MSI-H/dMMR vs TMB-H/MSS前列腺癌,免疫治疗效果如何?
2024-08-24 苏州绘真医学 苏州绘真医学
本研究表明,MSI-H/dMMR前列腺癌比TMB-H/MSS前列腺癌具有更高的TMB、indel和新抗原负荷,这些差异可能促使对ICB深刻而持久的反应。
微卫星高度不稳定/错配修复缺陷(MSI-H/dMMR)和高肿瘤突变负荷(TMB-H)前列腺癌患者可进行帕博利珠单抗治疗。本研究探索了 MSI-H/dMMR 和 TMB-H/微卫星稳定(MSS) 前列腺癌患者的基因特征、临床病程和对免疫检查点阻断疗法(ICB)的反应。对 2257 名前列腺癌患者的 3244 个肿瘤进行了测序。MSI-H/dMMR 前列腺癌定义为 MSIsensor 评分 ≥10 或 MSIsensor 评分在3 和 10 之间且具有有害 MMR 基因变异。TMB-H 定义为 ≥10 个突变/兆碱基。分析了 PSA50 和 RECIST 反应。使用log-rank检验比较总生存期和影像学无进展生存期(rPFS)。结果显示,63名(2.8%)为MSI-H/dMMR前列腺癌患者,33名(1.5%)为TMB-H/MSS前列腺癌患者。MSI-H/dMMR 和 TMB-H/MSS 肿瘤患者在诊断时更常表现为 5 级和转移性疾病。与 TMB-H/MSS 肿瘤相比,MSI-H/dMMR 肿瘤具有更高的 TMB、indel 和新抗原负荷。27 名 MSI-H/dMMR 患者和 8 名 TMB-H/MSS 患者接受了 ICB,这些患者均为POLE野生型。MSI-H/dMMR 患者中,约 45% 获得 RECIST 缓解,65% 获得 PSA50 反应。TMB-H/MSS 患者中,无人获得 RECIST 缓解,50% 获得 PSA50 反应。与接受免疫治疗的 TMB-H/MSS 患者相比,接受免疫治疗的 MSI-H/dMMR 患者的 rPFS 往往更长。MSI-H/dMMR缓解者和非缓解者在基因变异、TMB和MSIsensor评分方面不存在显著差异。本研究表明,MSI-H/dMMR前列腺癌比TMB-H/MSS前列腺癌具有更高的TMB、indel和新抗原负荷,这些差异可能促使对ICB深刻而持久的反应。

研究背景
微卫星高度不稳定/错配修复缺陷(MSI-H/dMMR)前列腺癌患者可进行帕博利珠单抗(PD-1单抗)治疗。2017 年,帕博利珠单抗MSI-H/dMMR泛癌种适应症获得加速批准,依据的是一项临床试验显示 149 名非结直肠癌患者的客观缓解率为 34%。2020 年,第二项泛癌种适应症获批,肿瘤突变负荷高的微卫星稳定(TMB-H/MSS)肿瘤患者也有资格接受帕博利珠单抗治疗。鉴于 MSI-H/dMMR 和 TMB-H/MSS 前列腺癌的罕见性以及这种癌症类型不常规检测微卫星不稳定性,很少有前列腺癌患者被纳入这些 FDA 泛癌种批准所依据的研究。因此,在 MSI-H 和 TMB-H/MSS 前列腺癌患者中使用免疫检查点阻断疗法(ICB)的决定受到较小病例系列和病例报告的指导。
MSI-H/dMMR 和 TMB-H/MSS 是相关但在生物学上不同的分子亚组。dMMR 肿瘤表现出有缺陷的 DNA 修复,导致高突变负荷,特征是在称为微卫星的 DNA 重复区域。然而,dMMR 只是 TMB-H 表型的一个原因,TMB-H 表型可能由 DNA 修复中的其他癌细胞内在缺陷引起,例如聚合酶 ε 催化亚基(POLE)突变,或暴露于突变诱导毒素(如替莫唑胺)所致。无论原因是什么,都假设高突变负荷会增加新抗原靶点数量引发免疫反应,这可由 ICB 增强。然而,目前,MSI-H/dMMR和TMB-H/MSS前列腺癌之间的分子差异,以及这些差异对免疫治疗敏感性的影响尚未得到系统研究。
本研究纳入了 2015 年 4 月 7 日至 2021 年 2 月 18 日期间在纪念斯隆凯特琳癌症中心接受治疗、进行 MSK-IMPACT 检测的前列腺癌患者,比较了 MSI-H/dMMR 和 TMB-H/MSS 前列腺癌的临床特征和基因图谱,还比较了免疫检查点抑制剂在MSI-H/dMMR和TMB-H/MSS前列腺癌患者中的临床获益。
研究结果
2257 名男性符合纳入标准(图 1A)。该队列中,63 名(2.8%)为MSI-H/dMMR 肿瘤患者,33 名(1.5%)为TMB-H/MSS 肿瘤患者,其余 2161 名(95.7%)为TMB-L/MSS 肿瘤患者。MSI-H/dMMR 样本定义为 MSIsensor 评分为 ≥10 或 MSIsensor 评分在 3 到 10 之间且四个错配修复基因(MSH2、MSH6、MLH1、PMS2)中有一个存在有害的胚系或体细胞突变。TMB-H/MSS 样本定义为 ≥10 个突变/Mb、MSIsensor 评分为 <3 或 MSIsensor 评分在 3 到 10 之间且不存在错配修复基因有害突变。在检测了多个肿瘤的患者中,没有患者一个肿瘤样本为 MSI-H/dMMR而另一个肿瘤样本为 TMB-H/MSS。在 MSI-H/dMMR 患者中,84%(53/63)的 MSIsensor 评分 ≥10,16%(10/63)的 MSIsensor 评分在 3 到 10 之间且有 MMR 基因存在有害突变。MSI-H/dMMR患者的TMB显著高于TMB-H/MSS患者(中位41,IQR 26-57 vs. 中位15,IQR 11-27,P < 0.01;图1B)。3 名患者存在致癌性 POLE 突变(2 名 P286R 和 1 名 V411M,TMB 分别为 183、34 和 169),均患有 MSS 肿瘤。三组在诊断时的年龄、种族和PSA方面相似(表1)。MSI-H/dMMR(62%)和TMB-H/MSS肿瘤(59%)中Gleason 5级的比例高于TMB-L/MSS肿瘤(40%,P < 0.001)。MSI-H/dMMR肿瘤患者(37%)相比TMB-H/MSS肿瘤(16%)但非TMB-L/MSS肿瘤(31%,P = 0.13)也更可能诊断为M1疾病。
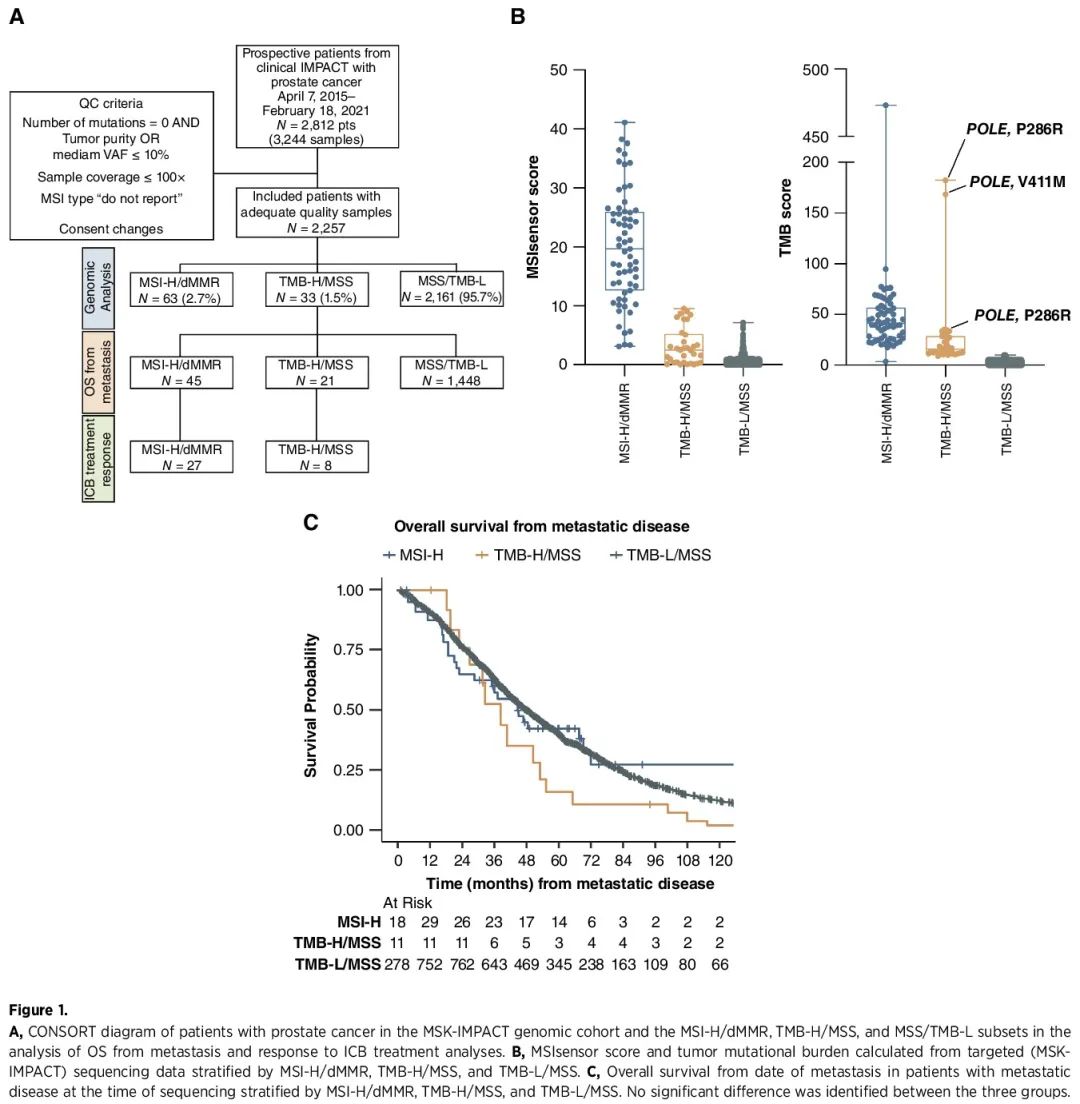
图1
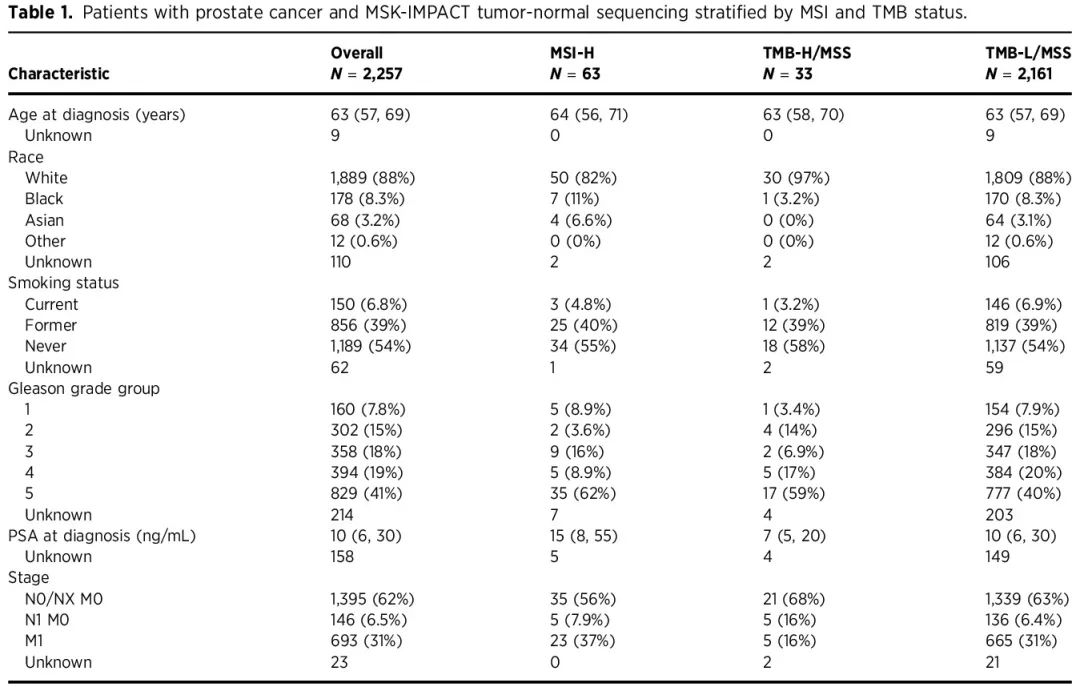
表1
在测序时有转移性疾病的患者中,45 名 MSI-H/dMMR 肿瘤患者、21 名 TMB-H/MSS 肿瘤患者和 1448 名 TMBL/MSS 肿瘤患者从转移性疾病日期算起的总生存期(OS)可评估。MSI-H/dMMR(中位45个月)、TMB-H/MSS(39个月)和TMB-L/MSS肿瘤(48个月;log-rank P=0.36;图1C)从转移性疾病日期算起的OS没有显著差异。
由于 FDA 分开批准帕博利珠单抗用于治疗 MSI-H/dMMR 和 TMB-H/MSS 肿瘤患者,我们试图比较 ICB 在这些分子定义的前列腺癌亚组中的疗效。27名MSI-H/dMMR患者和8名TMB-H/MSS前列腺癌患者接受ICB治疗,这些患者均为POLE野生型(图2A和B)。在 27 名接受 ICB 治疗的 MSI-H/dMMR 患者中,7 名在基线时没有 RECIST 可测量疾病。在 20 名 RECIST 可评估患者中,客观缓解率为 45%(95% CI 26%–66%),最佳影像学反应包括 2 名(10%)CR、7 名(35%)PR、5 名(20%)SD 和 3 名(15%)PD。3 名患者(15%)没有进行随访影像学检查来确定他们是否有反应,被算作无反应者。在 23 名 PSA 可评估 MSI-H/dMMR 患者中,15 名有 PSA50 反应(65%;图2C)。
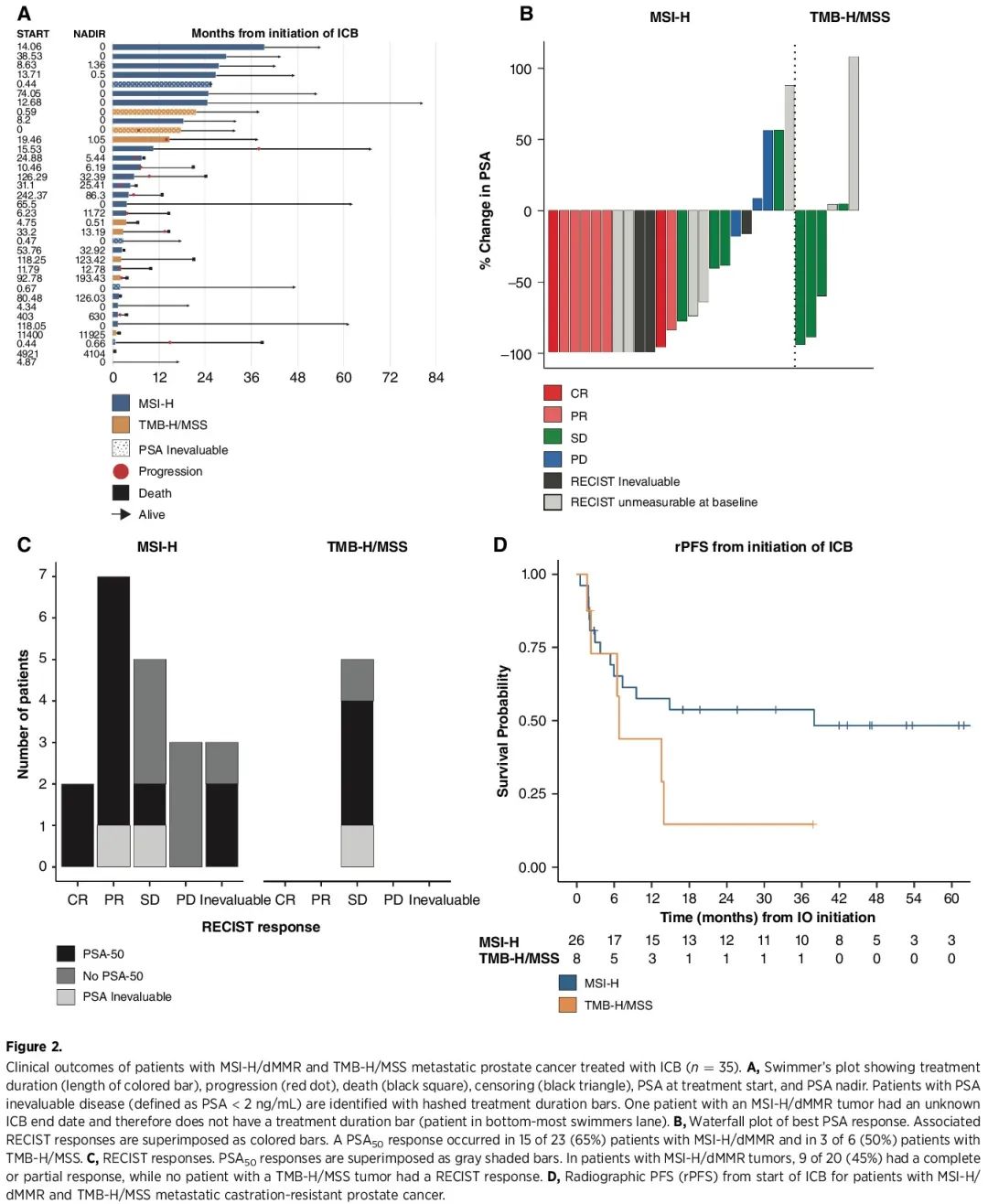
图2
在 8 名接受 ICB 治疗的 TMB-H/MSS 患者中,3名无法通过RECIST标准进行评估。所有 5 名可评估疾病患者的最佳反应均为 SD。6 名 PSA 可评估的患者中有 3 名(50%)获得 PSA50 反应。与接受ICB治疗的MSI-H/dMMR队列相比,TMB-H/MSS队列的中位rPFS往往较短(中位38个月 vs. 7个月;HR 2.13;95%CI,0.79-5.73;P = 0.14;图2D)。
鉴于 MSI-H/dMMR 和 TMB-H/MSS 前列腺癌在 ICB 临床获益方面的潜在差异,我们比较了 MSI-H/dMMR 和 TMB-H/MSS 肿瘤的基因图谱。我们比较了 63 个 MSI-H/dMMR 肿瘤与 33 个 TMB-H/MSS 肿瘤的靶向panel测序结果。在 MSI-H/dMMR 队列中,75% 的患者存在有害 MMR 基因变异,其中许多患者有多个 MMR 基因突变。MMR基因突变在TMB-H/MSS患者中很少见(6% MSH2,9% MSH6,3% MLH1,0% PMS2)(图3A)。值得注意的是,ERG融合在MSI-H/dMMR组中似乎很少见,仅存在于3%的病例,而TMB-H/MSS肿瘤中这一比例为12%(图3A),TMB-L/MSS肿瘤中为0.2%(P = 0.015)。我们观察到,MSI-H/dMMR肿瘤中JAK1突变率(56%)高于TMB-H/MSS肿瘤(15%,图3A)和TMB-L/MSS肿瘤(32%,P < 0.001),MSI-H/dMMR(17.5%)和TMB-H/MSS(21%)肿瘤中BRCA2/1突变率高于TMB-L/MSS肿瘤(5.2%)。
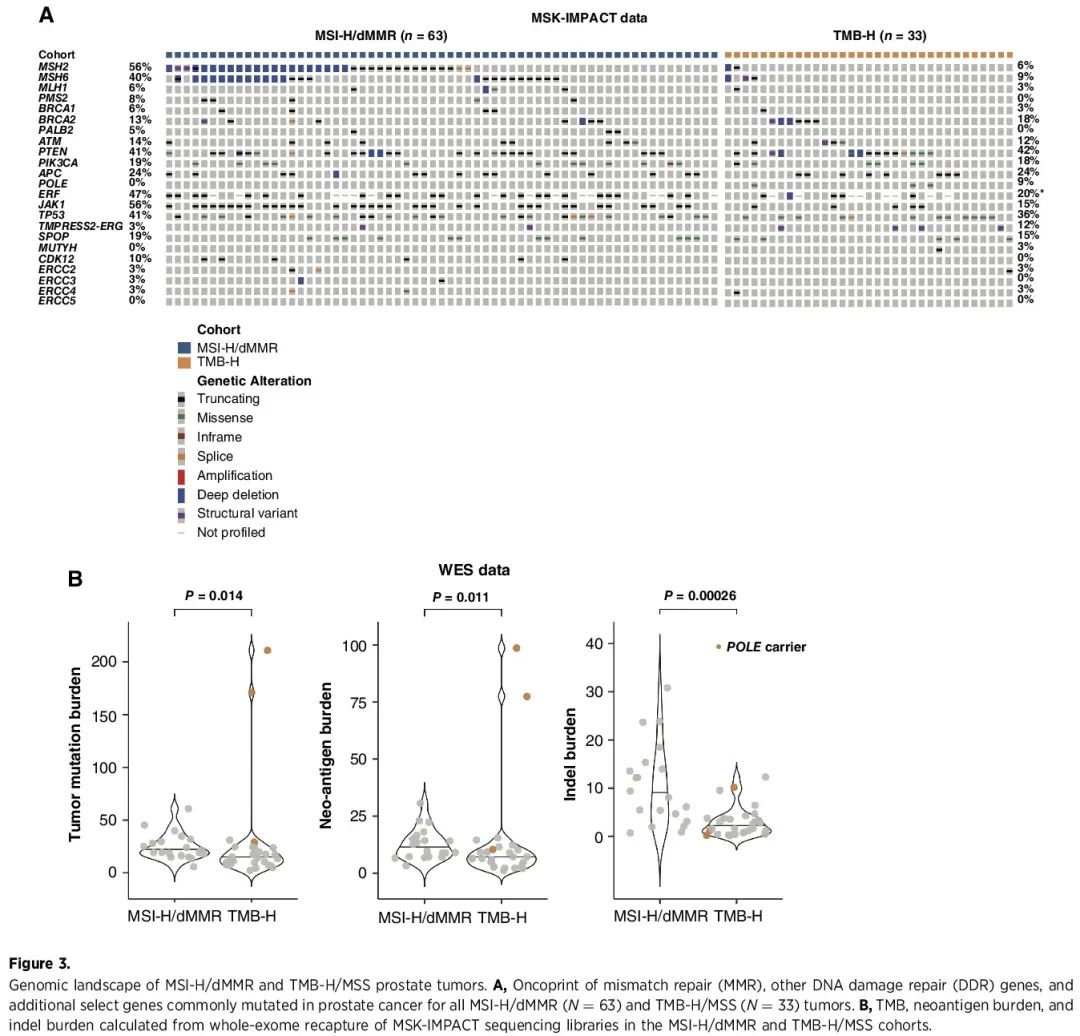
图3
在TMB-H/MSS亚群中未观察到重现性突变模式。鉴于TMB-H 组的致癌突变频率高于 TMB-L 组,我们开发了一个逻辑回归模型,以平均 TMB 作为每组的协变量,以减轻由基因长度引起的偏倚。在该测试中,所有基因均未显示出统计学意义。此外,我们没有观察到TMB-H组特异性新致癌基因或热点突变的出现。
为了更好地明确全面的突变特征,通过重新捕获 48 个肿瘤样本的 MSK-IMPACT 测序文库(MSI-H/dMMR n = 20;TMB-H/MSS n = 28)进行WES。然后分析 WES 数据来计算 MSIsensor 评分、TMB、移码负荷、indel负荷和新抗原负荷。与TMB-H/MSS肿瘤相比,MSI-H/dMMR肿瘤的中位TMB(27.39 vs. 25.02,P = 0.014)、新抗原负荷(11.1 vs. 6.8,P = 0.011)和indel负荷(8.7 vs. 2.1,P < 0.001)显著较高(图3B)。突变特征分析显示,除一个MSI-H/dMMR肿瘤外,其他每个MSI-H/dMMR肿瘤都有MMR单碱基替换特征,此外还有年长、APOBEC和烟草突变特征。TMB-H/MSS肿瘤的突变特征组成显著更异质,包括MMR、年长、APOBEC、POLE、烟草和致病性不明的其他突变特征。
为了识别其他潜在的 ICB 反应生物标志物,我们还将 MSI-H/dMMR 队列按缓解者(CR 和 PR,n = 9)和非缓解者(SD 和 PD,n = 8)分层,对基因变异、TMB 和 MSIsensor 评分进行探索性分析。在该亚群中,缓解者和非缓解者在基因变异频率、MSIsensor 评分和 TMB 方面没有统计学上的显著差异,但不能排除微小的差异。
我们队列中一位出色的缓解者说明了 MSI-H/dMMR 肿瘤亚群对 ICB 深刻和持久的反应效果(图 4)。该患者在46岁时被诊断为高危前列腺癌,接受了雄激素剥夺疗法(ADT)和外照射放疗,但2年后发展为转移性疾病。然后,他再次接受 ADT 治疗,此后 PSA 一直没有检测到,直到 6 年后出现 PSA 升高,发现新的 3.5 cm 右肾上腺转移灶。对肾上腺肿块进行活检,MSK-IMPACT 检测显示 MSI-H/dMMR 肿瘤,MSIsensor 评分为 26,TMB 为 18。鉴于肿瘤的 MSI-H/dMMR 表型,患者参加一项临床试验接受了 ICB 联合 IDO 抑制剂治疗。IDO 抑制剂在 13 周后停用,ICB 继续使用 2 年,患者PSA检测不到,获得CR。尽管又停用 ADT 2 年,仍然没有疾病迹象。之后他的 PSA 开始上升。转移性检查结果为阴性。前列腺 MRI 发现 PIRADS 5 病灶,靶向活检显示 5 级肿瘤。对该新前列腺肿瘤的 MSK-IMPACT 检测显示 TMB 较低(1.8),并且与之前的转移灶活检没有共同突变。对两个肿瘤都进行了 WES,MSS 前列腺肿瘤检出 372 个突变,MSI-H/dMMR 转移瘤检出 1209 个突变,有 251 个共同的突变,其中绝大多数(248)共同突变为非致癌性突变。只有3个突变被认为是致癌突变(ASXL1、MSH3 和 SESN1)。患者接受了机器人辅助前列腺切除术(pT3N0),术后 18 个月 PSA 检测不到。
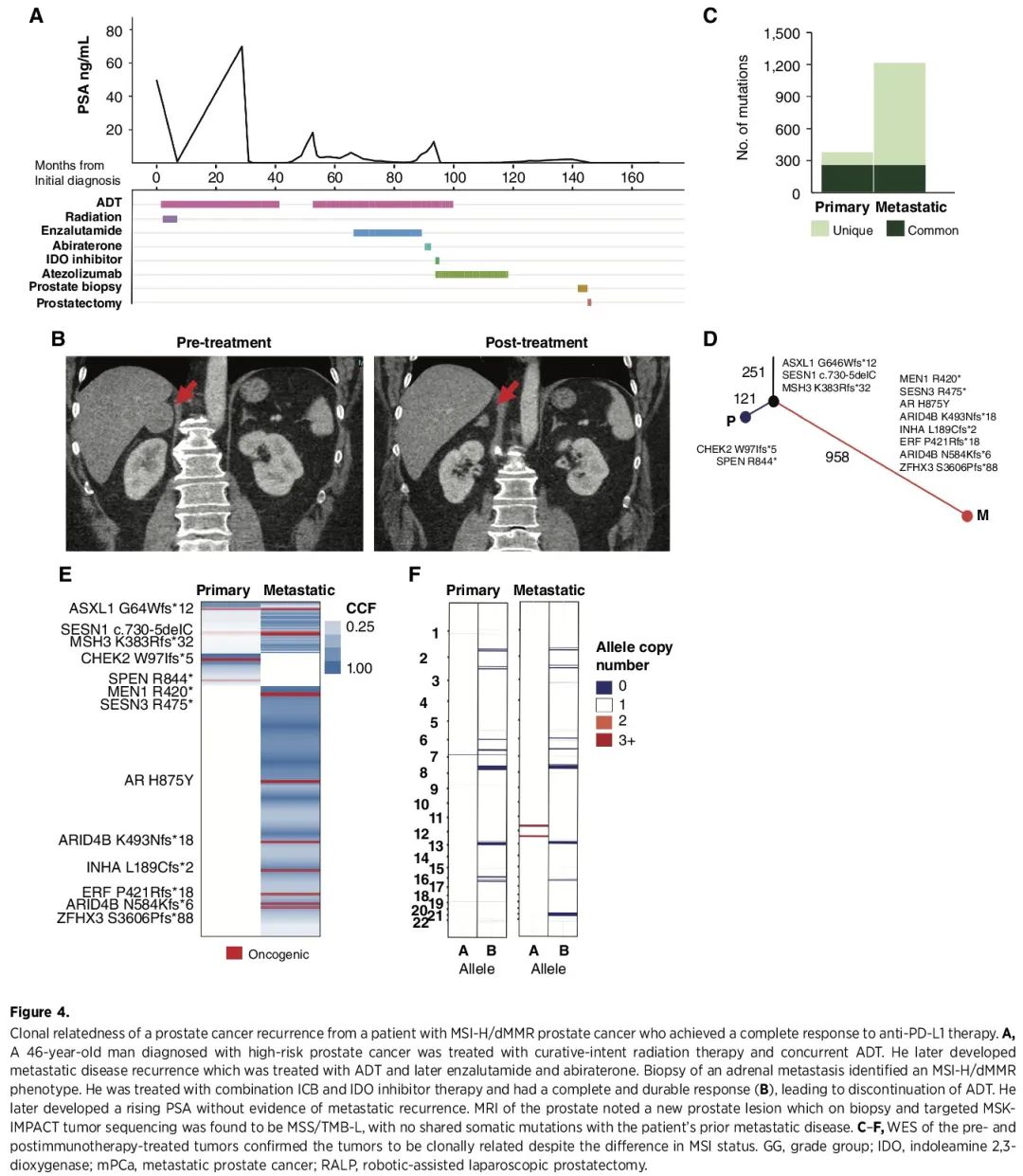
图4
讨 论
MSI-H/dMMR 和 TMB-H/MSS 前列腺癌是罕见的分子亚群,分别约占前列腺腺癌的 3% 和 2%。我们发现MSI-H/dMMR和TMB-H/MSS肿瘤更常为Gleason 5级前列腺癌。先前研究报告了 MSI-H 和 TMB-H 表型与Gleason 5级疾病的相关性,特别是对于 MSH2 缺失的肿瘤。
尽管 MSI-H/dMMR 和 TMB-H/MSS 肿瘤之间 ICB 治疗的科学原理相似,即高突变负荷,但很少有研究比较前列腺癌患者中这些分子定义的亚组之间的临床结果。我们的数据证实,MSI-H/dMMR 肿瘤患者对 ICB 可能产生深刻而持久的反应,而 TMB-H/MSS 肿瘤患者对 ICB 治疗没有表现出相同程度的持久性。我们比较了 MSI-H/dMMR 和 TMB-H/MSS 肿瘤的基因变异、突变特征、TMB、indel负荷和新抗原负荷,发现了indel和新抗原负荷的显著差异,这可能解释了 ICB 治疗临床获益的差异。值得注意的是,我们还发现,与 TMB-H/MSS 和 TMB-L/MSS 前列腺癌相比,MSI-H/dMMR 前列腺癌的 TMPRSS2-ERG 重排率较低。尽管据报道,靶向panel测序对ETS基因重排的捕获不足,但MSI-H/dMMR前列腺癌这种较低频率的TMPRSS2-ERG融合表明,其可能通过不同的致癌途径发生,不依赖于ETS重排导致的早期激活AR信号通路激活。同样,我们发现 MSI-H/dMMR 前列腺癌富含 JAK1 突变,这可能是因为 JAK1 内的微卫星片段导致基因突变增加。与TMB-L/MSS肿瘤相比,MSI-H/dMMR和TMB-H/MSS肿瘤的BRCA2/BRCA1突变率也较高,这可能是由于BRCA2/BRCA1基因体中突变负荷更高以及存在微卫星片段。突变较多可能代表与这些基因较大相关的亚克隆或乘客事件,而不是潜在可操作的致癌事件,这与先前研究报道的对 PARP 抑制剂反应较低一致。
大约一半的 MSI-H/dMMR 转移性前列腺癌患者经 ICB 治疗获得影像学缓解,大约三分之二的患者 PSA 下降 ≥50%。我们的研究结果与先前报告的缓解率在53%至65%之间基本一致。然而,我们队列与既往研究存在一些显著差异。在 Graham 等人和 Sena 等人的研究中,MSI-H 是根据多种因素组合定义的,包括 IHC 和使用各种测序平台的NGS测序(靶向外显子组、全外显子组和仅胚系)。此外,还使用了各种 dMMR 定义,包括 MMR 基因的任何有害变异以及 MSI不确定状态。在先前研究中,临床获益主要基于PSA治疗后变化,如最佳PSA反应和PSA50反应,而本研究PSA反应和影像学反应(根据RECIST 1.1标准)都评估了。
目前,很少有关于 ICB 用于 TMB-H/MSS前列腺癌患者的证据。FDA泛癌种批准所依据的研究仅招募了105名TMB ≥10突变/ Mb的患者,其中无人患有前列腺癌。将 TMB-H 作为预测生物标志物在所有癌症中的广泛应用可能是不合理的。例如,Valero等人的研究显示,TMB的预测能力因肿瘤类型和治疗背景而异。不幸的是,这些研究也没有包括前列腺癌患者。在另一项针对 TMB-H 肿瘤的泛癌种分析中,只有一名前列腺癌患者接受了 ICB 治疗,尽管 TMB 为 36 个突变/Mb,但该患者未获得缓解。其他研究发现,对 ICB 的反应可能与肿瘤浸润 CD8+ T 细胞和新抗原负荷有关。Sena 等人发现,在接受 ICB 治疗的 MSI-H/dMMR 前列腺癌患者中,变异类型,特别是移码突变的比例,与 PFS 相关。一项新的非随机研究表明,与标准化疗相比,TMB-H 肿瘤患者使用 ICB 的开始下一线治疗时间及OS 更好。我们发现与 TMB-H/MSS 肿瘤相比,MSI-H/dMMR 肿瘤的平均新抗原和indel负荷更高,而对 MSI-H/dMMR 队列中缓解者的分析未发现其他差异。测序类型(例如,靶向 vs. WES)可能会改变 TMB 结果,本研究使用肿瘤+正常配对样本分析来限制错误分类胚系变异的混杂效应。可能需要互补的分子检测方法(如 RNA 测序或其他新方法)来识别最有可能对 ICB 有反应的 MSI-H 肿瘤患者。
本研究是关于接受 ICB 治疗的 MSI-H/dMMR 和 TMB-H 患者的最大研究之一,但本研究有几个局限性。MSI-H/dMMR和TMB-H/MSS亚组的队列规模相对较小,因此统计功效受到限制。其次,这是一个真实世界数据集;因此,患者之间的影像学评估间隔和反应评估存在差异。另一个局限性是,本研究中的疗效评估没有采用 iRECIST 标准,该标准是专门为免疫疗法治疗肿瘤开发的,但目前前列腺癌工作组不推荐。我们没有使用 IHC 来确认 MMR 蛋白表达缺失,因为根据我们之前的研究,MSIsensor 评分 ≥10,以及在 MSIsensor 评分不确定的情况下MMR 基因变异,被认为是可靠的替代方法。测序的肿瘤来自原发性和转移性疾病部位,因为后者通常难获取。在Barata 等人的研究中,9名mCRPC患者通过液体活检确定 MSI-H 表型并接受 ICB 治疗,使用在治疗开始前不久收集的样本分析循环肿瘤 DNA 或许能够克服使用存档肿瘤样本的需要。最后,我们对 TMB-H/MSS 队列的基于 WES 的突变特征分析显示,这类患者具有异质性基因图谱,并且可能具有不同的分子发病机制,因此未来更大规模的研究可能会发现一些 TMB-H/MSS 肿瘤亚群,如具有 POLE 突变的亚群,对 ICB 的反应率较高。
最后,本研究中提到的病例强调了在前列腺癌患者通常十年或更长时间的病程中评估连续收集的肿瘤的克隆相关性的挑战,随着时间的推移,由于持续的突变诱导或干预性局部(放疗)或全身治疗,出现可操作的突变或突变特征(如微卫星不稳定性)。图 4 中的患者,比较肾上腺转移灶和第二原发灶的靶向测序数据,发现突变负荷和 MSI 状态存在差异并且没有共同的体细胞突变,提示为两个不同的原发肿瘤。然而,更广泛的WES检测在两个肿瘤中识别了251个共同的体细胞突变,提示两者起源于一个共同的前体。有可能这两个肿瘤都起源于转化的前体肿瘤细胞,也有可能共同的突变起源于良性前列腺组织内(体细胞嵌合体),然后通过单独的突变过程,产生了两个独立但克隆相关的前列腺癌。
总之,本研究结果表明,MSI-H/dMMR 肿瘤患者对 ICB 治疗可能产生完全缓解和持久反应,这支持 NCCN 关于局部晚期和转移性前列腺癌患者进行肿瘤体细胞检测以指导治疗选择的推荐。指南推荐对局部或低负荷转移性疾病患者进行放疗作为一种选择,在MSI-H 前列腺癌患者中,鉴于免疫疗法介导的疾病治愈后前列腺第二 MSS 肿瘤的风险,如本研究中的病例,ICB 治疗的深刻和持久的反应可能需要重新考虑根治性局部治疗来降低第二肿瘤的风险。
参考文献:
Lenis AT, Ravichandran V, Brown S, Alam SM, Katims A, Truong H, Reisz PA, Vasselman S, Nweji B, Autio KA, Morris MJ, Slovin SF, Rathkopf D, Danila D, Scher HI, Woo S, Vargas HA, Laudone VP, Ehdaie B, Reuter V, Arcila M, Berger MF, Viale A, Schultz N, Gopalan A, Donoghue MTA, Ostrovnaya I, Stopsack KH, Solit DB, Abida W. Microsatellite Instability, Tumor Mutational Burden, and Response to Immune Checkpoint Blockade in Patients with Prostate Cancer. Clin Cancer Res. 2024 Jul 1. doi: 10.1158/1078-0432.CCR-23-3403. Epub ahead of print. PMID: 38949888.


作者:苏州绘真医学
版权声明:
本网站所有注明“来源:梅斯医学”或“来源:MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明“来源:梅斯医学”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言










#前列腺癌# #免疫治疗# #MSI-H/dMMR# #TMB-H/MSS#
47