Nature Medicine:ProBio平台:前列腺癌精准治疗的新纪元
2024-08-22 生物探索 生物探索
ProBio试验通过实时分析循环肿瘤DNA,结合结果自适应平台设计,成功地探索了不同治疗方案在晚期去势抵抗性前列腺癌中的应用前景。
引言
前列腺癌(prostate cancer)是全球男性中最常见的癌症之一,也是导致男性癌症相关死亡的重要原因。特别是在晚期阶段,前列腺癌对去势治疗产生抵抗,进展为去势抵抗性前列腺癌(castration-resistant prostate cancer, CRPC)。CRPC患者通常需要系统性的全身治疗,以延缓疾病的进展并提高生存率。然而,即使经过治疗,许多患者的预后仍然较差,因此,如何为这类患者选择最优的治疗方案一直是临床实践中的重要挑战。
随着精准医学(precision medicine)和分子生物标志物(molecular biomarkers)在癌症治疗中的快速发展,研究人员越来越重视通过个体化治疗策略来改善患者预后。雄激素受体通路抑制剂(androgen receptor pathway inhibitors, ARPIs)和紫杉类药物(taxanes)是晚期前列腺癌治疗中的两大主要药物类别,ARPIs通过抑制雄激素受体信号传导途径,阻止前列腺癌细胞的生长,而紫杉类药物则通过抑制细胞分裂起到抗肿瘤作用。然而,不同患者对这些药物的反应并不相同,这使得精准治疗在该领域的应用显得尤为重要。
为了更好地理解不同治疗方案在不同基因突变背景下的效果,8月20日Nature Medicine的报道“Androgen receptor pathway inhibitors and taxanes in metastatic prostate cancer: an outcome-adaptive randomized platform trial”提供了新的研究数据。ProBio研究是首个针对前列腺癌的结果自适应平台试验(outcome-adaptive platform trial),通过贝叶斯框架(Bayesian framework)对患者的治疗效果进行评估。在这项研究中,研究人员对患者进行循环肿瘤DNA(circulating tumor DNA, ctDNA)和生殖系DNA分析,以根据特定的生物标志物对治疗方案进行个体化分配。该试验的设计不仅提供了一种筛选生物标志物与治疗组合的新方法,还通过实时调整试验中的随机分组,提高了试验的效率和患者治疗的精确性。
研究的主要终点是患者在治疗过程中不再获得临床收益的时间(time to no longer clinically benefitting, NLCB),这一指标可以有效衡量治疗对患者的长期效果。次要终点包括总生存期(overall survival)和严重不良事件(serious adverse events, SAEs)。根据ProBio的初步结果,ARPIs在未选择生物标志物群体(biomarker-unselected)的患者中表现出优于紫杉类药物的疗效,延长了大约50%的NLCB时间(中位数为11.1个月,相比紫杉类药物的6.9个月)和总生存期(中位数为38.7个月,而紫杉类药物为21.7个月)。尤其是在AR(单核苷酸变异/基因结构重排)阴性、TP53野生型以及TMPRSS2-ERG融合阳性的患者中,ARPIs的效果尤为显著,而对于TP53突变的患者,ARPIs和紫杉类药物之间的差异并不显著。
综上,ProBio试验通过实时分析循环肿瘤DNA,结合结果自适应平台设计,成功地探索了不同治疗方案在晚期去势抵抗性前列腺癌中的应用前景。这项研究不仅为临床医生提供了个体化治疗的证据支持,也为未来精准医学在前列腺癌领域的应用提供了新思路。

前列腺癌(prostate cancer)是全球范围内最常见的男性恶性肿瘤之一,尤其在晚期阶段,许多患者最终会发展为去势抵抗性前列腺癌(metastatic castration-resistant prostate cancer, mCRPC)。传统的治疗方案如雄激素受体通路抑制剂(androgen receptor pathway inhibitors, ARPIs)和紫杉类药物(taxanes)在治疗这类癌症时取得了不同程度的成功,但由于个体化差异,患者对这些治疗方法的反应存在显著差异。因此,针对不同生物标志物的精准治疗策略已成为提高治疗效果的关键方向。
ProBio平台是一项正在进行的多中心、随机、基于生物标志物驱动的结果自适应临床试验,旨在为mCRPC患者提供个体化治疗。研究通过分析患者的循环肿瘤DNA(circulating tumor DNA, ctDNA)和生殖系DNA,将患者根据生物标志物分为不同组别,从而比较ARPIs和紫杉类药物的疗效。ProBio采用了平台试验设计,这使得在同一试验中可以评估多个治疗方案和生物标志物组合的有效性。此外,ProBio还通过自适应随机化分配患者,使得表现出较好疗效的治疗方案能获得更多患者数据。
研究的主要终点是患者不再获得临床收益的时间(time to no longer clinically benefitting, NLCB),而次要终点包括总生存期(overall survival)和不良事件(adverse events, AEs)发生率 。
ProBio研究纳入了343名mCRPC患者,并在三个国家的24个临床中心进行。通过血液样本中的ctDNA分析,患者被分配到不同的治疗组。ctDNA分析主要评估了AR基因、TP53基因的变异及TMPRSS2-ERG基因融合等生物标志物。随后,患者被随机分配到雄激素受体抑制剂组或紫杉类药物组进行治疗。研究通过实时液体活检,追踪患者基因组变化 。
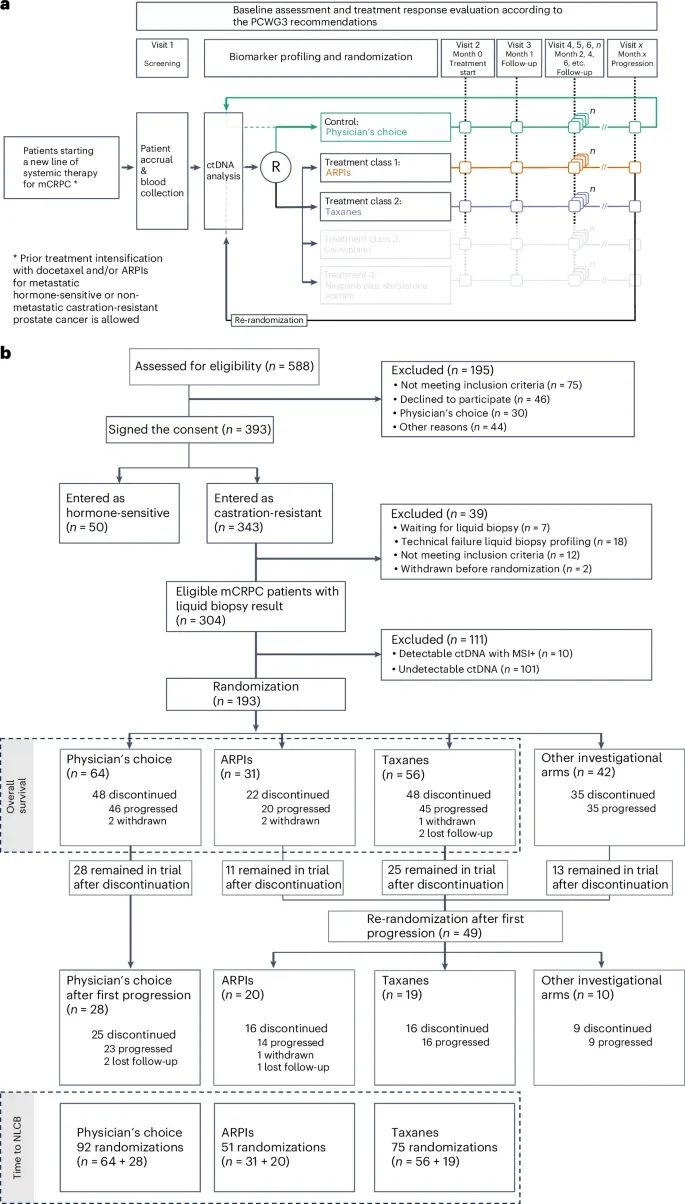
ProBio研究的整体设计(Credit: Nature Medicine)
患者筛选与随机化:最终有193名mCRPC患者完成了循环肿瘤DNA(ctDNA)分析并随机分配到不同的治疗组。部分患者因技术问题或不符合标准被排除。
治疗组与再随机化:图中展示了患者首次随机化后的治疗流程。随机分配到雄激素受体通路抑制剂(ARPI)组、紫杉类药物(taxane)组或医生选择组的患者,会根据疾病进展情况被重新随机化到不同的治疗组。透明灰色部分标注的是其他正在进行的实验性治疗组,这些数据尚未包含在当前报告中。
随访和结果评估:图中还列出了随访时间点和患者的治疗反应评估,这些是根据PCWG3(Prostate Cancer Clinical Trials Working Group)的建议进行的。所有患者的随访数据都会纳入分析,包括随机化后开始新治疗的患者。
NLCB时间的显著延长:研究显示,在未选择生物标志物的患者中,接受ARPI治疗的患者的NLCB时间显著延长,达到了中位数11.1个月,而接受紫杉类药物治疗的患者中位NLCB时间仅为6.9个月。特别是在AR(单核苷酸变异/基因结构重排,SNV/GSR)阴性且TP53基因未突变的患者中,ARPI治疗效果尤为显著 。
总生存期:在总生存期方面,ARPI治疗组的中位生存时间为38.7个月,而紫杉类药物组仅为21.7个月,表明ARPI在延长患者生存期方面具有显著优势 。
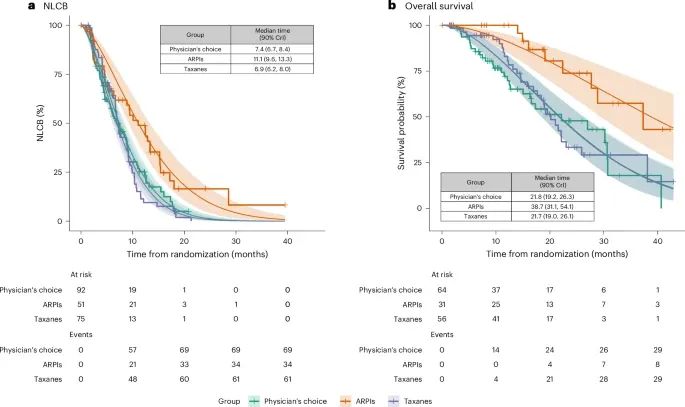
前列腺癌患者接受不同治疗方案的生存曲线和治疗效果评估(Credit: Nature Medicine)
NLCB时间(Time to NLCB):ARPI治疗组在NLCB时间上表现显著优于紫杉类药物组和医生选择组。具体而言,ARPI治疗组的中位NLCB时间为11.1个月,明显长于紫杉类药物组(6.9个月)和医生选择组(7.4个月)。这一结果表明,ARPI在延缓疾病进展方面具有更好的效果,特别是对于未选择生物标志物的患者。
总生存期(Overall Survival):ARPI治疗组的总生存期显著优于其他组别。具体而言,ARPI治疗组的中位生存时间为38.7个月,而紫杉类药物组为21.7个月,医生选择组为21.8个月。这个结果显示,ARPI治疗不仅在延长NLCB时间方面表现优异,同时在总生存期上也具有显著的优势。
不良事件(AEs):紫杉类药物组的不良事件发生率高于ARPI组,尤其是治疗相关的不良事件发生率显著增加。紫杉类药物的治疗更容易引发严重感染、胃肠道问题和心血管问题 。
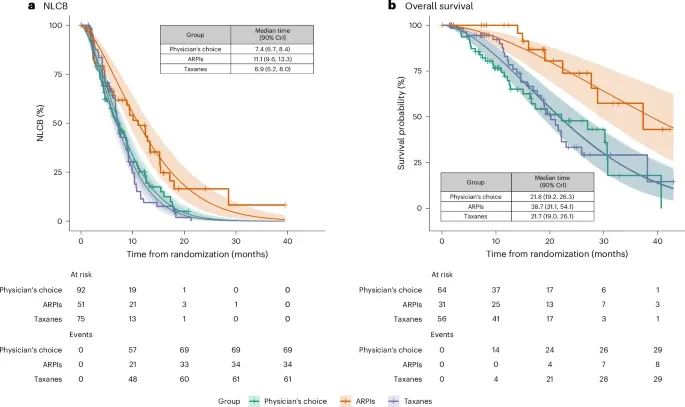
患者根据治疗方案和生物标志物状态(阳性或阴性)的生存曲线(Credit: Nature Medicine)
AR(SNV/GSR)阴性和TP53野生型患者:在这组患者中,雄激素受体通路抑制剂(ARPI)治疗的效果优于紫杉类药物(taxane)。生存曲线显示,接受ARPI治疗的患者在时间到NLCB(不再获得临床收益)方面有更长的生存时间。
TP53突变患者:对于TP53突变的患者,ARPI和紫杉类药物的治疗效果没有显著差异。生存曲线表现出相似的结果,这表明这类患者对这两种治疗的反应相近。
TMPRSS2-ERG融合阳性患者:在TMPRSS2-ERG基因融合阳性的患者中,ARPI治疗的效果显著优于紫杉类药物。这一组的生存曲线显示,ARPI显著延长了NLCB时间。
ProBio研究的初步结果表明,ARPI治疗在ctDNA阳性的mCRPC患者中表现出优于紫杉类药物的疗效,特别是在AR(SNV/GSR)阴性且TP53未突变的患者中。通过液体活检,研究能够实时跟踪患者的基因变化,并相应地调整治疗方案,这为前列腺癌的精准治疗提供了重要依据。未来,ProBio的研究成果可能会进一步推动癌症治疗个体化进程,为患者提供更为个性化的治疗方案 。
通过ProBio平台,研究人员不仅能够评估治疗方案的疗效,还能够筛选出最适合不同生物标志物患者的治疗组合。随着更多数据的积累,该研究有望为前列腺癌的精准治疗开辟新的方向,并为临床实践提供更为有力的证据支持 。
参考文献
De Laere B, Crippa A, Discacciati A, Larsson B, Persson M, Johansson S, D'hondt S, Bergström R, Chellappa V, Mayrhofer M, Banijamali M, Kotsalaynen A, Schelstraete C, Vanwelkenhuyzen JP, Hjälm-Eriksson M, Pettersson L, Ullén A, Lumen N, Enblad G, Thellenberg Karlsson C, Jänes E, Sandzén J, Schatteman P, Nyre Vigmostad M, Olsson M, Ghysel C, Sautois B, De Roock W, Van Bruwaene S, Anden M, Verbiene I, De Maeseneer D, Everaert E, Darras J, Aksnessether BY, Luyten D, Strijbos M, Mortezavi A, Oldenburg J, Ost P, Eklund M, Grönberg H, Lindberg J. Androgen receptor pathway inhibitors and taxanes in metastatic prostate cancer: an outcome-adaptive randomized platform trial. Nat Med. 2024 Aug 20. doi: 10.1038/s41591-024-03204-2. Epub ahead of print. PMID: 39164518.
https://www.nature.com/articles/s41591-024-03204-2
作者:生物探索
版权声明:
本网站所有注明“来源:梅斯医学”或“来源:MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明“来源:梅斯医学”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言










#前列腺癌# #去势抵抗性前列腺癌# #紫杉类药物# #雄激素受体通路抑制剂#
48