Dermatol Ther:Bimekizumab治疗日本斑块型银屑病患者的疗效和安全性研究
2023-01-20 医路坦克 MedSci原创
斑块型银屑病是一种慢性、免疫介导的炎症性疾病,本研究对BE VIVID日本患者亚人群的分析旨在评估bimekizumab在这些患者中的疗效。
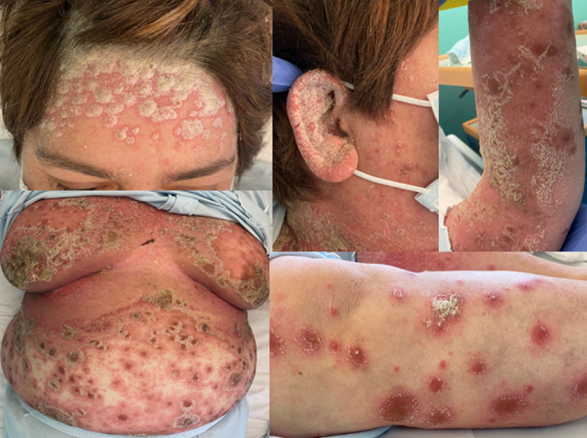
 斑块型银屑病是一种慢性、免疫介导的炎症性疾病,其特征是明显的皮肤损害,可呈鳞片状、厚厚的,有时还会瘙痒,并造成严重的疾病负担,影响患者的生活质量。此外,银屑病还与多种合并症的风险增加有关。
斑块型银屑病是一种慢性、免疫介导的炎症性疾病,其特征是明显的皮肤损害,可呈鳞片状、厚厚的,有时还会瘙痒,并造成严重的疾病负担,影响患者的生活质量。此外,银屑病还与多种合并症的风险增加有关。
白介素17A和白介素17F在银屑病和银屑病关节炎的发病机制中起中心作用,两者在银屑病皮损中都有过表达。IL-17A和IL-17F有50%的结构相似性,形成同源和异源二聚体,具有重叠的促炎功能。日本皮肤病协会推荐对斑块型银屑病患者进行生物治疗,包括针对IL17途径的治疗,这些患者对标准的系统治疗没有足够的反应,并影响到C10%的身体表面积(BSA),或者有难治性皮肤或关节症状,对系统治疗难以治愈,并显著影响生活质量
针对IL-17途径的常见生物疗法抑制IL-17或针对IL-17受体复合体。抗IL-17A药物已证明对中到重度银屑病患者有效;然而,近三分之一的患者在5年内因无效、原发或继发失败、感染或其他原因而停止治疗,需要额外的治疗选择。此外,在选择生物疗法时,其他因素可能会影响患者的偏好,患者可能会优先考虑不同的因素。一项对395名日本银屑病患者的调查报告称,患者更喜欢长期和早期疗效、停药后持续有效、严重感染风险低等因素的药物。
Bimekizumab是一种人源化的免疫球蛋白G1抗体,选择性地与IL-17A和IL-17F高亲和力结合,抑制下游信号转导。在4个3/3b期临床试验中,Bimekizumab在中到重度斑块型银屑病患者中显示出比安慰剂、阿达利单抗、Seckinumab和Ustekinumab更好的临床疗效。最近,Bimekizumab在日本被批准用于治疗斑块型银屑病、泛发性脓疱型银屑病和对现有治疗无效的银屑病红皮病
考虑到日本与西方患者人群在疾病流行病学和严重程度上的差异,本研究对BE VIVID日本患者亚人群的分析旨在评估bimekizumab在这些患者中的疗效。PASI绝对值与PASI改善百分比以及其他疗效和安全性结果一起报告。
方法:在全球范围内,患者被随机分成三组,分别接受Bimekizumab 320 mg每4周(Q4W)、Ustekinumab(45/90 mg体重在基线和4周,然后每12周)或安慰剂(Q4W至16周,然后Bimek-izumab 320 mg Q4W)。疗效终点包括第16周银屑病面积和严重程度指数(PASI)90和调查者总体评估(IGA)0/1,以及其他结果[PASI 100、PASI 75、IGA 0、皮肤病生活质量指数(DLQI)0/1、绝对PASI、头皮IGA、银屑病症状和影响测量(P-SIM)反应]。进行了安全性分析。

日本患者亚人群试验概况。第16周和第52周的数字表示每个治疗组中到那时为止完成研究的患者数量,这些患者的数据被考虑纳入分析。患者在第16周从安慰剂切换到bimekizumab 320 mg Q4W。Q4W:每4周

第16周在日本患者亚群中的疗效。A为PASI 90,b为IGA 0/1,C为PASI 100,D为0,DLQI为0/1。DLQI 0/1皮肤病生活质量指数评分为0或1,表明银屑病对患者的生活没有影响;IGA 0/1调查者的全球评估评分为0(无障碍)或1(几乎无障碍),与基线相比,调查者全球评估中的C2类别改善,5分量表评分,NRI无反应者归责,OC观察病例,PASI XX C XX在银屑病区域和严重程度指数评分较基线改善XX%,PTS患者,每4周Q4W
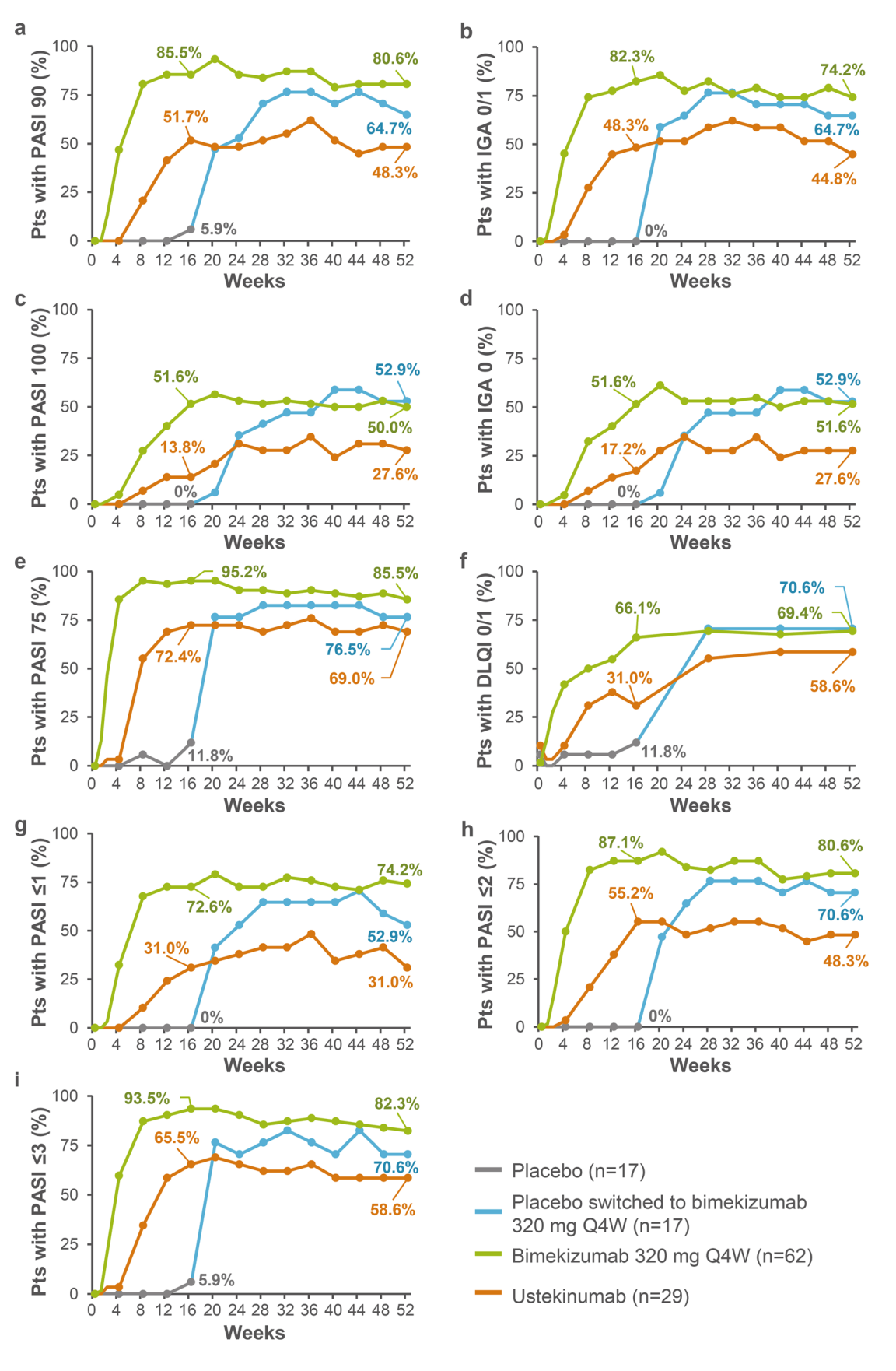
随时间推移(0-52周)在日本患者亚群(NRI)中的疗效。A PASI 90反应;b IGA 0/1反应;c PASI 100反应;d IGA 0反应;e PASI 75反应;f DLQI 0/1反应;g PASI B 1反应;h PASI B 2反应;I PASI B 3反应。在第16周,接受安慰剂治疗的患者改用比卡珠单抗320 mg,q4w。由于无响应而导致数据丢失。DLQI 0/1皮肤病生活质量指数评分为0或1,表明银屑病对患者的生活没有影响;IGA 0/1调查者全球评估评分为0(清晰)或1(几乎清晰),调查者全球评估中C2类别较基线有所改善,按5分量表评分,NRI无反应者归责,PASI X绝对银屑病面积和严重程度指数B X,PASI XX C XX%银屑病面积和严重程度指数评分,PTS患者,每4周一次
结果:共有108名日本随机患者(bimekizumab:62例;ustekinumab:29例;安慰剂:17例)。在16周时,接受bimekizumab治疗的患者的临床反应高于ustekinumab和安慰剂(PASI90:85.5%比51.7%和5.9%;IgA0/1:82.3%比48.3%和0.0%)。在超过52周的时间里,服用Bimekizumab的患者的临床反应保持了改善,包括患者在第16周时从安慰剂转为服用。总体而言,日本患者的安全性与在全球人群中观察到的一致。
结论:与ustekinumab和安慰剂相比,Bimekizumab具有更好的临床疗效,并且在日本患者中耐受性良好。
作者:医路坦克
版权声明:
本网站所有注明“来源:梅斯医学”或“来源:MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明“来源:梅斯医学”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言