最新Nature NBE:可治疗肠炎的结肠特异性免疫生态位
2023-12-10 BioMed科技 BioMed科技
该工程化生态位将降低自身免疫并诱导耐受,从而解决溃疡性结肠炎症状。因此,该生态位可恢复稳态组织环境,允许隐窝中的肠干细胞通过替换垂死的结肠上皮细胞来修复受损的结肠上皮。
溃疡性结肠炎
溃疡性结肠炎是一种慢性自身炎症性肠病,其中自身反应性T细胞和巨噬细胞攻击结肠粘膜中的健康结肠上皮细胞,导致慢性炎症和溃疡。溃疡性结肠炎的症状会导致危及生命的并发症,如肠穿孔和中毒性巨结肠。尽管溃疡性结肠炎的病因尚不完全清楚,但人们普遍认为它是由基因突变、免疫系统功能异常和环境因素引发的,而且目前为止仍然无法治愈。目前的治疗策略通常包括免疫抑制疗法和手术切除。然而,长期免疫抑制具有显著的副作用,包括感染和癌症发展,并且手术具有高发病率和长期健康并发症风险。因此,溃疡性结肠炎的治疗迫在眉睫。
抗原特异性免疫治疗
抗原特异性免疫治疗建立了疾病特异性和抗原特异性的免疫耐受性,是治疗自身免疫性疾病的一种新型免疫抑制方法。研究已经表明,抗原特异性免疫耐受可以通过在免疫调节剂(如免疫抑制免疫检查点分子和促调节细胞因子)存在的情况下向T细胞呈递疾病特异性抗原来实现。然而,这种方法对没有常见可识别自身抗原的自身炎症性疾病(如溃疡性结肠炎)是无效的。为了解决这一阻碍,潜在的解决方案是在器官样组织微环境中存在免疫调节剂的情况下,将自身免疫靶向的整个细胞呈递给自身反应性T细胞。
可注射免疫生态位
因此,在本研究中,德克萨斯大学西南医学中心Andrew Z. Wang和Kin Man Au等人报道了一种含有免疫抑制微环境的可注射结肠特异性免疫生态位,以用于治疗溃疡性结肠炎。这种生态位将与免疫原性皮下环境中的自身反应性T细胞相互作用,参与溃疡性结肠炎的发病机制,耗尽和抑制自身反应性T细胞,并极化促炎M1巨噬细胞。此外,该工程化生态位将降低自身免疫并诱导耐受,从而解决溃疡性结肠炎症状。因此,该生态位可恢复稳态组织环境,允许隐窝中的肠干细胞通过替换垂死的结肠上皮细胞来修复受损的结肠上皮。相关工作以“An injectable subcutaneous colon-specific immune niche for the treatment of ulcerative colitis”为题发表在Nature Biomedical Engineering。

【文章要点】
一、器官特异性免疫生态位的生物工程化构建
在该研究中,作者开发了皮下注射免疫生态位,它可以同时使自身反应性CD8+T细胞无能,并通过多种免疫抑制途径将促炎激活的M1巨噬细胞极化为抗炎M2巨噬细胞。该免疫生态位是由结肠上皮细胞、脱细胞结肠细胞外基质(ECM)和纳米纤维(NFs)改造组合而成(图1)。作者首先通过两步可逆加成-断裂链转移(RAFT)聚合,合成了聚(2-(甲基丙烯酰氧基)乙基磷酰胆碱)-聚(甲基丙烯酸2-羟丙基)(PMPC–PHPMA)二嵌段共聚物并在原位自组装成杆状纤维状胶束。以此NF作为支架,作者用数种免疫药物对NFs进行功能化。在这一免疫生态位中,结肠上皮细胞和脱细胞的结肠ECM再现类结肠微环境,以吸引溃疡性结肠炎中涉及的自身反应免疫细胞并与之相互作用。同时,脱细胞的结肠ECM也起到了仓库的作用,可逐渐释放促调节生长因子和细胞因子,以调节自身反应性T细胞和巨噬细胞的激活。免疫抑制分子功能化的NFs则被设计为通过结合免疫检查点分子和其他免疫抑制剂,调节多种免疫抑制信号通路的同时可使自身反应性T细胞无能并使巨噬细胞极化。
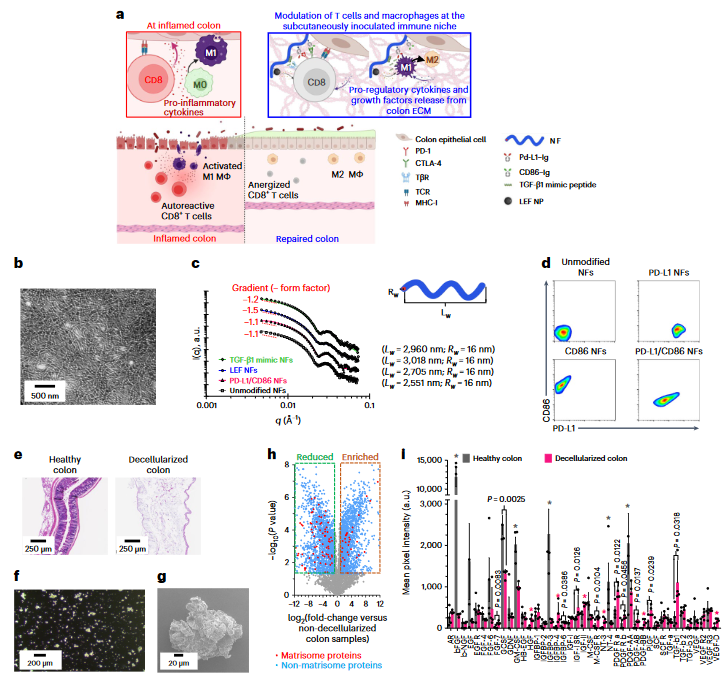
图1 免疫抑制性组合型结肠特异性免疫生态位的构建与表征
在这些功能化NF中,程序性死亡配体1(PD-L1)可触发抑制性PD-1/PD-L1免疫检查点途径,并诱导活化的M1巨噬细胞极化为交替活化的M2巨噬细胞;分化簇86(CD86)则可在活化的CD8+T细胞中触发免疫抑制细胞毒性T淋巴细胞相关蛋白4(CTLA-4)途径;免疫调节药物来氟米特(LEF)可以抑制活化的T细胞和巨噬细胞增殖;促调节细胞因子转化生长因子β1(TGF-β1)模拟肽则可以与转化生长因子受体II受体结合以抑制CD8+T细胞的活化,并使活化的M1巨噬细胞极化为M2巨噬细胞(图2)。

图2 组合型NF的作用机制
二、治疗溃疡性结肠炎和预防结直肠癌
体外研究表明,组合型NFs有效地使CD8+T细胞失能,并诱导经典活化的M1巨噬细胞极化为交替活化的M2巨噬细胞。在结肠ECM存在的情况下,由于其保留的促调节生长因子和细胞因子,免疫抑制效果得到了进一步改善。动物实验证实,组合型生态位的皮下注射治疗可以改善结肠炎症状,并加速隐窝中的结肠上皮干细胞修复上皮损伤。用上述四种不同类型的免疫抑制剂设计的组合生态位制剂的治疗效果最为显著。组织学研究证实,结肠特异性免疫生态位治疗,特别是组合型生态位治疗显著减少了绒毛中凋亡的结肠上皮细胞的数量,并保持了隐窝中结肠上皮干细胞的活力。除溃疡性结肠炎外,作者还证明,在已建立的小鼠模型中,组合生态位治疗可以预防结肠炎相关结直肠癌癌症的发展(图3)。
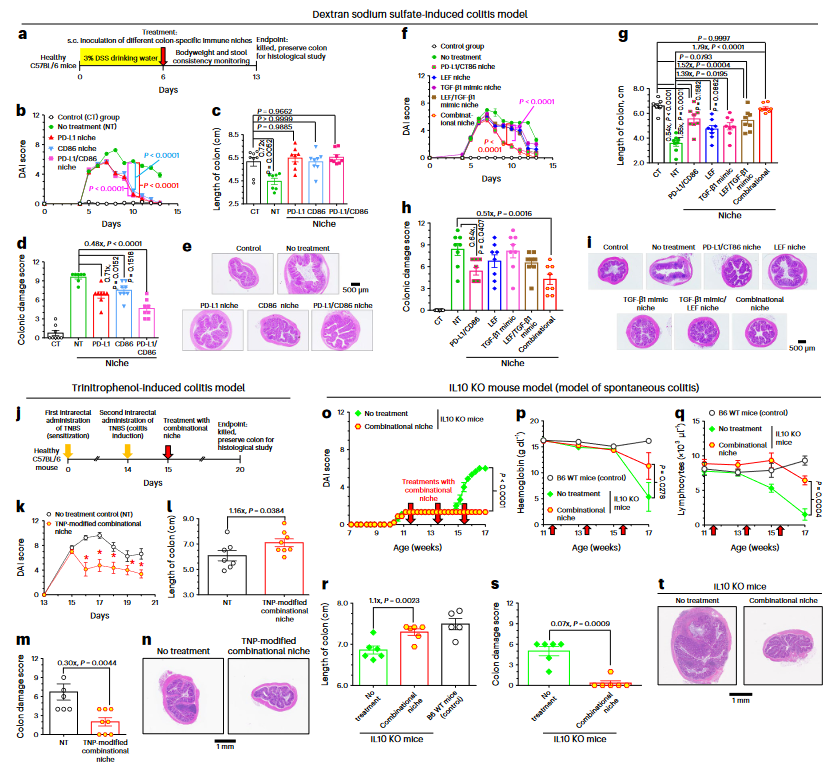
图3 治疗肠炎
结论与展望
在该项研究中,作者也提出了此类策略的局限性:一是需要结肠上皮的自体来源来设计结肠特异性免疫生态位,这需要对患者进行内镜活检,同时存在并发症风险和经济成本;另一个潜在的局限性是结肠特异性免疫生态位治疗不能完全捕捉溃疡性结肠炎的微生物组相关生物学,而微生物组在溃疡性结肠炎的发病机制中起着未知而重要的作用;最后,作者也意识到,这种生态位具有成分上的高度复杂性,因此在未来的工作需要简化配方以便于制造。
原文链接:
https://www.nature.com/articles/s41551-023-01136-9
作者:BioMed科技
版权声明:
本网站所有注明“来源:梅斯医学”或“来源:MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明“来源:梅斯医学”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言







#溃疡性结肠炎# #结肠特异性免疫生态位#
82