FDA和EMA已接受bimekizumab治疗银屑病的市场营销申请
2020-09-28 Allan MedSci原创
美国食品药品监督管理局(FDA)和欧洲药品管理局(EMA)均已接受UCB制药公司的银屑病治疗药物bimekizumab的市场营销申请。
美国食品药品监督管理局(FDA)和欧洲药品管理局(EMA)均已接受UCB制药公司的银屑病治疗药物bimekizumab的市场营销申请。UCB正在美国和欧盟寻求批准bimekizumab治疗中度至重度斑块状银屑病。

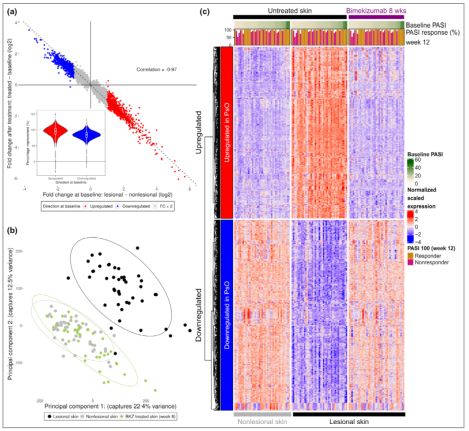
两项批准都是基于UCB牛皮癣全球III期临床开发计划的数据。所有的III期研究均达到了主要终点:与接受安慰剂和AbbVie Humira(阿达木单抗)治疗的患者相比,接受bimekizumab治疗的患者在第16周的皮肤清除率更高。
此外,两项研究显示,bimekizumab优于包括Janssen的Stelara(ustekinumab)和AbbVie的Humira(阿达木单抗)在内的现有生物疗法。除了作为银屑病治疗方法外,UCB目前正在研究将bimekizumab作为银屑病关节炎、强直性脊柱炎、非放射线轴性脊柱关节炎和化脓性汗腺炎的潜在疗法。
UCB执行副总裁Emmanuel Caeymaex说:“经过一系列积极的III期数据,我们很高兴地宣布,美国FDA和EMA已接受我们的申请,将bimekizumab用作银屑病的潜在新疗法”。
原始出处:
作者:Allan
版权声明:
本网站所有注明“来源:梅斯医学”或“来源:MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明“来源:梅斯医学”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言











#MEK#
83
#mAb#
61
#EMA#
73