LYNPARZA(olaparib)联合贝伐单抗一线治疗HRD阳性晚期卵巢癌:已获FDA首肯
2020-05-11 Allan MedSci原创
阿斯利康(AstraZeneca)和默克(Merck)今日宣布,美国食品药品监督管理局(FDA)已批准LYNPARZA(olaparib)联合贝伐单抗一线维持治疗晚期上皮性卵巢癌。
阿斯利康(AstraZeneca)和默克(Merck)今日宣布,美国食品药品监督管理局(FDA)已批准LYNPARZA(olaparib)联合贝伐单抗一线维持治疗晚期上皮性卵巢癌、输卵管癌或原发性腹膜癌,这些患者对一线铂类化学疗法有完全或部分反应,且BRCA基因为同源重组缺陷(HRD)阳性状态。
这项批准是基于PAOLA-1 III期试验的387例HRD阳性肿瘤患者的数据分析,该研究表明LYNPARZA联合贝伐单抗可将疾病进展或死亡的风险降低67%(HR 0.33,95%CI 0.25-0.45)。对于HRD阳性的晚期卵巢癌患者,联合治疗将中位无进展生存期(PFS)提高到37.2个月,而单独使用贝伐单抗仅提高到17.7个月。
然而,与单独使用贝伐单抗的患者相比,接受LYNPARZA联合贝伐单抗的患者发生静脉血栓栓塞的可能性更高(5.0%比1.9%)。LYNPARZA联合贝伐单抗组中有54%的患者中断剂量,41%的患者降低剂量,20%的患者因不良反应终止治疗。
原始出处:
作者:Allan
版权声明:
本网站所有注明“来源:梅斯医学”或“来源:MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明“来源:梅斯医学”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言







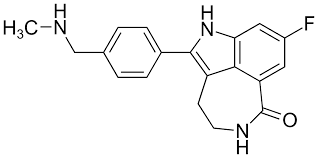



#olaparib#
36
#LAP#
35
#APA#
44
#晚期卵巢癌#
59
#贝伐#
36