【论著】| 探究不良病理学特征数量对Ⅰ~Ⅲ期结直肠癌复发风险分层的指导作用:对9 875例病例的回顾性队例研究
2024-07-20 中国癌症杂志 中国癌症杂志
不良病理学特征数量是Ⅰ~Ⅲ期结直肠癌患者无复发生存的独立预后因素,将其作为多分类变量与年龄、pT、 pN分期联合具有良好预后分层、复发分层效力,有望指导临床治疗。
[摘要] 背景与目的:根据目前共识,不良病理学特征仅与Ⅱ期结直肠癌的辅助治疗相关。作为重要的预后影响因素,我们进一步挖掘基于这些不良病理学特征来识别潜在复发和指导临床治疗的可能性。方法:本研究是回顾性队列研究。回顾性分析2008年—2018年复旦大学附属肿瘤医院大肠外科行手术治疗的结直肠癌患者的临床数据。本研究经复旦大学附属肿瘤医院伦理委员会批准(审批号:050432-4-2108*),本研究符合赫尔辛基宣言。纳入的9 875例患者中,男性5 859例,女性4 016例,年龄[M(IQR)]60(16)岁(范围:16~94岁)。中位随访时间1 779.0(95% CI:1 750.1~1 807.9)d。生存率分析采用Kaplan-Meier法和log-rank检验,使用Cox多因素分析影响结直肠癌总生存(overall survival,OS)、无病生存(disease-free survival,DFS)和5年无复发生存(recurrence-free survival,RFS)的独立危险因素,构建列线图模型来对患者预后进行评估、分层。本队列研究严格遵循《加强流行病学中观察性研究报告质量》(Strengthening the Reporting of Observational Studies in Epidemiology,STROBE)指南中的各项条目。结果:根据合并的不良病理学特征数量进行分组,分为5组:Hr_0组(0 incorporating high-risk pathological features,0个不良病理学特征)、Hr_1组(1 incorporating high-risk pathological features)、Hr_2组(2 incorporating high-risk pathological features)、Hr_3组(3 incorporating high-risk pathological features)、Hr_4组(≥4 incorporating high-risk pathological features)。Kaplan-Meier生存曲线结果提示,不同分组之间的OS、DFS和RFS差异均有统计学意义(P<0.001);针对Ⅱ期结直肠癌进行亚组分析,不同Hr分组OS、DFS和RFS的生存曲线不同分组之间出现重叠,相较于全部病例,不同分组的生存差异明显减小,提示伴有单个不良病理学特征的Ⅱ期肠癌患者可能从辅助化疗中获益;RFS的独立预后危险因素包括:年龄、pT分期、pN分期和Hr分组;OS、DFS和RFS的生存曲线提示Hr_4组预后显著差于Ⅲc期患者;分别有5.2%和14.1%的Ⅰ期和Ⅱ期患者合并2个及以上不良病理学特征(Hr分组≥2)。最后,纳入上述结直肠癌预后独立危险因素构建列线图模型。校准曲线显示实际观察与列线图预测之间具有良好的一致性,决策曲线分析(decision curve analysis,DCA)显示本研究所构建的模型在复发分层中具有良好的效能。结论:不良病理学特征数量是Ⅰ~Ⅲ期结直肠癌患者无复发生存的独立预后因素,将其作为多分类变量与年龄、pT、 pN分期联合具有良好预后分层、复发分层效力,有望指导临床治疗。
[关键词] 结直肠癌;复发;不良病理学特征;预测模型
[Abstract] Background and purpose: According to current consensus, adverse high-risk pathological features are only associated with adjuvant therapy for stage Ⅱ colorectal cancer (CRC). As important prognostic factors, we further explored the possibility of identifying patients with potential recurrence and poor prognosis based on these incorporating high-risk pathological features. Methods: This is a cohort study. A retrospective analysis was conducted on clinical data of CRC patients who underwent surgical treatment at the Second Department of Colorectal Surgery, Fudan University Affiliated Shanghai Cancer Center from 2008 to 2018. This study was approved by the Ethics Committee of the Fudan University Shanghai Cancer Center (approval No.: 050432-4-2108*), and the study complies with the Declaration of Helsinki. A total of 9 875 patients were enrolled, including 5 859 males and 4 016 females, aged [M (IQR)] 60 (16) years (range: 16 to 94). Median follow-up time was 1 779.0 days [95% CI: 1 750.1-1 807.9]. We used the Kaplan-Meier method to plot survival curves for different groups. Cox multivariate analysis was used to identify independent risk factors for 5-year overall survival (OS), disease-free survival (DFS) and recurrence-free survival (RFS). Finally, a column chart model was constructed to evaluate and stratify patient prognosis. The Strengthening the Reporting of Observational Studies in Epidemiology (STROBE) checklist was followed for this cohort study. Results: According to the number of incorporating high‑risk pathological features, patients were divided into five groups: Hr_0 group (0 incorporating high‑risk pathological feature), Hr_1 group (1 incorporating high-risk pathological feature), Hr_2 group (2 incorporating high-risk pathological features), Hr_3 group (3 incorporating high-risk pathological features), and Hr_4 group (4 or more incorporating high-risk pathological features). The Kaplan‑Meier survival curve results indicated significant differences in OS, DFS and RFS among different groups (all P<0.001). Subgroup analysis was conducted on stage Ⅱ colorectal cancer, and the survival curves of OS, DFS and RFS in different Hr groups overlapped with each other. Compared to the overall population, the survival differences in different groups were significantly reduced, indicating that stage Ⅱ colon cancer patients with incorporating high‑risk pathological features may benefit from adjuvant chemotherapy. The independent prognostic factors for RFS included age, pT stage, pN stage and Hr group. The survival curves of OS, DFS and RFS indicated that the prognosis of Hr_4 group was significantly worse than that of stage Ⅲc patients; 5.2% and 14.1% of stage Ⅰ and Ⅱ patients had two or more incorporating high-risk pathological features (Hr group≥2), respectively. Finally, a column chart model was constructed by incorporating the independent prognostic risk factors for CRC mentioned above. The calibration curve showed a good consistency between the actual observations and the predictions made by the nomogram, and the decision curve analysis (DCA) indicated that the model constructed in this study had good efficacy in stratifying recurrence. Conclusion: The number of incorporating high-risk pathological features is an independent prognostic factor for RFS in patients with stage Ⅰ-Ⅲ CRC. Combining it as a multiclass variable with age, pT and pN stage has good prognostic stratification and recurrence stratification efficacy, which is expected to guide clinical treatment.
[Key words] Colorectal cancer; Recurrence; Incorporating high-risk pathological features; Prediction model
国家癌症中心发布的数据显示,2022年中国新发结直肠癌51.71万,占恶性肿瘤发病率的第2位,死亡24万,占因癌死亡的第4位[1]。手术是结直肠癌最重要的治疗手段,包括切除受累肠段和引流淋巴结。手术标本的临床病理学特征对分期和预后预测至关重要,有助于指导术后患者的管理和治疗。对于Ⅱ期结直肠癌,术后是否接受化疗与低危因素和高危因素相关。微卫星高度不稳定(microsatellite instability-high,MSI-H)或者DNA错配修复蛋白缺陷为Ⅱ期结直肠癌的保护因素[2-4],也提示对5-氟尿嘧啶单药化疗不敏感[3-5]。根据美国国立综合癌症网络(National Comprehensive Cancer Network,NCCN)[6]和中国临床肿瘤学会(Chinese Society of Clinical Oncology,CSCO)[7]等国内外权威结直肠癌治疗指南的推荐,错配修复正常(mismatch repair proficient,pMMR)的Ⅱ期结直肠癌伴不良病理学特征的患者应进行辅助化疗。其中不良病理学特征包括[6-7]:T4期、组织学分化差(高级别,不包括MSI-H者)、淋巴管血管侵犯(lymphovascular invasion,LVI)、神经侵犯、术前肠梗阻或肿瘤部位穿孔、切缘阳性或情况不明、切缘安全距离不足、送检淋巴结不足12 枚等。目前,这些不良病理学特征的作用限于指导 Ⅱ期肠癌的辅助治疗,NCCN和CSCO指南并未明确将不良病理学特征作为Ⅰ期和Ⅲ期患者制定辅助治疗策略时的权重因素。研究指出这些不良病理学特征与复发风险相关,但在不同研究中,这些危险因素是否可以作为无复发生存的独立预后因素存在争议。
与费用高昂的循环肿瘤DNA(circulating tumor DNA,ctDNA)[8]等识别复发高危患者的检测手段相比,术后病理学检查报告的病理学特征具有经济、简便、覆盖范围广的优势,其指导结直肠癌患者辅助治疗的价值应被充分重视并挖掘。本研究,通过回顾复旦大学附属肿瘤医院Ⅰ~Ⅲ期结直肠癌患者的术后病理学资料,发现不良病理学特征的数目与结直肠癌患者不良预后及复发显著相关,基于不良病理学特征数目的预后预测模型有助于早期识别不良预后及复发风险高的患者,有望指导术后辅助治疗的决策。
1 资料和方法
1.1 临床资料
本研究为单中心、回顾性队列研究。研究对象为2008—2018年在复旦大学附属肿瘤医院大肠外科行手术治疗的结直肠癌患者,所有患者均签署知情同意书。本研究经复旦大学附属肿瘤医院伦理委员会批准(审批号:050432-4-2108*),本研究符合赫尔辛基宣言。本队列研究严格遵循《加强流行病学中观察性研究报告质量》(Strengthening the Reporting of Observational Studies in Epidemiology,STROBE)指南中的各项条目。
纳入标准:① 接受结直肠癌根治手术治疗的患者;② 手术样本经过2名以上的高年资病理科医师确诊为原发性结直肠腺癌;③ 根据美国癌症联合会(American Joint Committee on Cancer,AJCC)第8版结直肠癌肿瘤分期系统判定为 Tis-4N0-2M0。
排除标准:① 术前接受过新辅助治疗;② 有肿瘤既往史;③ 在本次原发性结直肠癌之后随访期间出现第二或以上的原发性恶性肿瘤;④ 术后病理学诊断非结直肠腺癌,包括上皮内瘤变或淋巴瘤、间质瘤等良恶性肿瘤;⑤ 病理学分期不明,或者为Ⅳ期患者;⑥ 行内镜下切除、局部切除或姑息性切除手术。
1.2 外科手术、辅助化疗和术后随访
所有外科手术均由具有丰富临床经验和资历的外科医师进行。手术指征遵循结直肠癌治疗指南[6-7,9]。根据NCCN、CSCO结直肠癌诊治指南来指导术后治疗方案的制订,包括随访观察,卡培他滨单药口服,进行为期3个月或者半年的FOLFOX或者XELOX方案化疗,对于奥沙利铂禁忌证或耐受的患者,应用FL(5-FU和亚叶酸)方案或卡培他滨方案。对于那些因不良反应而拒绝或无法耐受辅助化疗的患者,在不进行化疗的情况下进行常规随访监测。术后患者在前2年内每3个月在门诊进行1次随访,在接下来的3年中每6个月进行1次,之后每年进行1次。每次就诊时,留意中期临床病史和实验室血液检查结果,包括癌胚抗原(carcinoembryonic antigen,CEA)水平。每6个月进行1次患者的腹部计算机体层成像(computed tomography,CT)检查、胸部CT和盆腔磁共振成像(magnetic resonance imaging,MRI)检查。结肠镜检查在手术后的第1年进行,然后每两年进行1次。结合病历审查、电话随访和死亡登记数据链接来收集生存数据。最后一次随访是在2021年3月15日。主要研究终点是总生存期(overall survival,OS)、无病生存期(disease-free survival,DFS)和无复发生存(recurrence-free survival,RFS)。OS被定义为从治疗开始到最终随访或直到因任何原因死亡的时间[10-11]。DFS 定义为从治疗开始到局部或远处复发、任何原因死亡时间[10-11]。RFS 定义为从治疗开始到局部复发或远处转移的时间[11]。删失的定义:截至统计时尚未发生终点事件及未知终点事件的患者,在末次随访时间点按删失处理。
1.3 统计学处理
分类变量以计数和百分比表示。正态分布的连续变量表示为x±s。使用Kaplan-Meier方法计算OS、DFS和RFS,并通过log-rank检验进行比较。然后使用 Cox 比例风险回归模型通过多变量分析所有单变量分析具有统计学意义的因素。P<0.05为差异有统计学意义。在本研究中,为了评估不同处理组之间的差异,我们进行了一系列的两两比较。本研究采用了Bonferroni校正来控制家族错误率,将显著性水平α=0.05除以进行的比较次数(κ),从而得到每个单独比较的校正显著性水平α'(具体参见各部分内容)。所有统计学分析均使用 SPSS 26.0软件。
2 结 果
2.1 人口统计学和临床特征
共有9 875例患者符合纳入标准,患者的纳入标准及排除标准见图1。患者年龄[M(IQR)]60(16)岁(范围:16~94岁);男性患者 5 859例(59.3% ),女性患者4 016例(40.7%);0~Ⅰ期患者1 631例(16.5%),Ⅱ期患者3 441例(34.8%),Ⅲ期患者4 166例(42.2%);整体患者中位随访时间:1 779.0 (95% CI:1 750.1~1 807.9)d(表1)。

图 1 研究对象纳入流程图
Fig. 1 Flow chart showing patients enrollment
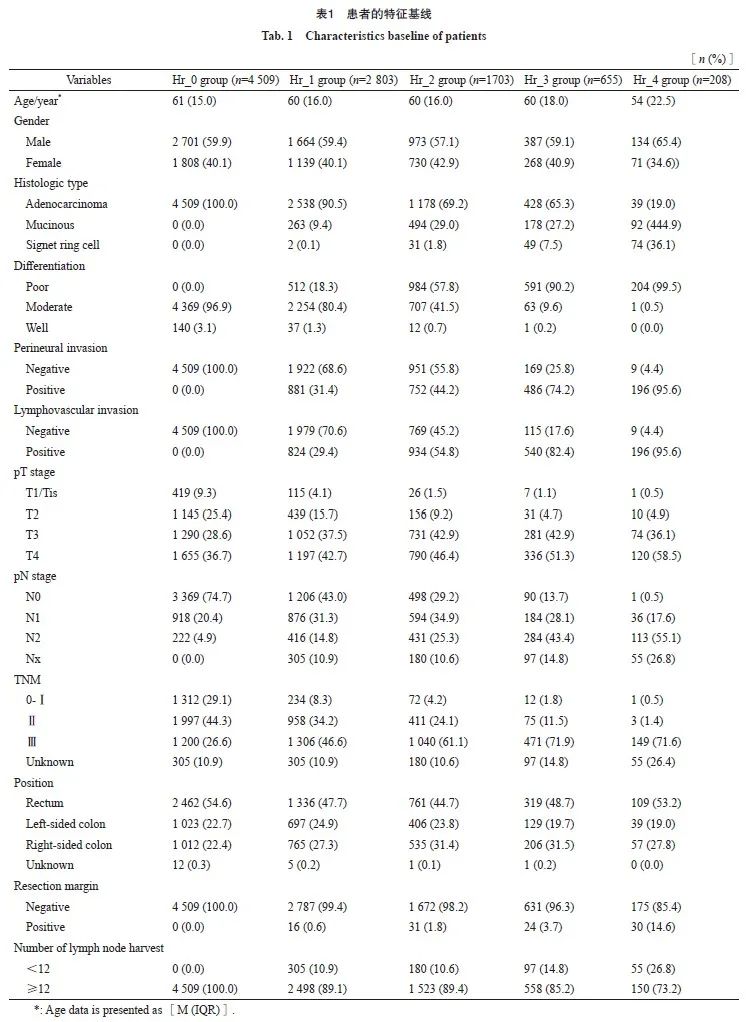
2.2 不良病理学特征数目与非转移性结直肠癌患者的预后相关
本研究纳入的不良病理学特征包括:组织学分化差(高级别)、LVI、神经侵犯、术前肠梗阻或肿瘤部位穿孔、切缘阳性或情况不明、切缘安全距离不足、送检淋巴结不足12枚。因5个及以上不良病理学特征患者较少,为便于分析,进一步将分组定义为:Hr_0组(0个不良病理学特征)、Hr_1组(1个不良病理学特征)、Hr_2组(2个不良病理学特征)、Hr_3组(3个不良病理学特征)、Hr_4组(4个及以上不良病理学特征)。在纳入患者中对不同分组的OS、DFS、RFS进行分析,发现不同数目的不良病理学特征可以很好地把患者生存区分开(P<0.001,图2),不同数量不良病理学特征分组两两之间比较差异有统计学意义,故进一步将不良病理学特征的数目作为研究目标,分析其在非转移性结直肠癌复发风险分层中的作用。
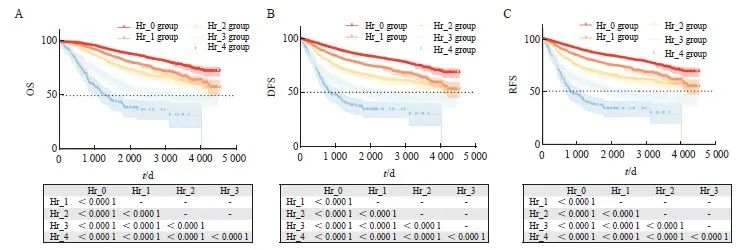
图 2 整体人群不同Hr组别的生存曲线
Fig. 2 Survival curves of different Hr groups
A: OS survival curves and the results of comparisons between different Hr group categories; B: DFS survival curves and the results of comparisons between different Hr group categories; C: RFS survival curves and the results of comparisons between different Hr group categories. Bonferroni correction was applied, with P<0.005 indicating statistical significance.
2.3 识别不良病理学特征在Ⅱ期结直肠癌中的作用
根据NCCN和CSCO指南,Ⅱ期结直肠癌伴复发不良病理学特征者(除外MSI-H者),需要进行辅助化疗。为了明确识别不良病理学特征是否提高了患者生存率,我们对不同不良病理学特征数量分组患者的OS、DFS和RFS进行Kaplan-Meier生存分析。结果表明,具有不同不良病理学特征数量的Ⅱ期肠癌的OS并不能区分开(图3A)。结果提示,具有不良病理学特征的Ⅱ期结直肠癌患者可以从辅助化疗中获益。此外,不同危险因素数量的患者之间的DFS和RFS只有部分(Hr_0和Hr_2,Hr_0和Hr_3)生存情况存在差异(图3B、C),并且该差异较整体人群显著缩小(图2)。本研究发现,不良病理学特征数量对Ⅲ期结直肠癌患者的预后有显著影响(图3D~F),其原因可能是不良病理学特征并不参与Ⅲ期肿瘤的辅助治疗决策。以上结果表明,对具有不良病理学特征的Ⅱ期结直肠癌患者进行联合辅助化疗可改善患者的生存情况,识别不良病理学特征在Ⅱ期结直肠癌中具有重要作用,并在临床实践中得到验证。具有多个不良病理学特征的Ⅱ期结直肠癌患者与仅有单个不良因素的患者往往表现出不同的肿瘤生物学特性,需要予以特别关注。
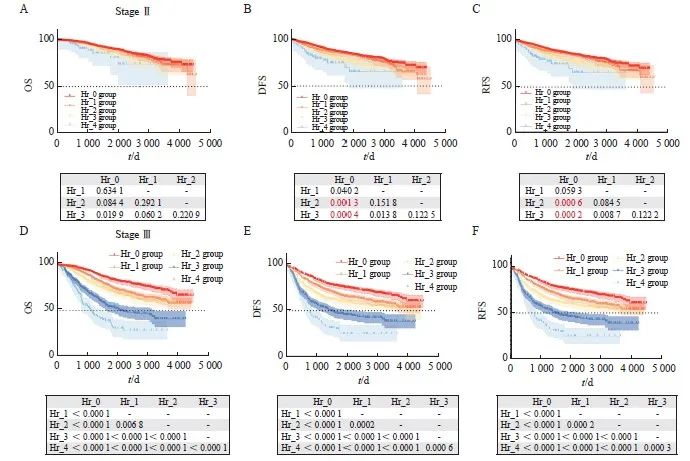
图 3 针对分期的亚组分析中不同Hr组别的生存曲线
Fig. 3 Survival curves for different Hr groups in subgroup analysis for staging
A-C: OS, DFS, and RFS survival curves for stage Ⅱ colorectal cancer patients in different Hr group categories, with Bonferroni correction applied, P<0.008 considered as statistically significant; D‑F: OS, DFS, and RFS survival curves for stage Ⅲ colorectal cancer patients in different Hr group categories, with Bonferroni correction applied, P<0.005 considered as statistically significant.
2.4 5年总OS率、DFS率和RFS率的多因素分析
将表1中的基本特征进行单因素分析,P<0.01的因素进入多因素分析。结果发现,年龄、pT分期、pN分期和Hr分组是总生存、无病生存和无复发生存的独立预后因素(表2)。OS的独立预后因素包括年龄、pT分期、pN分期和Hr分组;DFS的独立预后因素包括:年龄、pT分期、pN分期和Hr分组;RFS的独立预后危险因素包括年龄、pT分期、pN分期和Hr分组。
Cox多因素分析结果表明,pN分期和Hr分组都是影响患者生存的非常重要的因素。为了对比pN和Hr分组对预后的影响的权重,本研究初步分析了不同分组的生存曲线和5年OS率。由于Ⅲc期在非转移性结直肠癌患者中复发风险相对其他分期较高,我们也将其生存率结果一起汇总。结果显示,Hr_4无复发生存期显著劣于Ⅲc期。以上结果明,Hr分组在结直肠癌患者预后分层、复发分层分析时有突出表现(图4)。
目前临床实践中,对于结直肠癌患者的术后辅助治疗,主要取决于pTNM分期。Ⅰ期结直肠癌不推荐辅助化疗;Ⅱ期结直肠癌根据是否合并低危或者高危因素选择性进行随访或单药或者联合化疗;Ⅲ期结直肠癌患者进行3~6个月的XELOX/FOLFOX方案化疗。鉴于Hr分组方法对结直肠癌患者有良好的预后分层作用,有识别复发高危患者的潜在作用,我们进一步将Hr分组对pN分期和pTNM分期取交叉表(图4E、F)。结果显示,在pTNM分期为Ⅰ期的患者中有超过5%的患者(5.2%,合并2个及以上不良病理学特征,Hr分组≥2),复发风险高但未接受化疗。而有接近15%的合并2个或以上不良病理学特征的pTNM Ⅱ期的患者,具有相当高的复发风险,根据现有指南可能接受了时间不足或者强度不够的化疗,因而影响患者的预后。
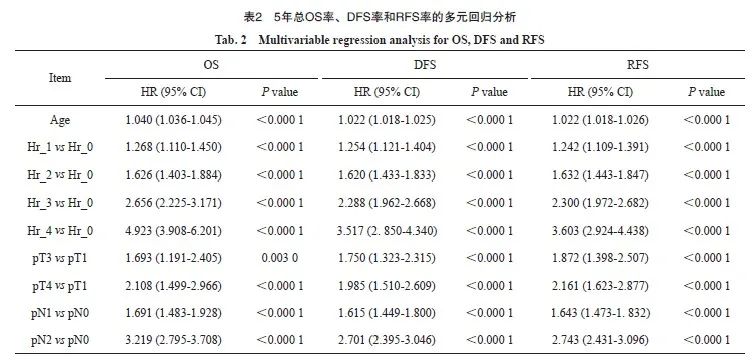
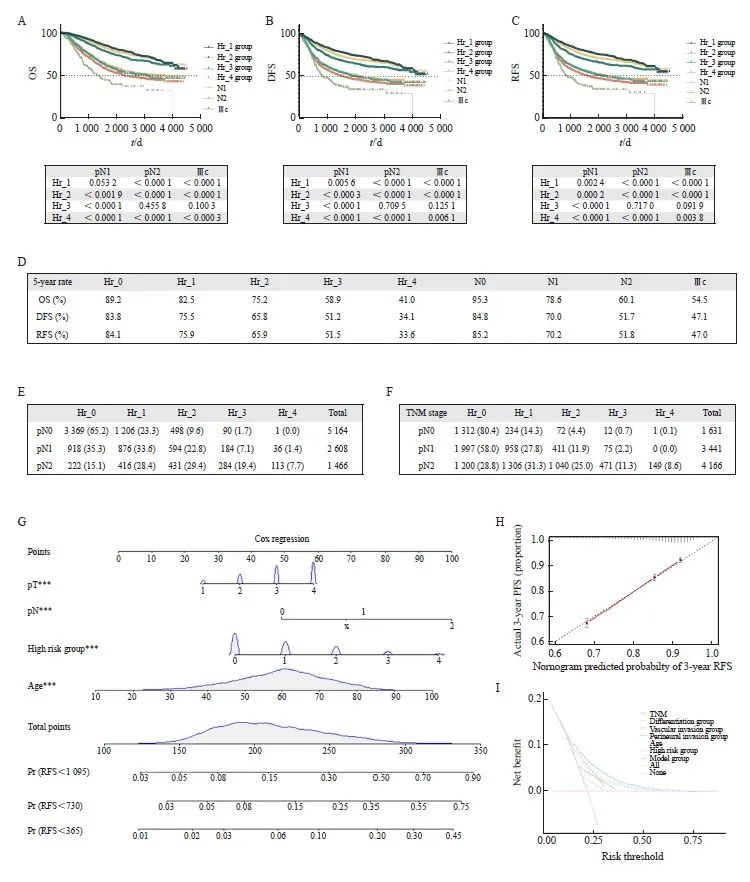
图 4 Hr group分组的潜在临床价值
Fig. 4 The potential clinical value of Hr group grouping
A‑C: OS, DFS, and RFS survival curves for different Hr groups, different pN stages, and stage Ⅲc were adjusted using Bonferroni, with P<0.004 2 indicating statistically significant differences; D: 5‑year OS, 5‑year DFS and 5‑year RFS for different Hr group groups, different pN stages, and stage Ⅲc; E: Cross tabulation of Hr group grouping and pN staging; F: Cross tabulation of Hr group grouping and TNM staging; G: Column chart of RFS risks for 1, 2, and 3 years; H: Calibration curve of the 3-year RFS column chart model; I: The DCA curve of the recurrence risk model.
3 讨 论
本研究为单中心、大样本的回顾性队列研究,纳入了本中心的9 875例Ⅰ~Ⅲ期结直肠癌患者。根据NCCN和CSCO指南中作为不良病理学特征的指标纳入分析(其中pT4是Ⅱ期结直肠癌独有的危险因素,遂将pT浸润作为单独变量进行讨论),包括:组织学分化差(高级别)、LVI、神经侵犯、术前肠梗阻或肿瘤部位穿孔、切缘阳性或情况不明、切缘安全距离不足、送检淋巴结不足12 枚。本研究的创新之处在于将阳性危险因素的总数作为研究对象,并将其推广到Ⅰ~Ⅲ期患者中,进一步挖掘术后病理学检查报告的潜在价值。
结直肠癌作为高度异质性的疾病,有50%的患者在根治性手术后复发[12]。通过术后病理学分期指导辅助治疗,Ⅲ期患者能从辅助治疗中获益,但这种优势在Ⅱ期患者中较小[13]。然而,使用分期作为唯一的标准可能会导致潜在复发患者的治疗不足,或让已经通过手术治愈的患者过度治疗。所以,分期本身并不能预测辅助治疗的潜在效果。目前,术后ctDNA检测[14]可以很好地指导辅助治疗并弥补传统病理学分期的固有缺陷,然而高昂的检测费用和尚无法统一的技术标准使该技术难以普及[15]。本研究通过挖掘术后常规病理学检查报告的病理学特征,结合分期信息来了解患者的复发风险和预测预后。
研究[16-17]表明,许多不良病理学特征是结直肠癌患者预后的独立危险因素,提示其价值不应局限于Ⅱ期结直肠癌。Ueno等[16]仅报告了低分化\未分化是Ⅱ~Ⅲ期结直肠癌患者DFS的独立危险因素;Liebig等[17]仅报告了神经侵犯是Ⅰ~Ⅳ期结直肠癌患者癌症特异性生存(cancer-specific survival,CSS)和DFS的独立危险因素;此外,有研究[18]显示环状切缘阳性是直肠癌手术肿瘤学结局的独立预后因素;淋巴结清扫数目是评价手术质量的重要指标,获取低于12枚淋巴结不仅无法进行N分期,也无法保证手术切除质量,预示肿瘤残余的可能性[19]。关于值得注意的是,不同研究报告也存在明显的出入,复发的独立预后危险因素似乎很难达成共识。所以,根据患者合并某个具体的危险因素,并不能很好地对复发风险进行分层,进而指导治疗。
本研究将0个不良病理学特征定义Hr_0组, 1个不良病理学特征定义为Hr_1组,以此类推,直至把4个及以上不良病理学特征的定义为Hr_4组。对9 875例Ⅰ~Ⅲ期患者进行生存分析,发现不同分组之间具有显著不同的OS、DFS和RFS (不同分组进行两两比较,P<0.001)。根据不同分期进行亚组分析发现,在Ⅲ期患者中,这种生存差异仍然显著存在,而Ⅱ期患者中,这种生存差异明显减小,生存曲线出现明显重叠。亚组分析提示,识别Ⅱ期结直肠癌伴不良病理学特征的患者并进行联合辅助化疗具有改善生存的重要作用,从侧面反映了不良病理学特征在结直肠癌中的重要作用。
本研究对整体人群进行多因素Cox回归分析。结果显示,年龄、pT分期、pN分期和Hr分组是OS、DFS和RFS的独立预测因素。进一步比较不同独立危险因素的权重,尤其是危险因素数量和淋巴结分期。5年OS率、DFS率、RFS率显示,Hr_4显著差于Ⅲc期,而Ⅲc期显著差于pN2期患者,提示Hr分组在预后预测中有重要作用。通过进行交叉分析,本研究发现超过5%的Ⅰ期的患者具有2个及以上不良病理学特征,有相当高的复发风险,但未接受化疗。而Ⅱ期有接近15%的患者具有2个或以上不良病理学特征,可能接受了时间不足或者强度不够的化疗。本研究发现,多个不良病理学特征是独立于淋巴结转移的危险因素,这些患者可能因为目前指南。
本研究的优势在于深入挖掘术后常规病理学检查报告进行分析,识别高危人群,相比其他检测手段具有可及性高、推广性好的优点;单一不良病理学特征尚未形成共识作为结直肠癌复发的独立危险因素,所以根据存在的某个具体危险因素,无法对复发风险进行分层来指导治疗。研究的不足主要来源于回顾性研究的固有限制,包括患者的选择、纳入和回忆偏倚。本研究主要纳入单中心的患者,纳入的患者无法完全代表结直肠癌患者的真实现状;本研究剔除了接受过新辅助治疗、发生转移、局部切除或者姑息性切除等患者,这使得研究结论的普适性受限;我们未将术后具体化疗情况和低危因素即患者的微卫星稳定状态纳入分析;此外,患者的KRAS/NRAS/BRAF等基因状态以及肿瘤标志物、美国麻醉医师协会分级等信息在本研究中未能体现。无论如何,根据本研究的大样本可靠数据,可以证实不良病理学特征与Ⅱ期结直肠癌的辅助治疗相关,且不良病理学特征数量是Ⅰ~Ⅲ期结直肠癌患者预后的独立预测因素,基于不良病理学特征数量的列线图模型可对肠癌患者进行复发风险、预后风险分层分析,可望更好地指导结直肠癌患者的 辅助治疗。
利益冲突声明:所有作者均声明不存在利益冲突。
作者贡献声明:
翁俊勇:研究实施、数据分析、文章撰写、统计分析;张若昕、叶紫岚:研究实施、数据采集;刘琪:论文审阅修改;李心翔:研究设计、论文审阅修改、行政支持。
[参考文献]
[1]HAN B F, ZHENG R S, ZENG H M, et al. Cancer incidence and mortality in China, 2022[J]. J Natl Cancer Cent, 2024, 4(1): 47-53.
[2]KLINGBIEL D, SARIDAKI Z, ROTH A D, et al. Prognosis of stage Ⅱ and Ⅲ colon cancer treated with adjuvant 5-fluorouracil or FOLFIRI in relation to microsatellite status: results of the PETACC-3 trial[J]. Ann Oncol, 2015, 26(1): 126-132.
[3]RIBIC C M, SARGENT D J, MOORE M J, et al. Tumor microsatellite-instability status as a predictor of benefit from fluorouracil-based adjuvant chemotherapy for colon cancer[J]. N Engl J Med, 2003, 349(3): 247-257.
[4]SARGENT D J, MARSONI S, MONGES G, et al. Defective mismatch repair as a predictive marker for lack of efficacy of fluorouracil-based adjuvant therapy in colon cancer[J]. J Clin Oncol, 2010, 28(20): 3219-3226.
[5]KIM J E, HONG Y S, KIM H J, et al. Defective mismatch repair status was not associated with DFS and OS in stage Ⅱ colon cancer treated with adjuvant chemotherapy[J]. Ann Surg Oncol, 2015, 22(Suppl 3): S630-S637.
[6]BENSON A B, VENOOK A P, AL-HAWARY M M, et al. Colon cancer, version 2.2021, NCCN clinical practice guidelines in oncology[J]. J Natl Compr Canc Netw, 2021, 19(3): 329-359.
[7]中国临床肿瘤学会指南工作委员会组织. 中国临床肿瘤学会(CSCO)淋巴瘤诊疗指南-2023[M]. 北京: 人民卫生出版社, 2023.
Organized by the Guidelines Working Committee of the Chinese Society of Clinical Oncology. Chinese Society of Clinical Oncology (CSCO) guidelines for diagnosis and treatment of lymphoma-2023 [M]. Beijing: People's Health Publishing House, 2023.
[8]CAMPOS-CARRILLO A, WEITZEL J N, SAHOO P, et al. Circulating tumor DNA as an early cancer detection tool[J]. Pharmacol Ther, 2020, 207: 107458.
[9]ARGILÉS G, TABERNERO J, LABIANCA R, et al. Localised colon cancer: ESMO clinical practice guidelines for diagnosis, treatment and follow-up[J]. Ann Oncol, 2020, 31(10): 1291-1305.
[10]WALIA A, TUIA J, PRASAD V. Progression-free survival, disease-free survival and other composite end points in oncology: improved reporting is needed[J]. Nat Rev Clin Oncol, 2023, 20(12): 885-895.
[11]COHEN R, VERNEREY D, BELLERA C, et al. Guidelines for time-to-event end-point definitions in adjuvant randomised trials for patients with localised colon cancer: results of the DATECAN initiative[J]. Eur J Cancer, 2020, 130: 63-71.
[12]LABIANCA R, NORDLINGER B, BERETTA G D, et al. Early colon cancer: ESMO clinical practice guidelines for diagnosis, treatment and follow-up[J]. Ann Oncol, 2013, 24(Suppl 6): vi64-vi72.
[13]BENSON A B 3rd, SCHRAG D, SOMERFIELD M R, et al. American Society of Clinical Oncology recommendations on adjuvant chemotherapy for stage Ⅱ colon cancer[J]. J Clin Oncol, 2004, 22(16): 3408-3419.
[14]TARAZONA N, GIMENO-VALIENTE F, GAMBARDELLA V, et al. Targeted next-generation sequencing of circulating-tumor DNA for tracking minimal residual disease in localized colon cancer[J]. Ann Oncol, 2019, 30(11): 1804-1812.
[15]MALLA M, LOREE J M, KASI P M, et al. Using circulating tumor DNA in colorectal cancer: current and evolving practices[J]. J Clin Oncol, 2022, 40(24): 2846-2857.
[16]UENO H, KAJIWARA Y, SHIMAZAKI H, et al. New criteria for histologic grading of colorectal cancer[J]. Am J Surg Pathol, 2012, 36(2): 193-201.
[17]LIEBIG C, AYALA G, WILKS J, et al. Perineural invasion is an independent predictor of outcome in colorectal cancer[J]. J Clin Oncol, 2009, 27(31): 5131-5137.
[18]MANISUNDARAM N, DIBRITO S R, HU C Y, et al. Reporting of circumferential rep margin in rectal cancer surgery[J]. JAMA Surg, 2023, 158(11): 1195-1202.
[19]TREPANIER M, ERKAN A, KOUYOUMDJIAN A, et al. Examining the relationship between lymph node harvest and survival in patients undergoing colectomy for colon adenocarcinoma[J]. Surgery, 2019, 166(4): 639-647.
作者:中国癌症杂志
版权声明:
本网站所有注明“来源:梅斯医学”或“来源:MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明“来源:梅斯医学”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言










#结直肠癌# #预测模型# #不良病理学特征#
74