Neurology:中年胰岛素抵抗增加老年阿尔兹海默风险
2018-02-25 zhangfan MedSci原创
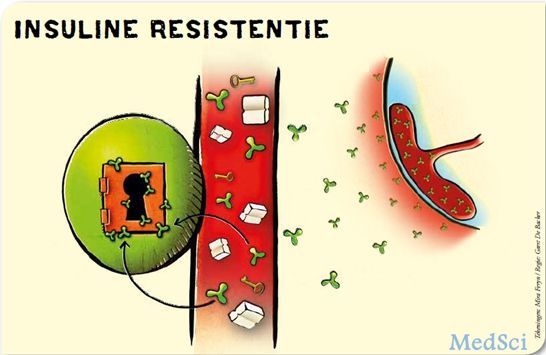
研究认为,对于无痴呆症状的中年人群,胰岛素抵抗导致老年期间的阿尔兹海默风险增加
作者:zhangfan
版权声明:
本网站所有注明“来源:梅斯医学”或“来源:MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明“来源:梅斯医学”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言








#胰岛#
41
#Neurol#
35
中年胰岛素抵抗增加老年阿尔兹海默风险.
71
中年胰岛素抵抗.
75
中年胰岛素抵抗.
66