ESMO Open:致病性BRCA1/2胚系突变在胰腺癌患者中的发生率
2021-01-08 Nebula MedSci原创
胚系BRCA1/2致病性突变(gBRCApv)可增加胰腺癌的风险,并预测对铂类药物和聚(ADP-核糖)聚合酶(PARP)抑制剂的反应
胚系BRCA1/2致病性突变(gBRCApv)可增加胰腺癌的风险,并预测对铂类药物和聚(ADP-核糖)聚合酶(PARP)抑制剂的反应。关于全球胰腺导管腺癌(PDAC)患者中gBRCApv发生率的数据很少,并且存在显著的地域异质性。本研究旨在分析gBRCApv在意大利患者中的发生率。
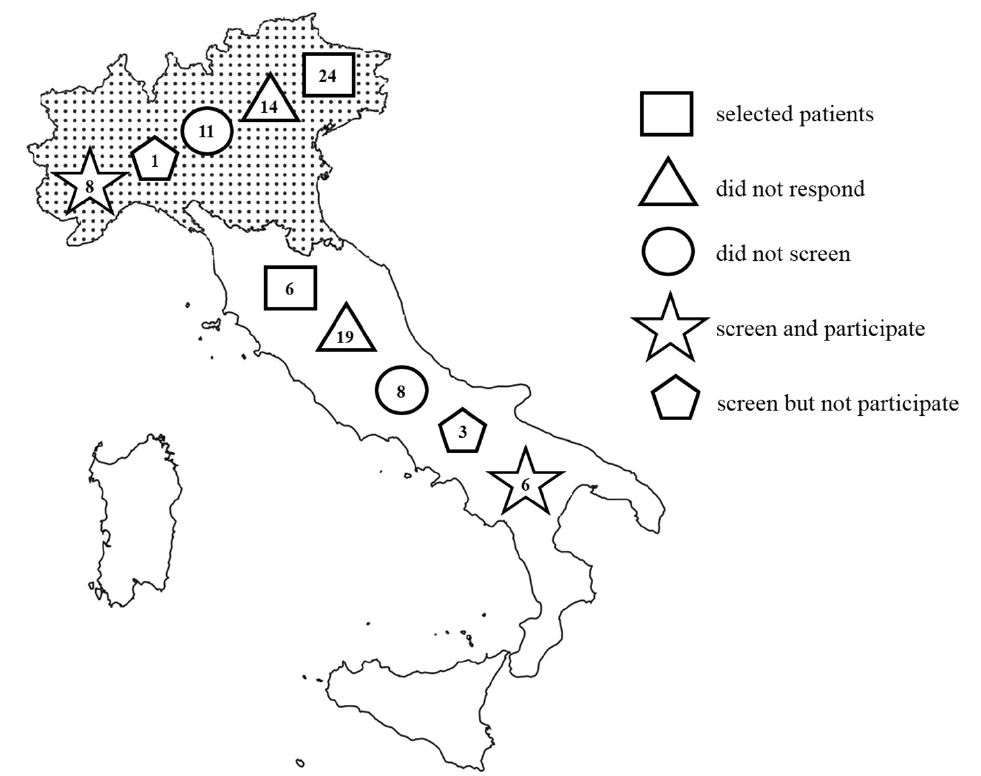
任何年龄的胰腺癌患者,在诊断后3个月内在意大利肿瘤学中心进行gBRCApv筛查,不作任何选择。在本分析中,患者有乳腺癌、卵巢癌、胰腺癌和前列腺癌家族史被认为可能与BRCA相关。
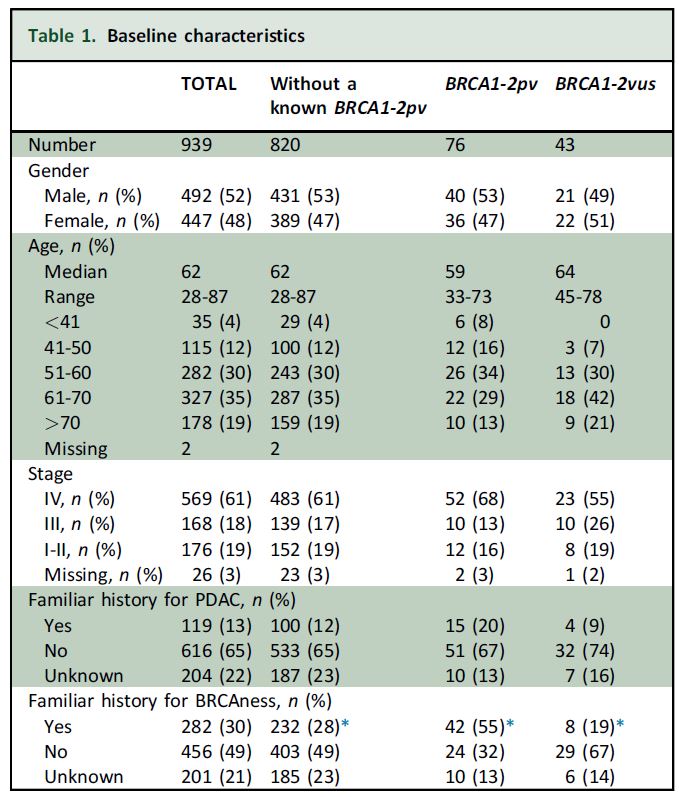
2015年6月-2020年5月,意大利14个中心共对939名患者进行了检测,其中492名(52%)男性,中位年龄62岁(28-87岁),569名(61%)患者有转移,273名(29%)有潜在的BRCA相关癌症家族史。
76位患者为gBRCA1-2pv阳性(8.1%;转移性 9.1%、非转移性 6.4%)。gBRCA2/gBRCA1的比值为5.4:1。与野生型相比,携带gBRCApv的患者年龄更小(59岁 vs 62岁,P=0.01)。在40岁以下的患者人群中,gBRCApv阳性率为17.1%,41~50岁为10.4%,51~60岁为9.2%,61~70岁为6.7%,70岁以上患者中为6.2%。在845位74岁以下的患者中,gBRCApv频率为9%。有 vs 无潜在BRCA相关肿瘤家族史的患者的突变率分别为14% vs 6%。
综上,在意大利PDAC患者中,gBRCApv的发生率高于预期。基于此结果,Peretti等建议,无论其家族史和分期如何,所有74岁以下的PDAC患者均应进行gBRCApv筛查。
原始出处:
Peretti U,Cavaliere A,Niger M et al. Germinal BRCA1-2 pathogenic variants (gBRCA1-2pv) and pancreatic cancer: epidemiology of an Italian patient cohort. ESMO Open, 2021, 6: 100032.https://doi.org/10.1016/j.esmoop.2020.100032.
作者:Nebula
版权声明:
本网站所有注明“来源:梅斯医学”或“来源:MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明“来源:梅斯医学”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言








#SMO#
38
#发生率#
43
#致病性#
38
#PE#
40
在本分析中,患者有乳腺癌、卵巢癌、胰腺癌和前列腺癌家族史被认为可能与BRCA相关。
81