中国青年学者一作,最新Nature:DNA 感应炎症小体引起复发性动脉粥样硬化性中风
2024-08-10 BioMed科技 BioMed科技
通过脱氧核糖核酸酶治疗或抑制炎性体激活来中和游离DNA可降低中风复发率。作者的研究结果为动脉粥样硬化患者发生缺血性事件后的高复发率提供了解释。
中风后早期复发事件的风险仍然很高且机制尚不明确
中风是全球第二大死因,也是导致长期残疾的主要原因,由于人口老龄化,其发病率不断上升。造成这一社会医学负担的一个重要因素是复发性血管事件(如心肌梗死)的高风险。此外,中风幸存者患心肌梗塞的风险也大大增加。动脉粥样硬化是一种慢性炎症性疾病。中风会导致全身性炎症反应,这可能会导致血管炎症和斑块负荷的进展,从而导致动脉粥样硬化。中风患者炎症生物标志物和动脉粥样硬化进展的流行病学数据表明,炎症可能与动脉粥样硬化进展甚至复发性缺血事件相关。基于这些发现,作者提出中风可能通过炎症机制促进后续血管事件发生的假设。然而,这条假定的脑-免疫-血管轴的详细机制目前尚不清楚,因此缺乏可能降低中风后早期复发率的特定免疫靶点。
靶向炎症小体可有效预防实验性脑中风后复发性缺血事件
在这项研究中,慕尼黑大学Arthur Liesz团队华人一作Jiayu Cao通过使用一种新型的中风引起的复发性缺血小鼠模型,发现中风通过增加循环无细胞DNA导致易损动脉粥样硬化斑块中AIM2炎性体的激活。中风后斑块炎症增强导致斑块不稳定和动脉粥样硬化血栓形成,最终导致动脉动脉栓塞和中风后数天内复发性中风。中性粒细胞被确定为脑中风后游离DNA的主要来源,游离DNA是导致AIM2炎性体活化的病原体。通过脱氧核糖核酸酶治疗或抑制炎性体激活来中和游离DNA可降低中风复发率。作者的研究结果为动脉粥样硬化患者发生缺血性事件后的高复发率提供了解释。相关工作以“DNA-sensing inflammasomes cause recurrent atherosclerotic stroke”为题发表在Nature。

【文章要点】
一、缺血事件可诱发中风复发并加剧斑块易损性
最新的流行病学数据显示,大动脉粥样硬化性(LAA)中风患者在发作后的早期阶段(0-30天)出现复发的风险明显高于其他中风亚型,这表明当前的二级预防措施难以有效降低LAA中风患者的早期复发风险。为探究其机制,作者建立了一种包含颈总动脉高度狭窄的实验性中风模型。结果发现,实验性中风导致30%的动物出现远端供血区的继发性缺血性损害,与斑块破裂和血栓形成相关。进一步分析发现,中风可增加斑块内炎症细胞的浸润和增殖,而局部增殖率与继发性事件的发生呈正相关。这提示,中风诱发的远端斑块不稳定是引起早期复发的关键机制。
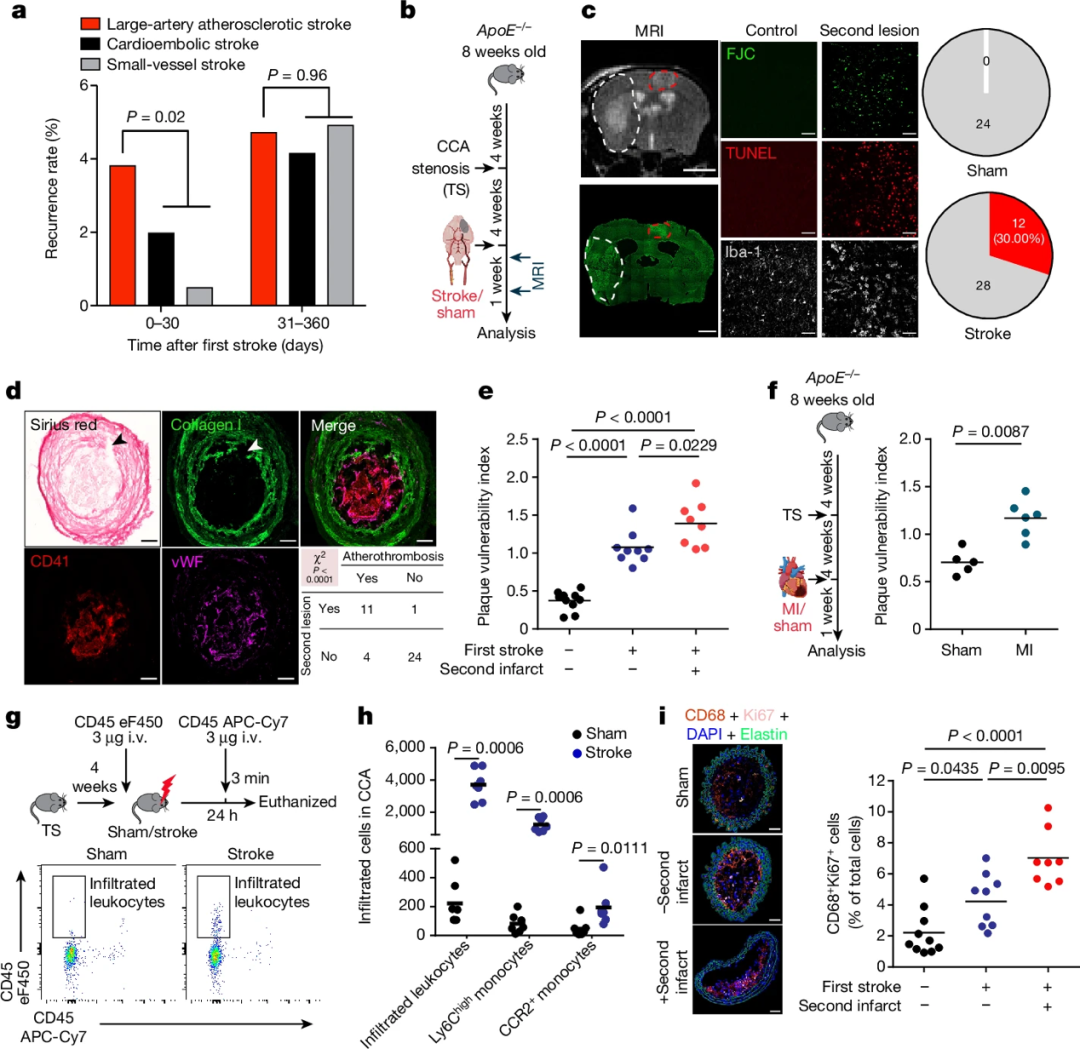
图1 缺血事件可诱发中风复发并加剧斑块易损性
二、中风后DNA激活斑块中的AIM2
中风可诱发颈总动脉粥样硬化斑块内的AIM2炎症小体激活,导致局部IL-1β水平升高,从而加剧斑块的炎症反应和脆弱性。抑制炎症小体活性,尤其是AIM2炎症小体,能够减少中风后斑块内免疫细胞的增殖和浸润,降低斑块的易破裂性。进一步研究发现,中风和心肌梗死后血清中游离DNA(cfDNA)水平短暂升高,cfDNA可直接激活AIM2炎症小体,中和cfDNA也能减少中风后斑块内炎症小体的激活。这些结果表明,中风诱发的远端粥样硬化斑块不稳定是由cfDNA激活AIM2炎症小体所致。
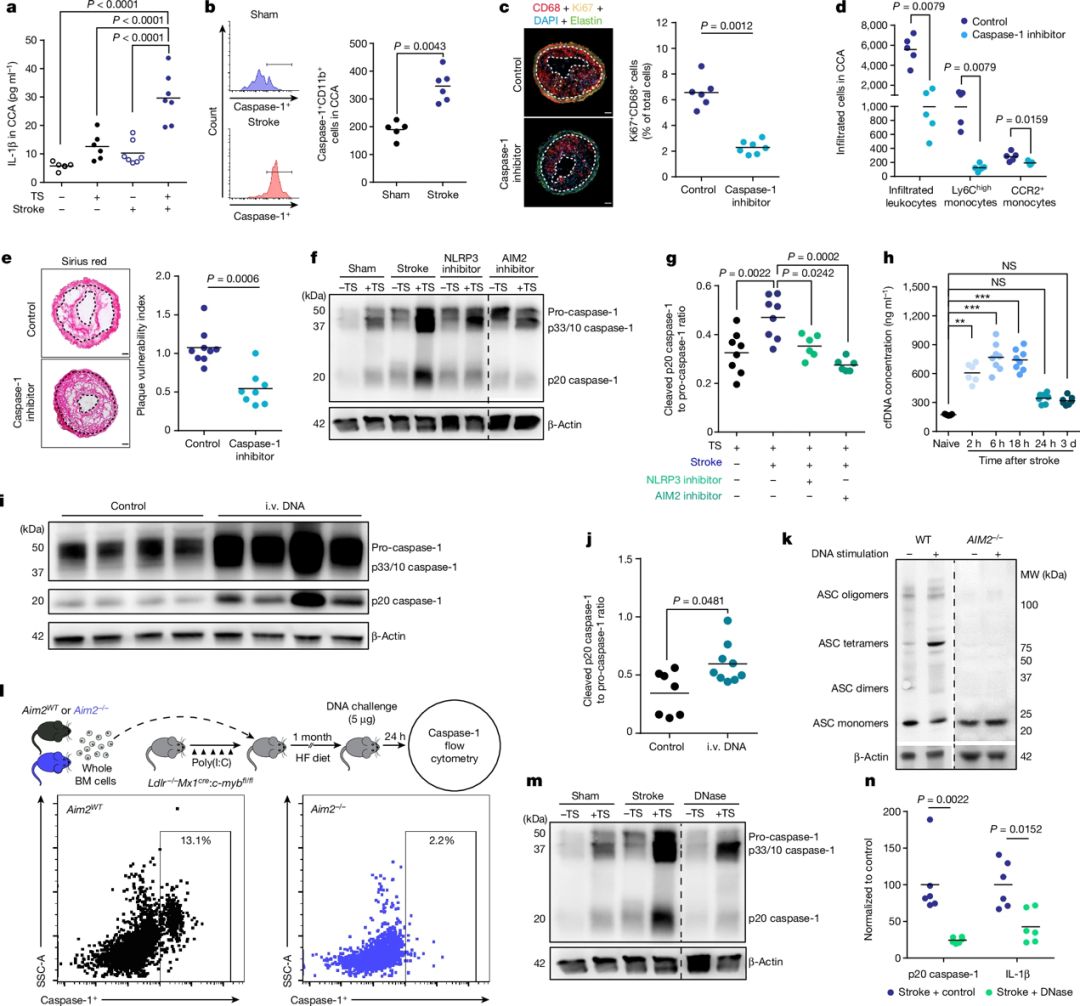
图2 中风后DNA激活斑块中的AIM2
三、抑制中风后炎性体激活可防止斑块不稳定和复发性中风事件
中风诱导的斑块炎症可能通过促进细胞外基质(ECM)重塑和凝血因子活化而导致斑块不稳定和血栓形成。中风导致斑块中基质金属蛋白酶(MMPs)活性增加,引起胶原纤维紊乱和ECM降解;同时,炎症小体激活产生的IL-1β也可促进MMPs的表达和活化。此外,中风诱发游离DNA(NET-DNA)的释放可激活凝血因子XII,进而导致血栓形成。抑制炎症小体活性、中和IL-1β或降解游离DNA,均可减少MMPs活性和凝血因子XII沉积,从而保护斑块稳定性,这为改善中风患者二级预防提供了新的治疗靶点。
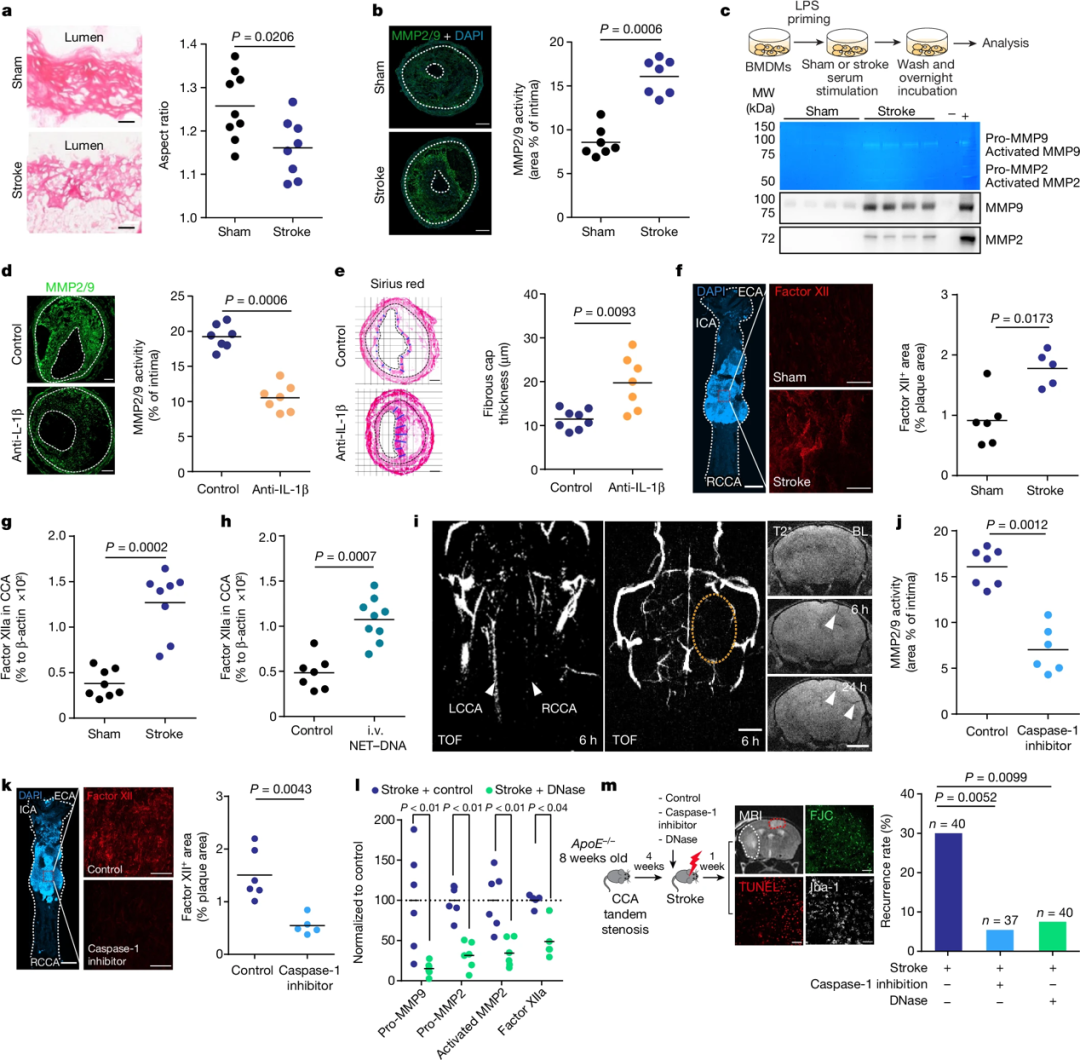
图3 抑制中风后炎性体激活可防止斑块不稳定和复发性中风事件
四、中风患者的验证
为了验证上述发现在临床中的适用性,作者对来自无症状患者和急性缺血性中风患者的颈动脉内膜切除术标本进行了分析。中风患者斑块中单核细胞计数明显增加,而外周血单核细胞和淋巴细胞计数无差异。中风和心肌梗死患者血浆中游离DNA(cfDNA)明显增加,斑块中炎症小体活化指标也显著上升。中风患者斑块中基质金属蛋白酶9(MMP9)活性超过无症状患者10倍以上。中风后斑块中凝血因子XII沉积显著增多。这些结果验证了动物实验中发现的关键机制,即游离DNA激活AIM2炎症小体,进而导致斑块内MMPs活性增加和凝血因子XII沉积,从而引发斑块不稳定和血栓形成,在中风患者中均有体现。
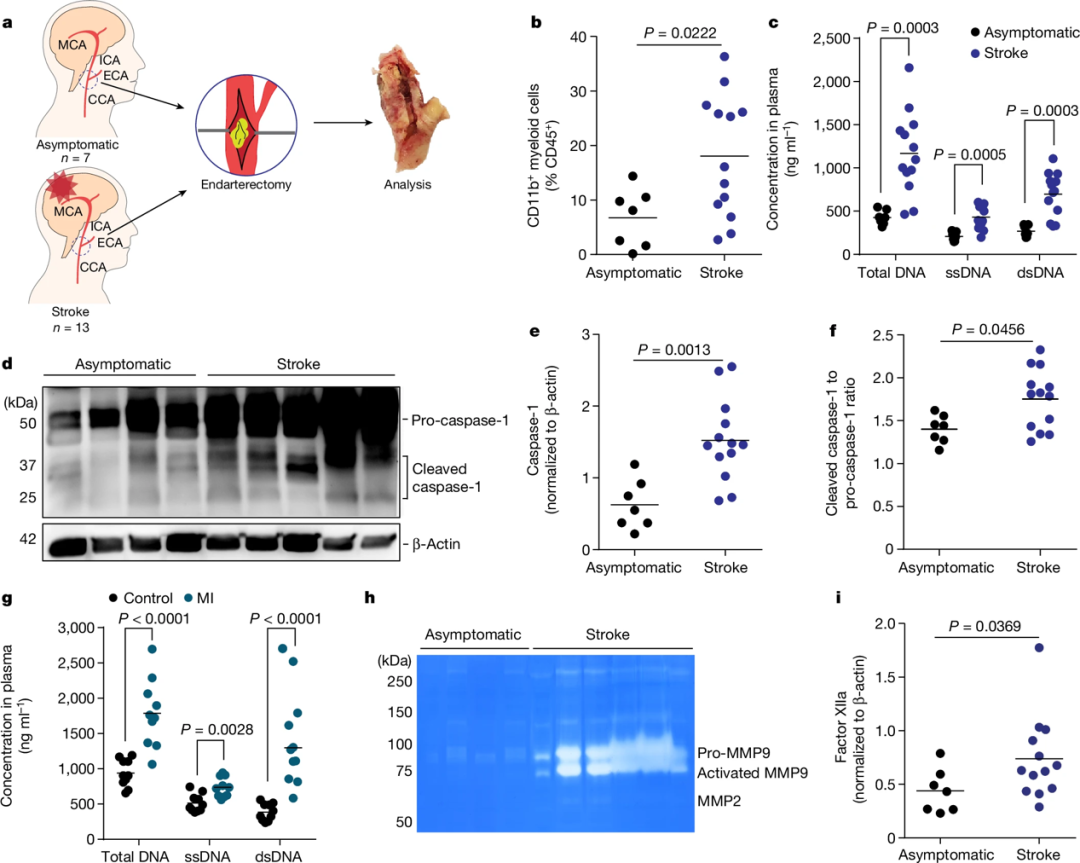
图4 中风患者的验证
【结论与展望】
总之,在这项研究中,作者提出了一种机制解释了动脉粥样硬化患者中风和心肌梗死后早期复发事件的高发生率。利用中风后斑块破裂和继发性梗死的新型动物模型,作者确定了免疫机制,并在人类颈动脉斑块样本中验证了这些机制。作者证实了这种信号级联的有效靶向治疗和管理有望作为进一步临床转化的治疗候选。
原文链接:
作者:BioMed科技
版权声明:
本网站所有注明“来源:梅斯医学”或“来源:MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明“来源:梅斯医学”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言











#动脉粥样硬化# #中风# #炎症小体#
54