Eur Heart J 南京医科大学陈宏山/季勇(南京医科大学/哈尔滨医科大学)/陈绍良揭示衰老能量-染色质重塑介导动脉粥样硬化
2024-08-06 论道心血管 论道心血管
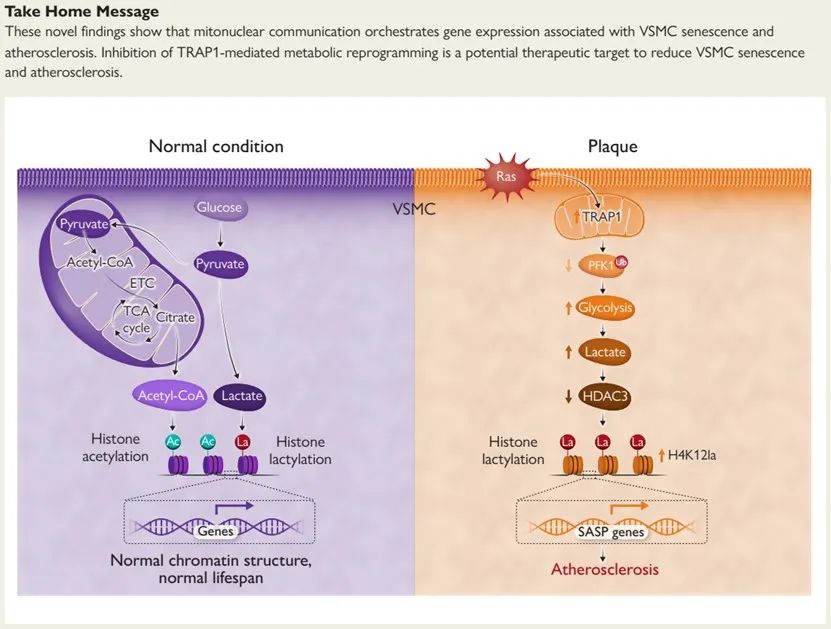
揭示了TRAP1-HDAC3-H4K12乳酸化新型修饰轴,其通过调节代谢重编程,诱导衰老相关分泌表型(SASP)基因染色质微环境及表观遗传重塑,促进VSMCs衰老和AS的作用及机制。
大量研究证实,血管平滑肌细胞(VSMCs)衰老是动脉粥样硬化(AS)病程进展和不稳定斑块形成的重要驱动因素。血管平滑肌能量重编程和染色质重塑是细胞衰老(Senescence)的两大重要特征,探索VSMCs衰老的机制可能为AS的治疗提供新的策略和干预靶点。
通过筛选课题组研究发现,衰老VSMCs中特征性峰值异常表达TRAP1(一种热休克蛋白90-HSP90-分子伴侣的线粒体亚型,线粒体能量代谢的关键调控因子之一)并伴随核仁周边大量染色质重排,因此本研究以此为切入点尝试探索VSMCs衰老新型机制并开发相关潜在药物。
2024年8月1日,南京医科大学药学院陈宏山教授、季勇教授(南京医科大学/哈尔滨医科大学)与南京医科大学附属南京医院(南京市第一医院)心血管内科陈绍良教授在European Heart Journal上发表题为“TRAP1 drives smooth muscle cell senescence and promotes atherosclerosis via HDAC3-primed histone H4 lysine 12 lactylation”的研究论文,揭示了TRAP1-HDAC3-H4K12乳酸化新型修饰轴,其通过调节代谢重编程,诱导衰老相关分泌表型(SASP)基因染色质微环境及表观遗传重塑,促进VSMCs衰老和AS的作用及机制。该研究强调了染色质作为信号整合平台,接受代谢重编程产生的乳酸信号,通过代谢重编程-染色质重塑表观遗传对话,为延缓VSMCs衰老和AS进程的临床治疗提供新思路。

本研究创新点主要包括:
1. 发现TRAP1-HDAC3-H4K12乳酸化修饰轴整合线粒体能量重编程和染色质重塑介导衰老相关动脉粥样硬化。
2. 发现HIF-1α-TRAP1-PFK1-线粒体呼吸链复合物IV新型通路是动脉粥样硬化斑块血管平滑肌在低氧环境中取代无氧糖酵解优先使用有氧糖酵解的重要途径。
3. 在典型的衰老相关疾病动脉粥样硬化(AS)和阿尔茨海默病(AD)中均发现特征性H4K12乳酸化修饰(区别于经典的H3K18乳酸化修饰)标签于衰老相关分泌表型(SASP)基因转录调控区域构建SASP表达独特染色质微环境。
4. 在疾病模型中鉴定去乳酸化酶HDAC3为全新的组蛋白乳酸化酶作用体系,与经典P300乳酸化酶构成乳酸修饰完整酶促-酶解反应体系。
5. 在血管系统中首次开展Protac(蛋白降解靶向嵌合体技术)药物靶向特异性提高药物作用效率。
详细研究结果报道如下:
为了揭示能量代谢和细胞衰老之间的新联系,研究者发现新的衰老相关分子肿瘤坏死因子受体相关蛋白1 (Tumor necrosis factor receptor-associated protein 1, TRAP1),该分子也是线粒体能量代谢的关键调控因子之一。通过蛋白免疫印记、免疫荧光染色及衰老染色等系列实验发现TRAP1及衰老相关分子表达在衰老刺激的血管平滑肌中异常升高,并且TRPA1和AS的细胞衰老机制密切相关。
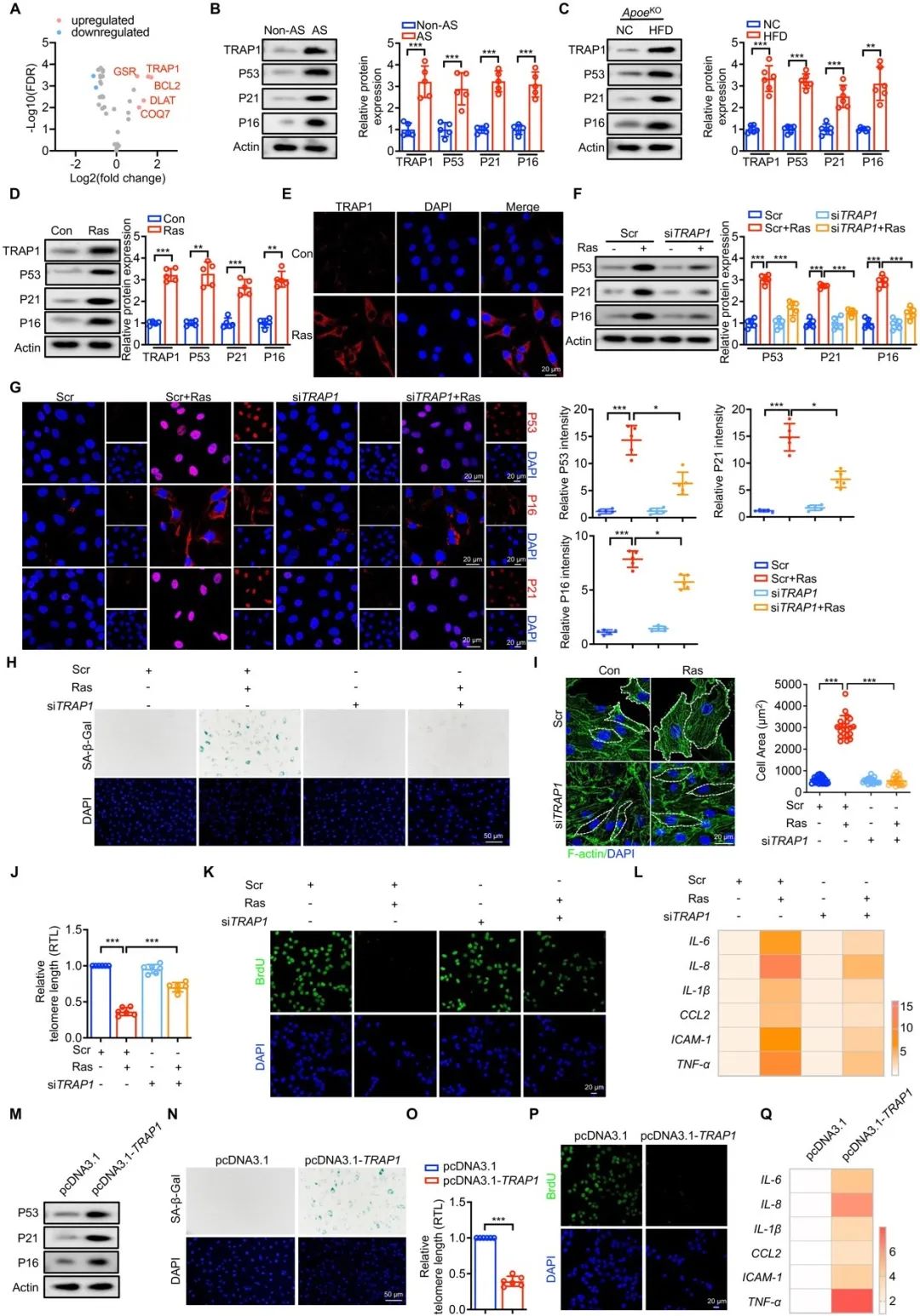
图1. TRAP1调节血管VSMC衰老
为了探索TRAP1促进VSMCs衰老的机制,研究者通过免疫荧光染色、Seahorse及蛋白免疫印迹等系列实验证实,TRAP1可通过调节能量代谢重编程(从氧化磷酸化向有氧糖酵解偏移),促进VSMCs衰老。通过进一步筛选,研究者发现TRAP1可特异性靶向结合三大糖酵解限速酶之一PFK1,降低其泛素化过程,抑制线粒体复合物IV活性,从而调节衰老VSMCs进行有氧糖酵解。通过以上结果,研究者首次发现TRAP1-PFK1-Complex IV是构成衰老VSMCs选择有氧糖酵解的重要环路。
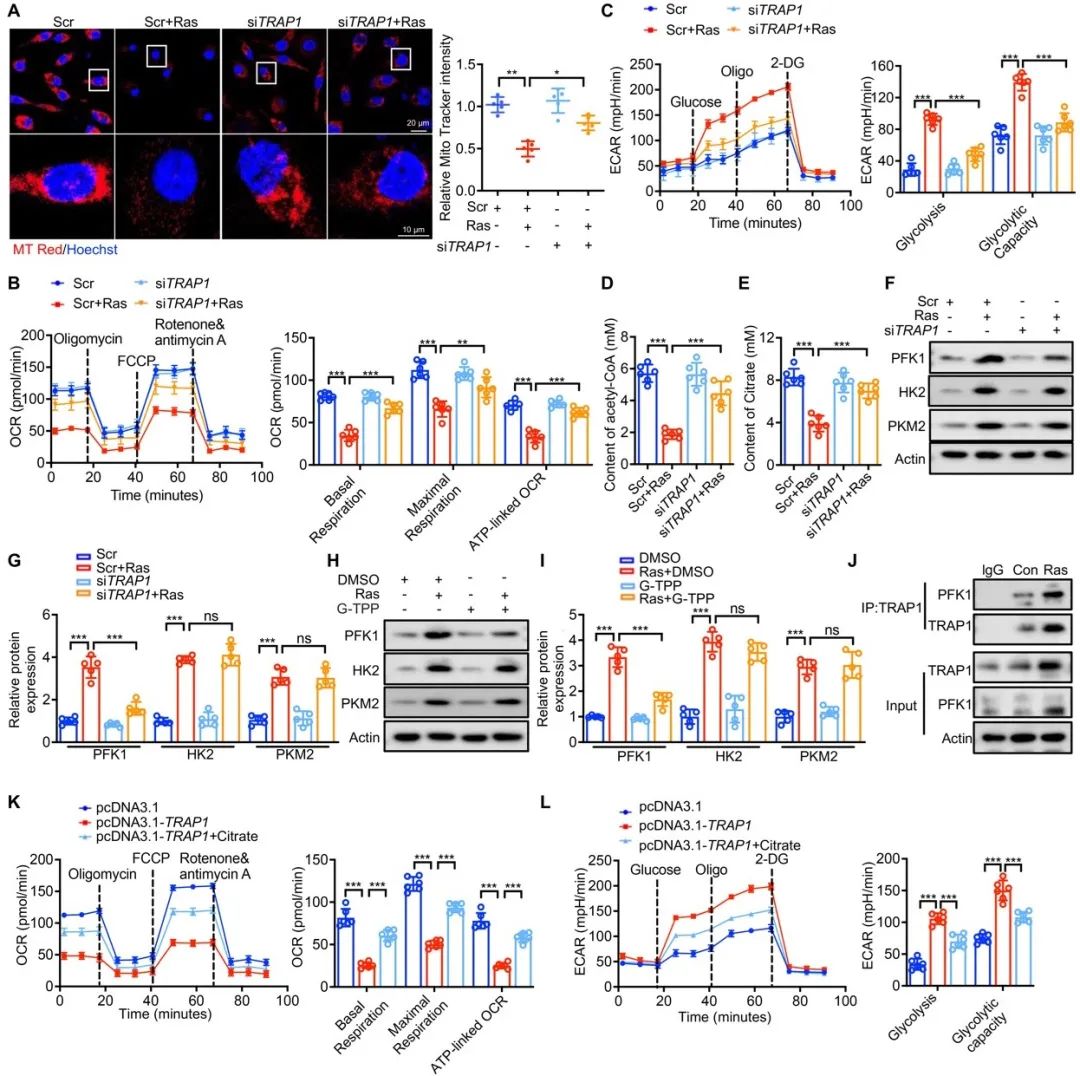
图2. TRAP1是衰老VSMCs中能量重编程的关键调节因子
近年来随着研究的深入,发现作为糖酵解的终产物乳酸,除了参与器官的生长和发育,还可作为信号分子参与多种疾病的发生发展。研究者发现衰老VSMCs中乳酸含量异常积累,而TRAP1敲除可显著逆转这一现象。为了探究TRAP1诱导VSMCs衰老是否依赖异常积累的乳酸,研究者通过外源性补充乳酸及抑制内源性乳酸生成等多种方法改变乳酸含量,检测对平滑肌衰老表型的影响。结果显示,在TRAP1敲除的VSMCs中,外源性补充乳酸可恢复Ras诱导的VSMCs衰老,而抑制乳酸生成显著抑制VSMCs衰老。以上结果表明,TRAP1通过增加乳酸积累诱导VSMCs衰老,并且进一步支持乳酸可作为多种疾病的潜在治疗方法的新策略。
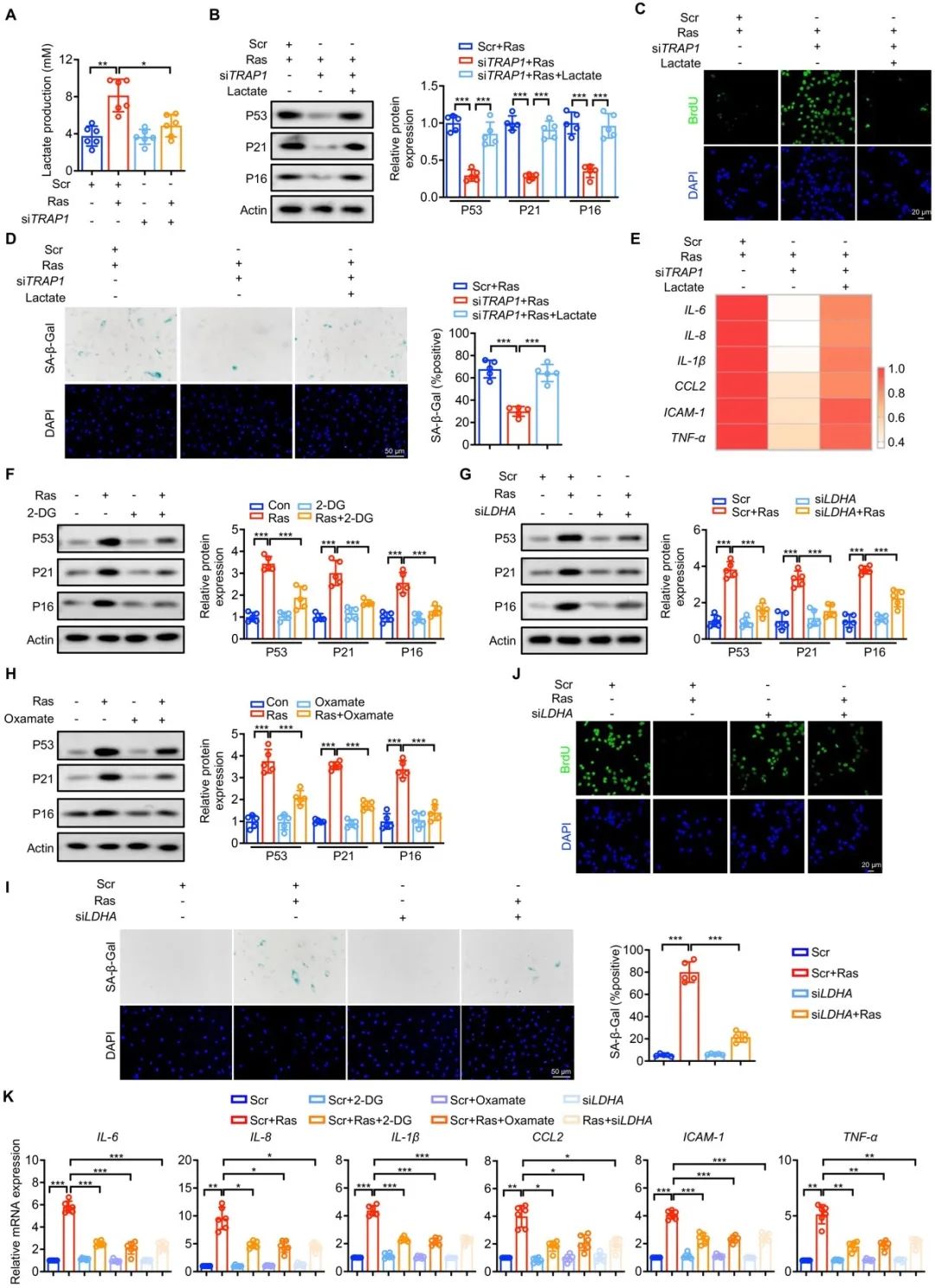
图3. TRAP1介导的乳酸积累促进VSMCs衰老
新近研究发现,乳酸不仅是一种代谢产物,同时也可以作为一种重要的表观遗传调控因子介导组蛋白赖氨酸乳酸化修饰,参与细胞代谢、信号转导和基因表达调控等过程。研究者通过筛选发现TRAP1-乳酸信号轴诱导的H4K12la是衰老VSMCs的特征性乳酸化变化。进一步通过超高分辨率细胞成像技术,研究者发现H4K12la在衰老VSMCs中呈现核周偏移,形成凝聚物的独特变化,揭示H4K12la可能参与染色质高级构象调控基因表达。接下来,研究者通过ChIP和Nuclear Run-On等多种表观遗传方法证实这种核周偏移和凝集现象在功能上导致SASP变化。这些结果证实,在衰老VSMCs中TRAP1诱导乳酸积累,增加H4K12la修饰,促进SASP转录和VSMCs衰老。
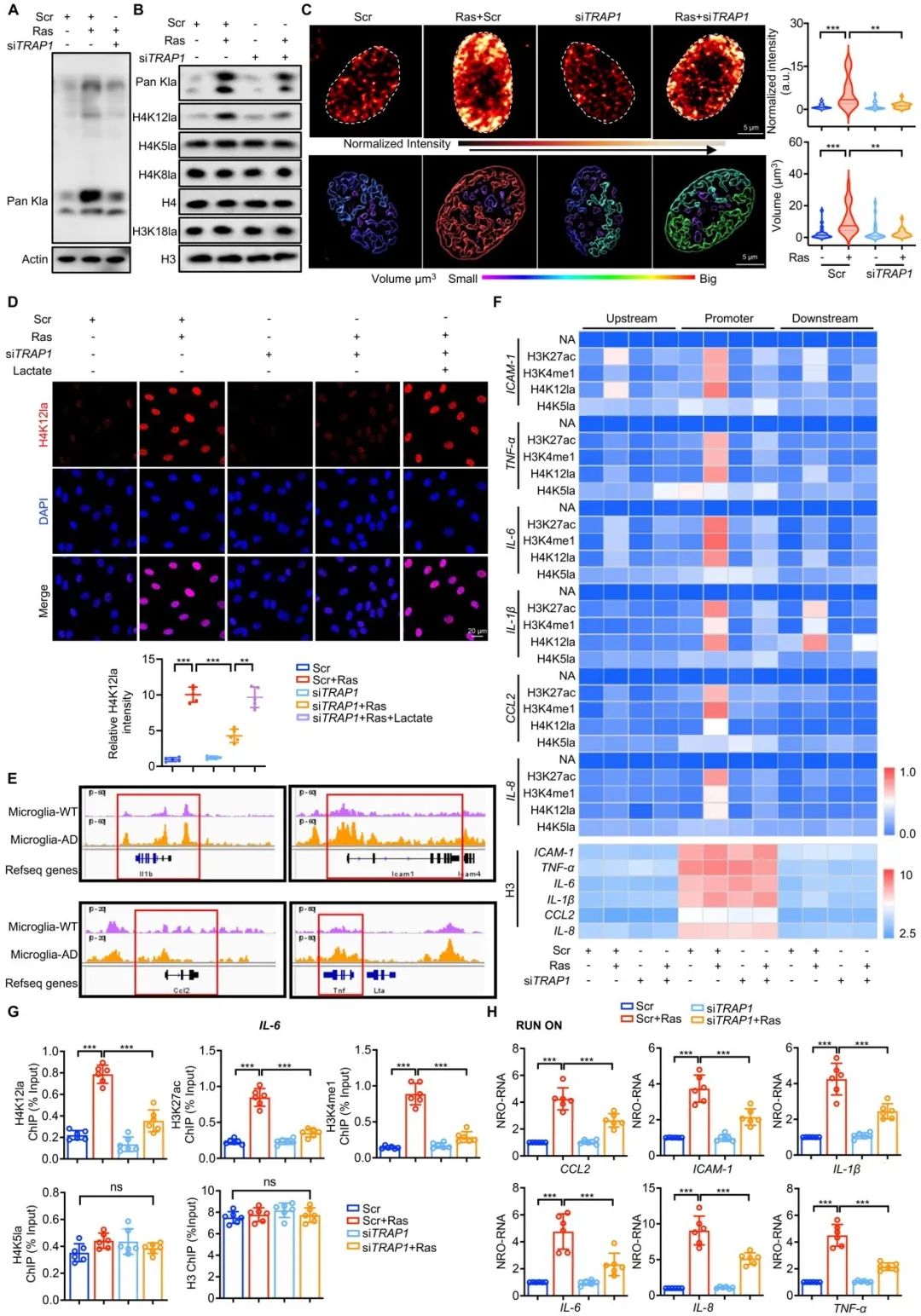
图4. TRAP1介导的H4K12la促进衰老VSMCs中SASP激活
已有研究发现,赖氨酸乳酸化修饰可由“writer”组蛋白乙酰基转移酶p300和“eraser”去乳酸化酶(HDAC1、HDAC2、HDAC3-体外生化实验中证实)协调完成。通过筛选,研究者发现在Ras诱导的VSMCs中,经典组蛋白乳酸化修饰酶P300表达没有改变,而新型去乳酸化酶HDAC3表达显著下降。同时,TRAP1通过乳酸下调衰老VSMCs中HDAC3蛋白的表达。此外,结合ChIP、Re-ChIP和超高分辨率显微镜成像技术,进一步证实TRAP1-HDAC3-H4K12la促进SASP染色质构象变化,诱导VSMCs衰老。基于以上结果,研究者首次在人类疾病中鉴定出HDAC3发挥重要蛋白质去乳酸化修饰作用,并建立了疾病模型中介导H4K12乳酸化修饰完整的“P300-HDAC3”酶促-酶解反应体系。
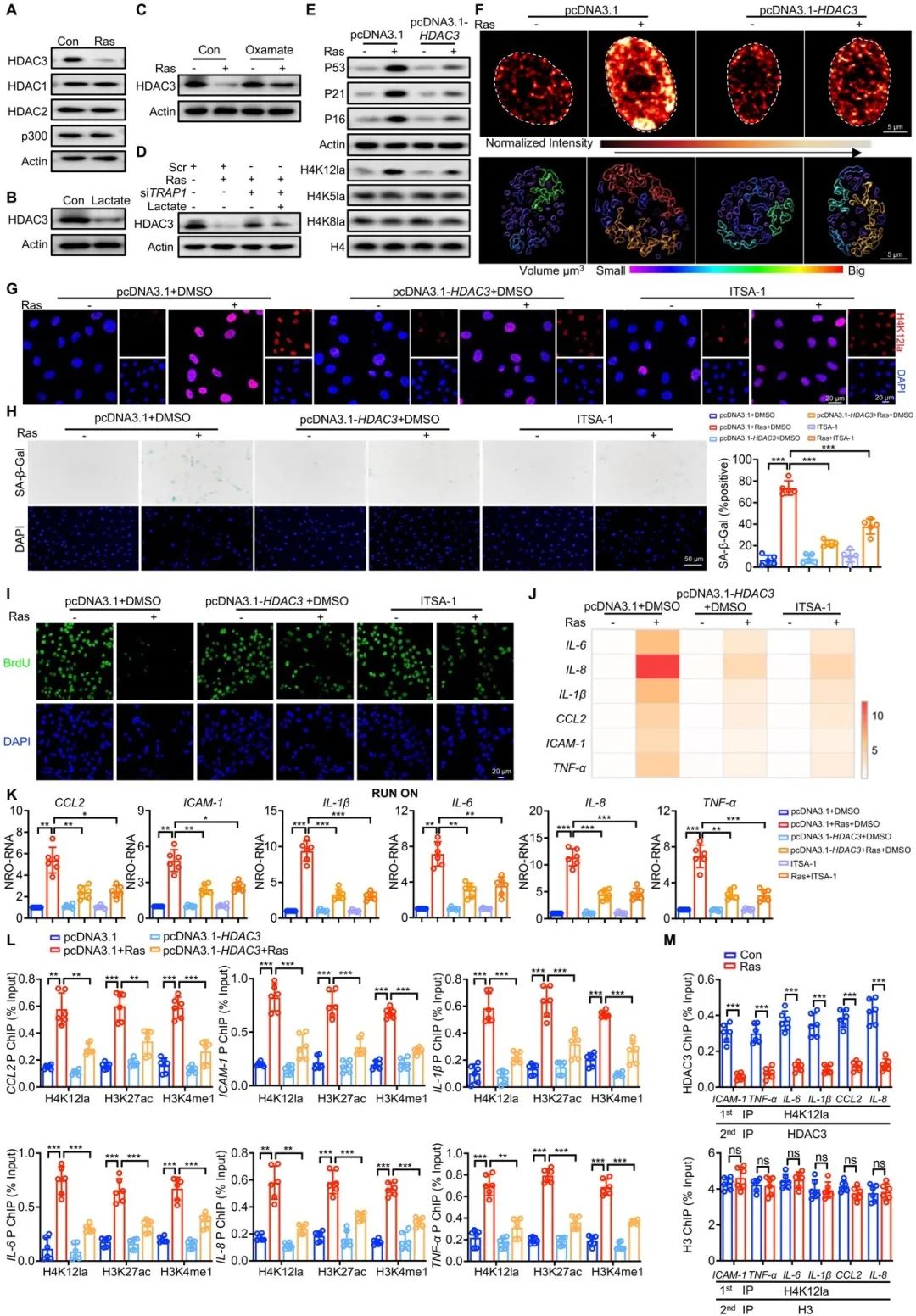
图5. TRAP1通过阻断HDAC3上调H4K12la促进VSMCs衰老
为了明确TRAP1对VSMCs衰老和AS的作用,研究者构建了平滑肌特异性TRAP1敲除的ApoeKO小鼠,并予以动脉粥样硬化造模。结果显示TRAP1敲除小鼠造模后,主动脉根部的脂质积累、斑块面积和坏死核心大小显著减少,胶原含量增加。为了进一步探索其中的细胞机制,研究者提取了造模小鼠VSMCs,通过免疫荧光、Seahorse等检测发现,TRAP1敲除可显著抑制高脂诱导的VSMCs中能量代谢重编程、H4K12乳酸化、SASP转录及衰老的增加。这些结果表明,平滑肌特异性Trap1敲除可有效功能性减少斑块面积,增加斑块稳定性,缓解AS进展。
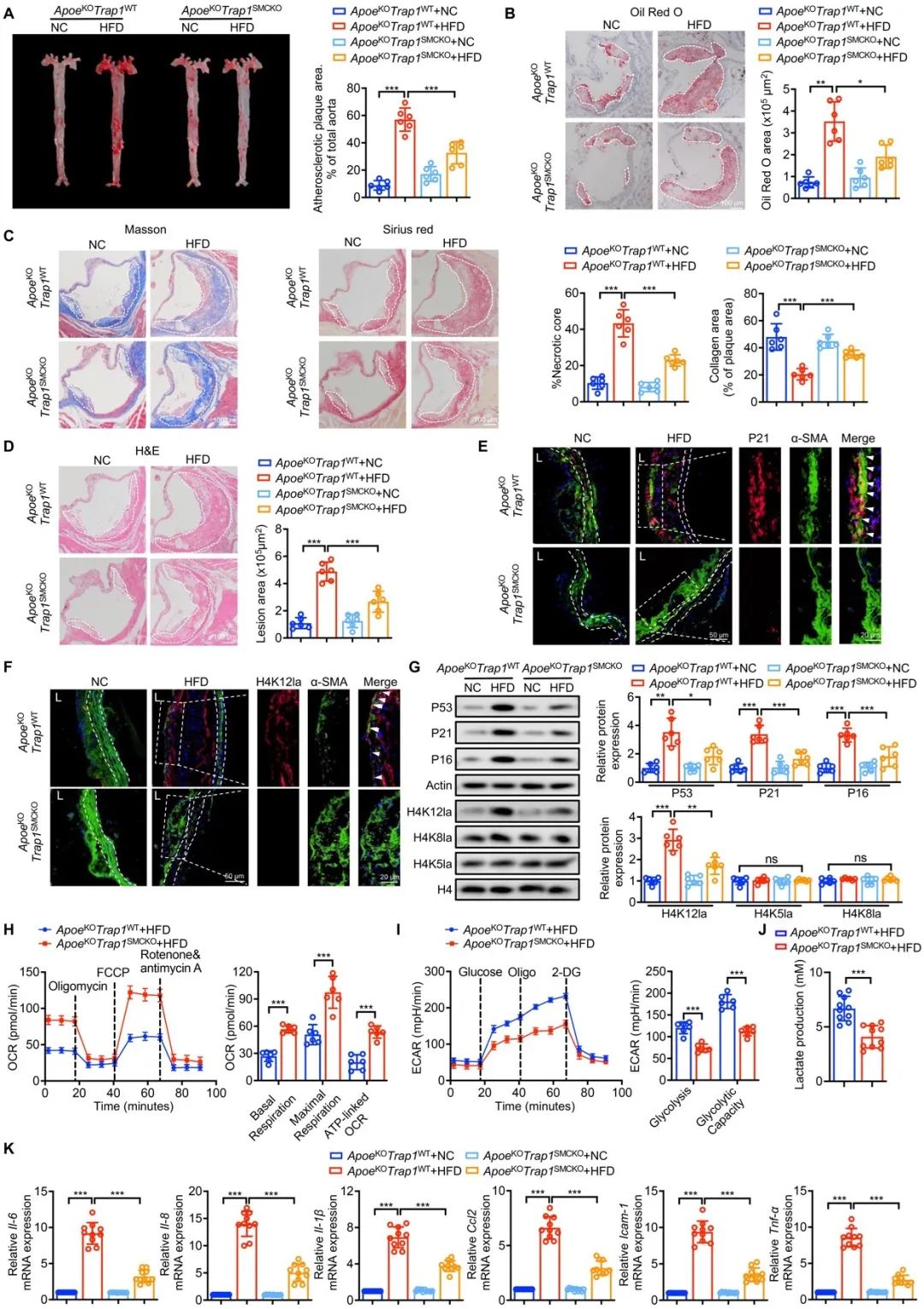
图6. SMC特异性Trap1敲除可改善动脉粥样硬化
G-TPP是一种针对TRAP1高效抑制剂,目前作为抗肿瘤药物已通过I期临床试验。而在本文中,研究者发现G-TPP具有新型抗AS活性,通过降低H4K12la延缓VSMCs衰老和AS。进一步通过实验验证,研究者发现G-TPP治疗AS剂量远小于肿瘤使用剂量,是一种安全有效的抗AS疗法,这提示G-TPP在未来临床应用过程中具有抗AS和抗肿瘤的双重功能。
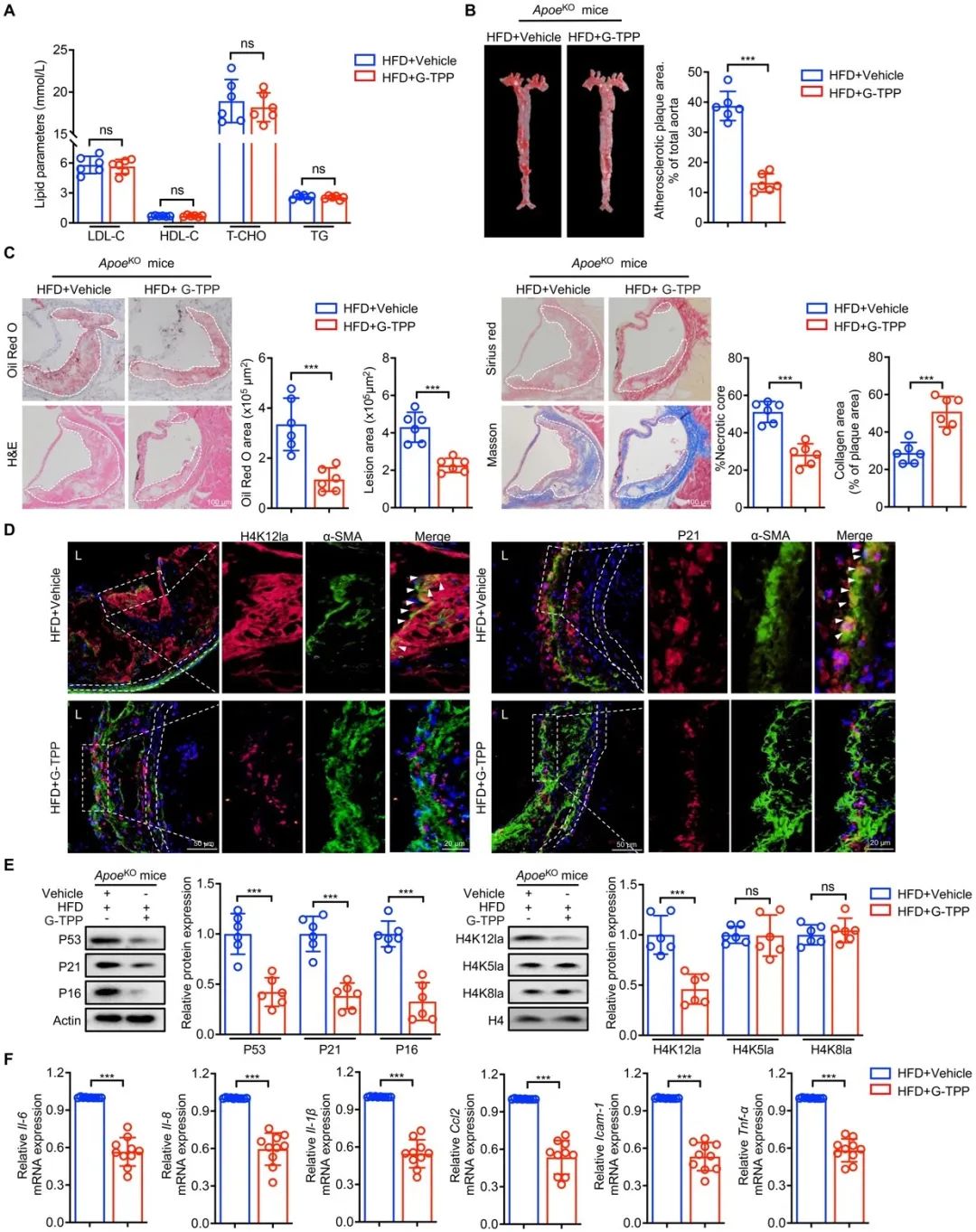
图7. TRAP1的药理抑制剂减缓动脉粥样硬化的发展
近年来,一种新型的蛋白降解技术-PROTAC (Proteolysis Targeting Chimeras, 蛋白降解靶向嵌合体)引起广泛的关注。PROTAC是一种双功能分子,可依赖泛素-蛋白酶体系统,诱导特定靶蛋白被降解,彻底消除其功能,达到治疗疾病的目的。与传统抑制剂相比,PROTAC具有选择性更好、安全性更高、耐药性更低等优势。目前,先进的PROTAC技术在衰老、心血管等领域应用很少。在本文中,研究者使用了PROTAC-BP3靶向降解TRAP1,并探索了其有效降解TRAP1的治疗剂量。研究发现,PROTAC-BP3可有效抑制高脂诱导的平滑肌细胞H4K12la和衰老的增加,减少斑块面积,增加斑块稳定性,缓解AS进展。以上结果提示,PROTAC-BP3用于治疗VSMCs衰老和AS具有很大的潜力和前景。
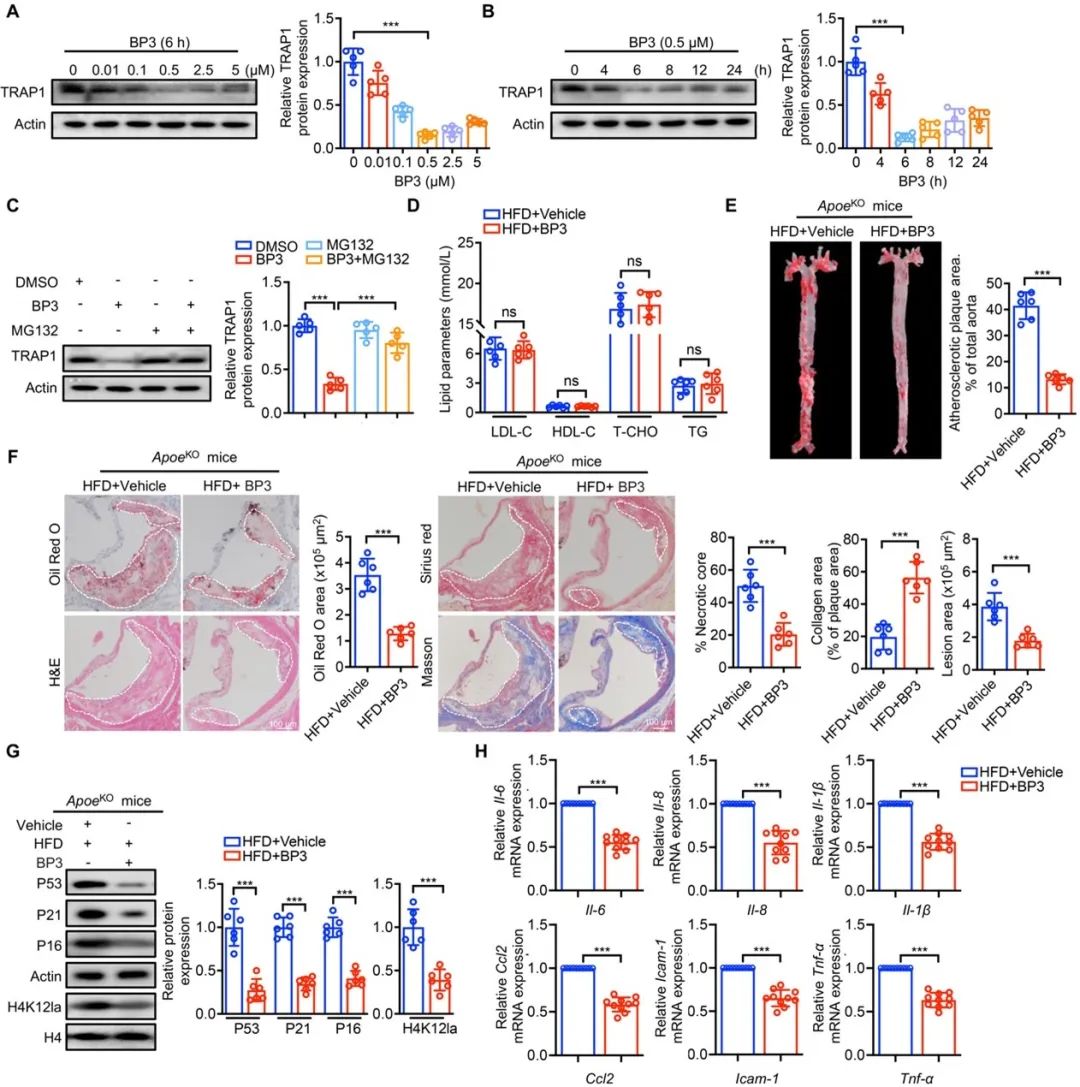
图8. 通过PROTAC降解TRAP1是治疗动脉粥样硬化的新策略
最后,研究者通过评估动脉粥样硬化患者中H4K12la表达发现动脉粥样硬化样本中其水平明显升高,而其他常见的H4乳酸化位点,包括H4K5la和H4K8la没有显著变化。此外,AS临床样本中H4K12la蛋白的表达水平与衰老标志物的表达呈正相关。线性回归分析显示,衰老标志物和SASP的mRNA水平变化与TRAP1的mRNA水平变化密切相关,这些结果表明TRAP1及其介导的H4K12la是AS临床治疗的潜在重要靶点。
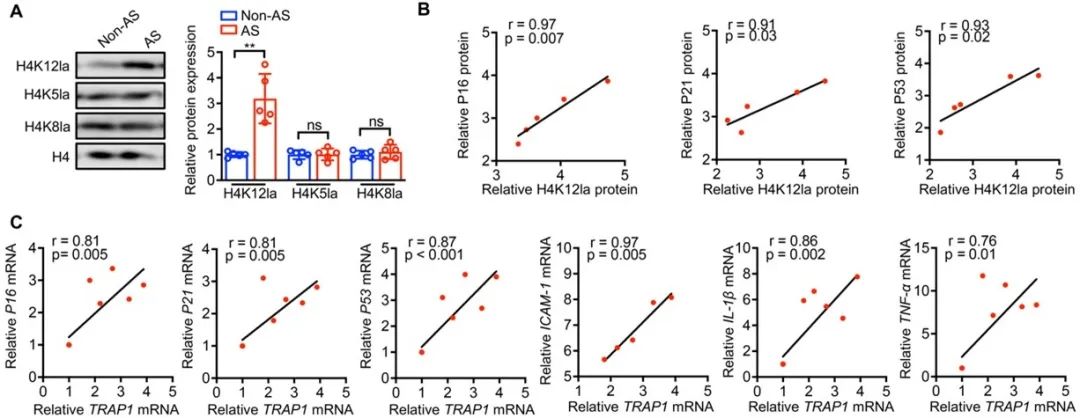
图9. TRAP1和H4K12la可能是临床VSMCs衰老和动脉粥样硬化的关键因素
综上所述,本研究发现TRAP1的高表达引起了能量代谢重编程,导致VSMCs 衰老和AS。进一步证明,TRAP1上调糖酵解导致乳酸积累,并且通过抑制新型组蛋白去乳酸化酶HDAC3表达,促H4K12la,改变组蛋白微环境,从而调节SASP转录激活,促进VSMCs衰老和AS。更重要的是,这也是首次在疾病中发现HDAC3可作为新型组蛋白去乳酸化修饰酶调控VSMCs衰老,对鉴定细胞衰老所致AS的组蛋白乳酸化修饰特征酶及特异修饰位点具有重要意义。这项研究为能量代谢重编程与表观遗传修饰之间的联系提供了新的见解,揭示了细胞衰老的新机制。
该研究通讯作者为南京医科大学药学院陈宏山教授,共同通讯作者为南京医科大学/哈尔滨医科大学季勇教授和南京医科大学附属南京医院(南京市第一医院)心血管内科陈绍良教授。第一作者为南京医科大学药学院江苏省心脑血管药物重点实验室李雪松副教授,共同第一作者为陈明红硕士和陈祥博士生。该项研究获得国家自然科学基面上项目和国家重点研发计划等项目的资助。
原文链接:
https://academic.oup.com/eurheartj/advance-article/doi/10.1093/eurheartj/ehae379/7725663?searchresult=1
作者:论道心血管
版权声明:
本网站所有注明“来源:梅斯医学”或“来源:MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明“来源:梅斯医学”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言











#动脉粥样硬化# #血管平滑肌细胞#
65