Nat Immunol:清华大学免疫所研究者揭示过敏性疾病调控新机制
2018-06-23 佚名 清华免疫
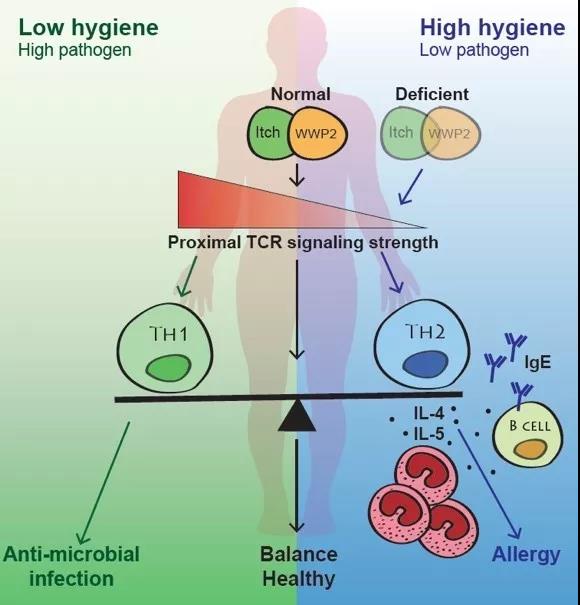
2018年6月20日,清华大学免疫所刘云才课题组在《Nature Immunology》期刊发表论文,揭示了蛋白质泛素化通过改变T细胞受体信号强度和T细胞分化方向来调控过敏性疾病发病的新机制。
作者:佚名
版权声明:
本网站所有注明“来源:梅斯医学”或“来源:MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明“来源:梅斯医学”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言








#研究者#
40
#Nat#
32
#过敏性#
27
#清华#
39
谢谢了.学习
52