CAR-T疗法里程碑:诺华CTL-019获10:0全票通过,FDA专家一致推荐
2017-07-13 MedSci MedSci,医药魔方
7月12日,诺华公司的突破性嵌合抗原受体T细胞疗法(CAR-T)Tisagenlecleucel(CTL-019)获美国 FDA 咨询专家委员会(ODAC)的一致投票(10-0)支持批准。CTL-019申请的适应症是复发或难治性儿童和年轻成人急性淋巴细胞白血病(ALL),在绝大多数情况下,FDA都会遵从专家咨询委员会的意见,也就是说,CTL-019将大概率成为全球首个获批上市的CRA-T疗法。
7月12日,诺华公司的突破性嵌合抗原受体T细胞疗法(CAR-T)Tisagenlecleucel(CTL-019)获美国 FDA 咨询专家委员会(ODAC)的一致投票(10-0)支持批准。CTL-019申请的适应症是复发或难治性儿童和年轻成人急性淋巴细胞白血病(ALL),在绝大多数情况下,FDA都会遵从专家咨询委员会的意见,也就是说,CTL-019将大概率成为全球首个获批上市的CRA-T疗法。这一投票标志着这类实验性治疗的关键里程碑。FDA 预计将于 10 月 3 日做出最终批准决定。宾夕法尼亚大学科学家、领导这一领域药物开发的 Carl June 医师表示,这可能会开启免疫疗法新的篇章 — “一个真正具有生命力的药物”。
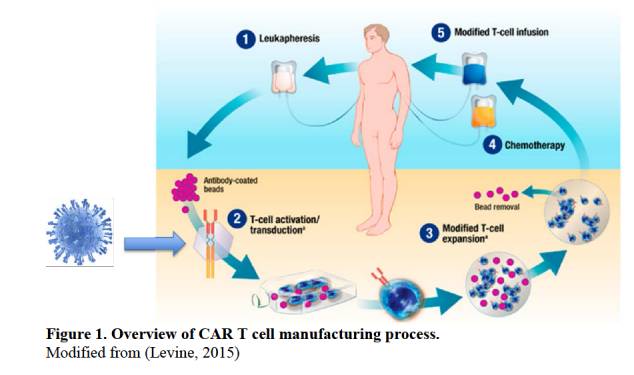
CAR-T 细胞疗法涉及从患者血液中提取称为 T 细胞的白细胞(免疫系统的卫士),将其冷冻并送至诺华在新泽西 Morris Plains 市的庞大制造工厂。在那里,使用改造的 HIV 片段对 T 细胞进行遗传修饰,从而使 T 细胞可以找到并攻击癌细胞。修饰后的细胞重新冷冻并输回患者体内。一旦进入人体,T 细胞数量暴增。
医生和研究人员的兴奋显而易见。宾夕法尼亚大学肿瘤学家、领导诺华淋巴瘤研究的 Stephen Schuster 表示,“我们正在挽救三四年前我们对于让他们维持生命束手无策的患者”。诺华的淋巴瘤研究和 Kite 制药的试验表明,治疗药物可以使约三分之一患有晚期疾病的成年患者(这些患者已经用尽所有治疗选择)得到缓解。
在此次咨询委员会召开的前2天,FDA对外发布了审评文件。资料显示,Study B2202研究入组的88例ALL患者有63例是在美国完成的CAR-T制备和输注。在这63例患者中,52例实现应答(CR或CRi),其中40例在输注后的前3个月内实现完全缓解(观察到肿瘤消失)。52例产生应答患者的中位随访时间4.8个月,中位应答持续期数据尚未获得。29例患者在诺华提交BLA时仍维持缓解,这29例患者的随访时间均接近1年。
Study B2202研究:应答持续期(DOR)
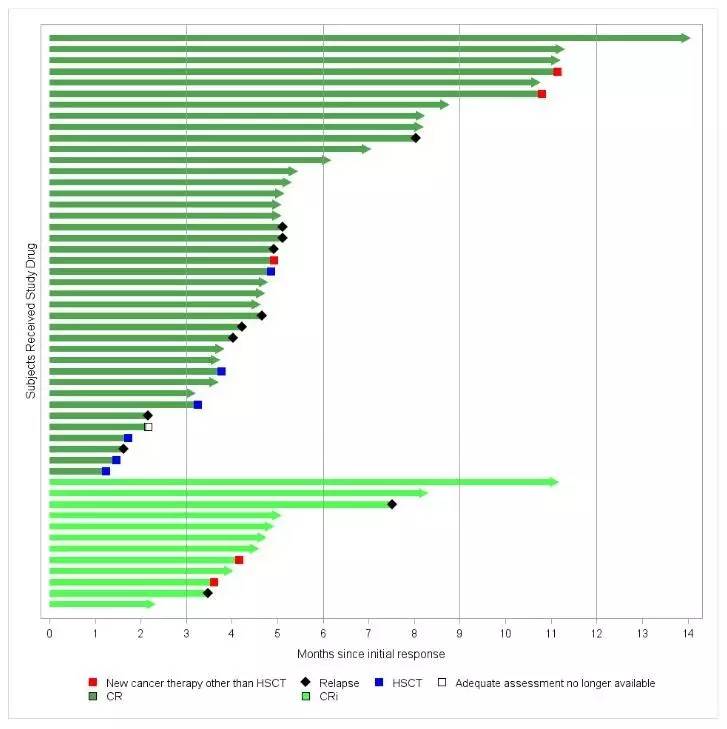
来源:FDA Statistical Reviewer
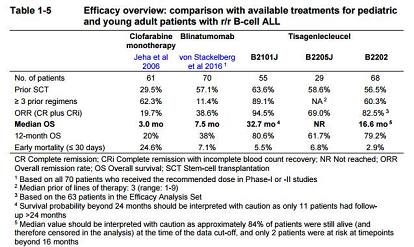
来源:Novartis ODAC briefing documents
实际上,监管机构、临床医生以及行业专家对CTL-019的疗效都没有太大疑问。然而,随着热情而来的是对疗法的安全性、成本和复杂性的紧迫问题。
根据EvaluatePharma的一项调查,美国临床肿瘤医生,特别是儿科医生,对CAR-T疗法的最大的担忧是疗效持续时间、操作的便捷性,其次是毒性。因此,业内一致认为7月12日的外部专家咨询委员会的讨论重点将会集中在CTL-019的安全性和生产环节的质量控制。费城儿童医院的 Stephan Grupp 表示,“安全地治疗患者是推出的核心。有效性问题自会解决,但安全性需要大量关注。”Grupp 是领导早期儿科研究以及诺华全球试验的医院癌症免疫治疗计划主任。
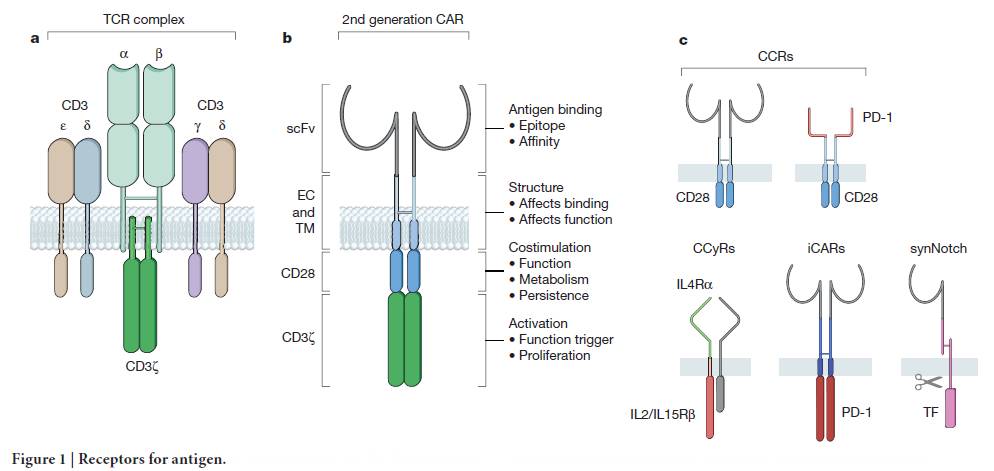
CAR-T疗法是先将患者自身的T细胞分离出来,经过嵌合抗原修饰和扩增后重新输注回患者体内,以激活患者的免疫系统来杀灭肿瘤细胞,这是一个伴有巨大个体差异的操作过程,具有很高的不确定性。诺华在上周5的电话会议还表示仍在对CAR-T产品的制备过程进行优化,以降低失败率,保证满足批量生产的需求。诺华公司代表Fisk则表示详细的制备过程涉及知识产权保护,不会向公众披露。
CAR-T的生产制备过程
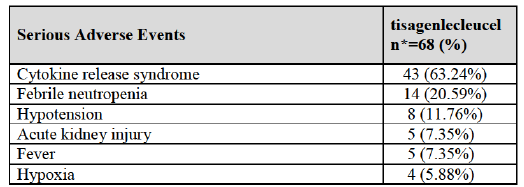
最常见的副作用之一是细胞因子释放综合症,可引起高热和焦虑症状,在某些情况下可能过于危险使患者需要处于重症监护中。另一主要担心是神经毒性,这可能导致暂时的意识混乱或潜在的致命脑水肿。Juno Therapeutics 公司的JACR015在五名患者因脑水肿死亡后关闭了其 CAR-T 计划,临床研究一度被FDA叫停,最终难挡失败。诺华公司官方表示,诺华在其试验中未见脑水肿。在CAR-T疗法竞赛中,诺华的风头原本并不及JUNO和Kite,但是在临床研究中先后出现5例脑水肿引起的患者死亡(见:FDA许可Juno继续进行CAR-T细胞治疗临床试验,化疗药物更换为环磷酰胺(ROCKET试验), CAR-T疗法JCAR015失败,JUNO公司数千万美元打水漂)。Kite制药的KTE-C19也在4月底出现1例患者死亡,惊得投资人一身冷汗(见:意外!Kite制药CAR-T疗法KTE-C19出现1例患者死亡)。鉴于此,FDA对CTL-019安全性方面的关心和谨慎是非常容易理解的。
Study B2202研究:发生率>5%的严重不良反应
Study B2202研究:细胞因子释放综合征的处理情况
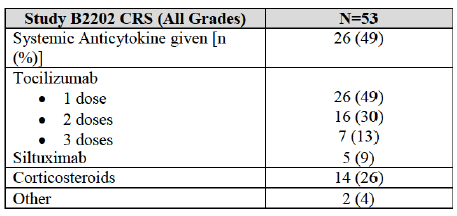
此外,FDA对CAR-T疗法的长期风险也有担忧。由于需要对T细胞进行修饰,会不会造成它们DNA突变而变得具有潜在致癌性?诺华未提供相关数据,只是回应称长期观察结果来看CAR-T疗法并没有致癌效应。
为确保患者安全,诺华公司没有计划典型的尽可能广泛和积极的产品推广。取而代之的是,公司将指定 30 至 35 个医疗中心实施治疗。其中许多医护人员参加了临床试验,并得到 Grupp 等人的大量培训。
在外部专家对CTL-019的上市申请做出10:0的肯定推荐后,不确定性已经很小,CTL-019大概率成为全球首个上市的CAR-T疗法,这是PD-1/PD-L1类药物上市近3年后肿瘤免疫治疗领域又一件具有里程碑意义的重磅事件,同时也为其他几家公司的CAR-T产品上市铺平了道路。
CAR-T是为数不多的中国不落后于西方国家的药品研发领域,中国在ClinicalTrials.gov登记的CAR-T相关临床研究数量仅次于美国。除了大手笔引进Kite制药CAR-T产品中国市场开发权利的复星医药外,国内其他在CAR-T疗法布局的公司还包括西比曼、博生吉、安科生物、恒瑞医药、中源协和……等。如今诺华CTL-019获得FDA专家的推荐批准无疑增加了这些公司的信心。
CAR-T 的历史
CAR-T 细胞疗法的批准将代表不到十年间的第二次重大免疫治疗进展。2011 年 FDA 批准了一类称为免疫检查点抑制剂(Immune Check Point)的新药中的首个制剂。从那以后,已经批准了另外五个药。这两种疗法之间存在很大差异。检查点抑制剂针对实体瘤,如晚期黑色素瘤、肺癌和膀胱癌,而 CAR-T 细胞疗法则针对血液病。尽管检查点抑制剂是现成的,每个患者都服用相同的药物,CAR-T 细胞疗法则是针对个体定制的。许多免疫治疗专家认为,当研究人员找到如何结合这两种方法时,将会实现癌症的最大进展。
对于宾夕法尼亚大学团队来说,CAR-T 细胞的故事可追溯到数十年前,开始于马萨诸塞州 Bethesda 市之后被称为国家海军医疗中心的地方,在那里 June 和一位叫 Bruce Levine 的博士后研究员从事新的 HIV 治疗研究。在这个过程中,他们想出一种增强 T 细胞以使其更强大更充足的方法。两位搭档于 1999 年搬到费城,转向癌症研究。两年后,June 的妻子死于卵巢癌,这件事激励他在这一领域更加努力工作。在随后的几年中,全国各地的研究人员获得了关于 T 细胞的一系列诱人发现。
快进到 2010 年,Bill Ludwig 成为宾夕法尼亚大学第一接受 CAR-T 细胞治疗的患者。另外两人在不久之后接受治疗。一人仍处于缓解期,另一人复发死亡。但在这三名患者之后,宾夕法尼亚大学的研究人员花光的钱而无法进行更多治疗。为提升人们对这一疗法的兴趣和获得资金,他们决定公布研究成果。2011 年 8月在新英格兰医学杂志(NEJM)上发表的文章引发了一场风暴,给他们带来了新资源。儿科试验与 Emily 治疗的成功开启了下一个春天。六个月后,宾夕法尼亚大学将其技术转让给诺华以换取资金支持,其中包括一个新的校内细胞制造设施。
FDA 的批准似乎即将到来,研究人员在治疗方法的开发和测试方面发挥了重要作用。
与CAR-T相关的拓展阅读:- 前沿探索:CAR-T细胞疗法应用到实体瘤的希望在何方?
- 两项重磅CAR-T疗法临床2期结果同时出炉
- ASCO 2017:CAR-T疗法联合伊布替尼治疗CLL,早期结果客观
- 艾森技术新突破与美国著名癌症中心合作研究CAR-T免疫治疗
- 数据公布,诺华新一代CAR-T疗法CTL119取得优异疗效
- CAR-T疗法JCAR015失败,JUNO公司数千万美元打水漂
- Nature:让CAR-T疗法更“牛”,这10个方向或许你该看看
- ASCO 2017:CAR-T细胞疗法使骨髓瘤患者获得持续缓解
- Nat Nanotechnol:重磅!利用纳米颗粒在体内制造CAR-T细胞
- 梳理CAR-T细胞疗法研究最新进展
- 意外!Kite制药CAR-T疗法KTE-C19出现1例患者死亡
- 人源CAR-T疗法挽救三位急淋白血病患者生命
- 「创意支架」搭载CAR-T,联合免疫疗法助力消灭实体瘤!
- 附属仁济医院李宗海团队CAR-T细胞治疗生物大楼落成启用
- 诺华CAR-T CTL019再获突破性疗法认定 更多信息请点击:有关CAR-T更多资讯
(内容整理于医药魔方,共识林等多个报道)
作者:MedSci
版权声明:
本网站所有注明“来源:梅斯医学”或“来源:MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明“来源:梅斯医学”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言







#CTL-019#
43
#CAR-#
41
#里程碑#
30
#诺华#
40
学习了涨知识
61