Nat Rev Clin Oncol综述:HER2靶向疗法在乳腺癌以外实体瘤中的应用前景、耐药机制及联合治疗策略
2024-09-01 测序中国 测序中国
该综述整合了近5年HER2在乳腺癌以外实体瘤中应用的全新进展,概述了HER2靶向治疗耐药性机制,提供了未来有望克服耐药的HER2靶向治疗策略,对HER2靶向治疗领域的发展具有促进意义。
人表皮生长因子受体-2(HER2)在20世纪80年代被发现,是迄今为止被研究的比较透彻的乳腺癌相关基因之一,已成为乳腺癌靶向治疗药物选择的一个重要靶点。随着肿瘤致病基因及其机制的深入研究,HER2在乳腺癌以外实体瘤中的生物学特性正逐渐引起学界的重视。HER2作为重要的候选泛癌治疗靶点,其靶向疗法已逐渐扩大至其他肿瘤类型。
近日,韩国研究团队在Nature Reviews Clinical Oncology上发表了题为“HER2-targeted therapies beyond breast cancer — an update”的综述文章,介绍了近5年关于HER2靶向疗法研究取得的成果进展,包括新的疾病适应症、具有不同作用机制的创新药物以及新的监管措施,尤其强调了抗HER2抗体-药物偶联物曲妥珠单抗deruxtecan在HER2过表达实体瘤患者中的应用。

01 HER2靶向治疗适应症扩大到乳腺癌/胃癌之外的实体瘤类型
HER2是一种ErbB受体酪氨酸蛋白激酶,由位于染色体17q12的ERBB2基因编码[1]。然而,该受体不具有直接的配体结合活性,而是作为其他三个ErbB家族成员的首选异二聚化伙伴发挥作用。ERBB2扩增和/或HER2的过表达导致过度激活下游通路,从而驱动细胞转化、存活、增殖、侵袭,进而驱动肿瘤生长和转移[2,3]。HER2过表达或ERBB2扩增已在各种肿瘤类型中发现(图1),因此,HER2靶向疗法正在扩大到乳腺癌和胃癌之外的实体瘤类型[4]。
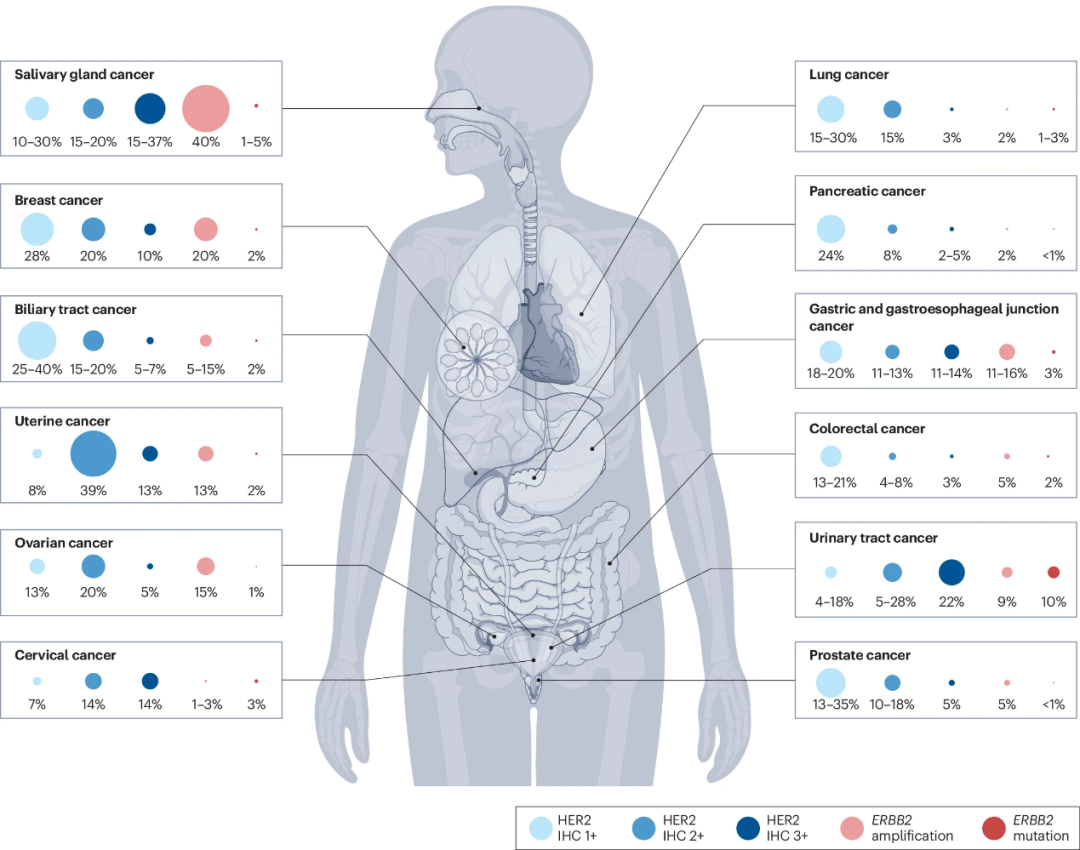
图1.不同肿瘤类型中HER2突变频率
2024年4月,抗HER2抗体-药物偶联物(ADC)曲妥珠单抗deruxtecan(T-DXd)获FDA批准用于既往接受过治疗的晚期HER2过表达实体瘤患者,成为难治性HER2阳性胃/胃食管结合部癌(G/GEJC)、HER2突变型非小细胞肺癌(NSCLC)或任何HER2过表达(免疫组化3+)实体瘤患者的新护理标准。
HER2突变的生物学特性因肿瘤类型而异,一些涉及细胞外结构域(ECD)的致癌性ERBB2突变通过HER2的结构变化引起持续异源二聚化,从而促进肿瘤生长(图2)。
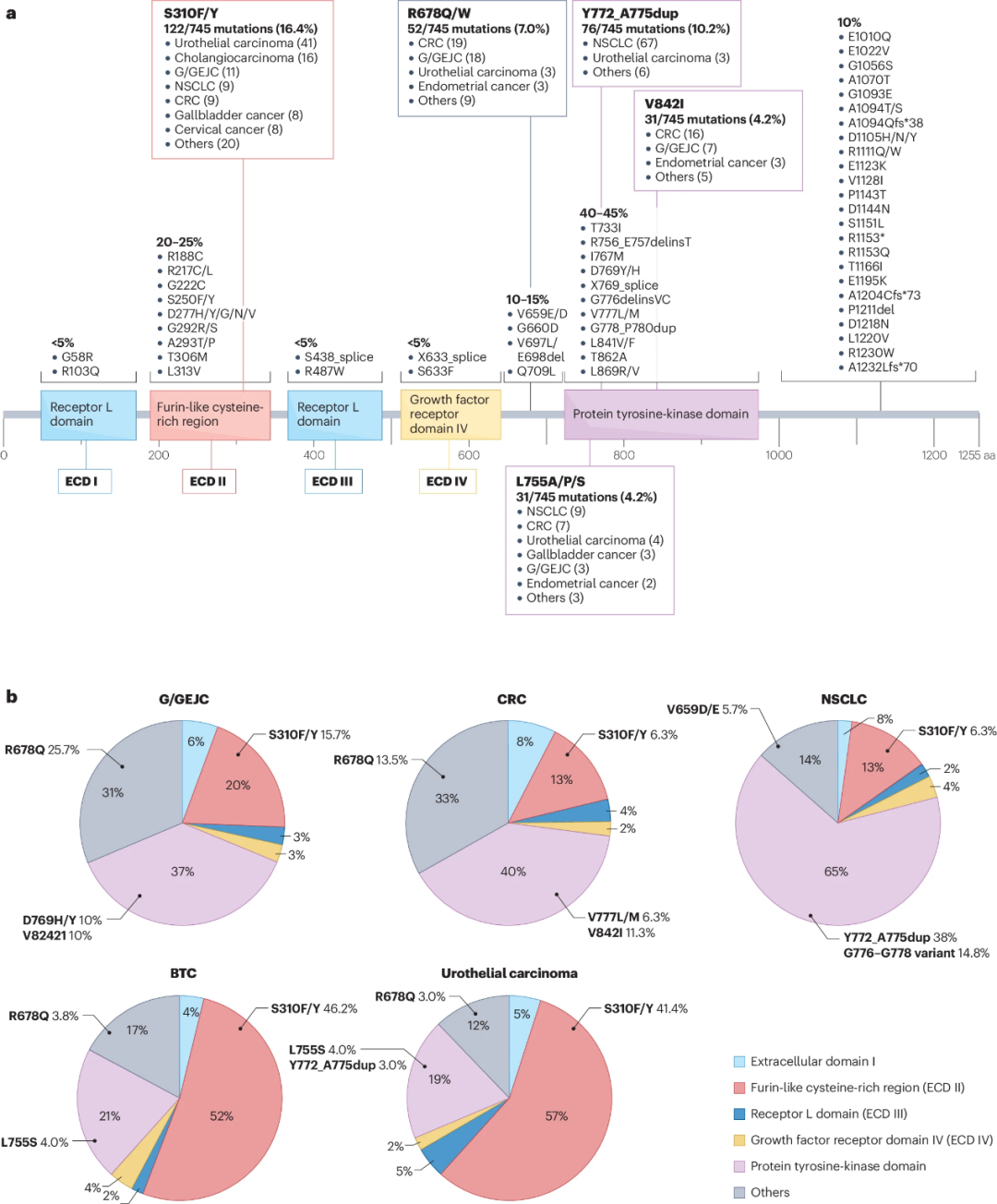
图2.致癌ERBB2基因突变在不同肿瘤类型中的分布
近年来,HER2靶向药物如单克隆抗体(mAb)、小分子TKIs、定向ADCs(图3)、bpAbs、双特异性T细胞接合剂(BTEs)(图4)等均已开发出来并逐步应用于临床,与各肿瘤类型相匹配。
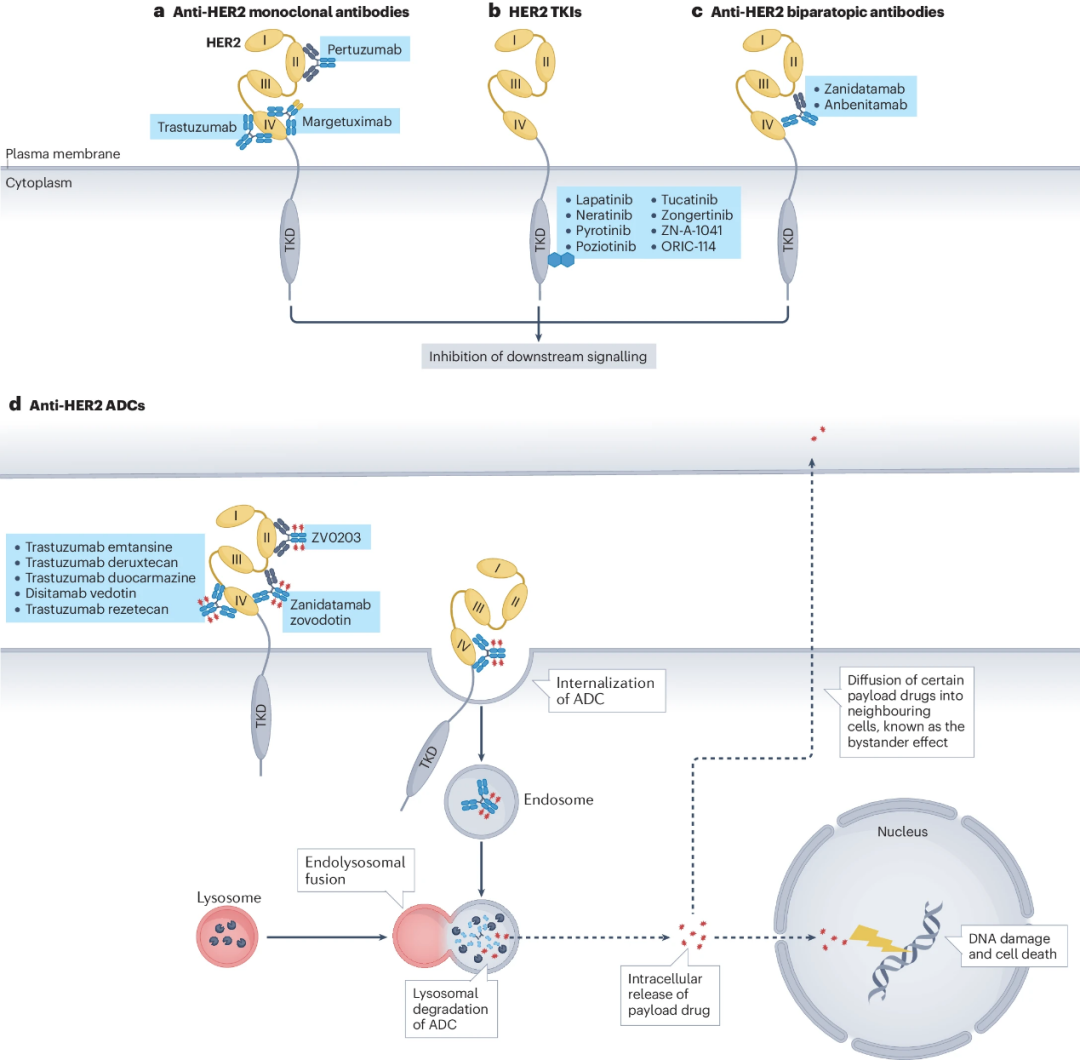
图3.HER2靶向药物(TKIs、ADCs)等的作用机理
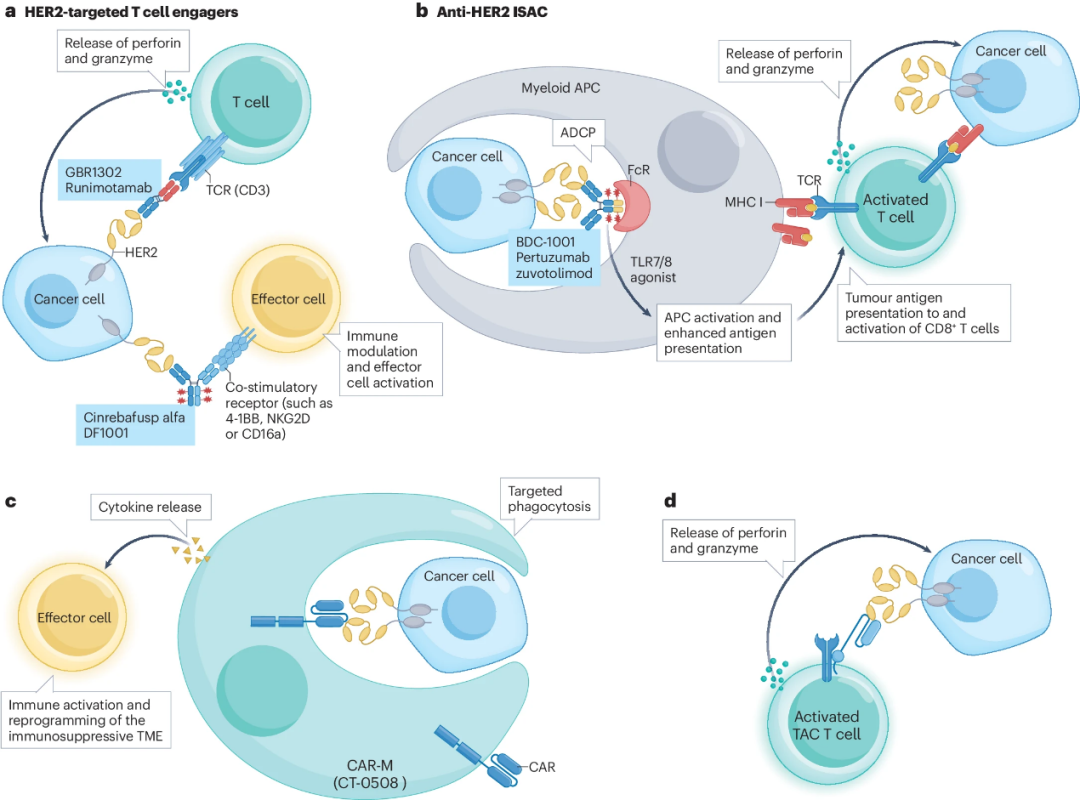
图4.BTEs与细胞疗法等靶向药物的作用机理
02 HER2靶向疗法为晚期G/GEJC患者提供新的一线治疗选择
一项II期DESTINY-Gastric01试验评估了德曲妥珠单抗(T-DXd)在G/GEJC患者中的疗效,包含HER2 IHC 2+和ISH−或IHC 1+疾病患者的探索性队列[5]。与II期HERB试验[6]、STATICE试验[7]结果相似,该研究发现HER2低表达患者人群对T-Dxd治疗有反应,表明T-Dxd具有治疗乳腺癌以外HER2低表达实体瘤的潜力。
但在CRC中,HER2靶向治疗的疗效更依赖于高表达HER2,因此,想要将HER2靶向治疗适应症扩大到HER2低表达人群,仍需要进一步研究每种肿瘤类型的生物学特异性。
03 HER2靶向疗法耐药性
1.获得性耐药机制
HER家族蛋白表达改变是HER2靶向疗法获得性耐药的一种靶向机制,与敏感癌细胞相比,耐药癌细胞的细胞表面HER2表达显著降低。目前已开发出具有新型有效载荷和/或更高药物抗体比(DAR)的强效第二代ADCs,如T-DXd和ARX788,它们对HER2低表达肿瘤、耐药性肿瘤仍保持着较高的活性。
第二种耐药性的获得性机制涉及靶表位的丢失或掩蔽。例如,细胞表面粘蛋白或HER2结合蛋白(如t-DARPP)的上调或HER2糖基化的改变会干扰结合。
此外,肿瘤内异质性也是导致HER2疗效不佳的主要原因。当在三种具有不同HER2表达的异种移植模型中评估T-DXd时,该ADC和曲妥珠单抗成分在肿瘤组织中的分布取决于HER2表达水平;但有效载荷分布到与HER2阳性肿瘤相邻的HER2阴性区域,这表明肿瘤中存在“旁观者效应”。这种旁观者效应被认为是一种关键机制,可能会改善HER2异质性表达的实体瘤的治疗反应。
2.脱靶耐药机制
引起HER2下游信号通路的改变也可以抵消HER2靶向药物的抗肿瘤作用。PTEN丢失和 PI3K通路其他组成部分的激活突变代表了这种对抗HER2疗法的脱靶耐药机制。
事实上,激活代偿信号通路以克服HER2靶向药物的作用已被证实为一种重要的脱靶耐药机制。对HER2阳性食管癌患者在疾病进展期间不同时间点取样的多个转移部位的分析,揭示了新发EGFR或MET扩增,MET的旁路激活会重新刺激HER2下游的信号通路,从而阻止了HER2靶向药物对细胞的生长抑制作用。
HER2阳性和细胞周期调节基因(如CCNE1和CDK6)同时发生扩增的G/GEJC患者已被证明对HER2疗法耐药,并且已提出与DNA损伤反应(DDR)抑制药物联合治疗的抗耐药策略。
04 新型HER2靶向疗法策略
1.联合免疫疗法
在HER2过表达的癌细胞系中观察到PD-L1的表达升高。临床前研究表明,PD-L1在HER2靶向药物产生耐药性期间或获得耐药性时被诱导表达,且HER2表达水平与胃癌患者的肿瘤免疫状态密切相关。因此,免疫检查点抑制剂(ICI)与曲妥珠单抗和化疗相结合的策略成为HER2阳性G/GEJC患者的新护理标准。
2.联合DDR抑制剂
在曲妥珠单抗耐药细胞系中,ATM抑制剂和PARP1抑制剂的组合显示出强大的合成致死性。此外,单独使用奈拉替尼已被证明可在HER2过表达的子宫浆液性癌中诱导多聚核糖基化,并且其与PARP1抑制剂的组合具有协同抗肿瘤作用。由于诱导双链DNA断裂,DDR抑制剂在增强拓扑异构酶I抑制剂的遗传毒性作用方面具有潜在的协同活性,例如有效载荷T-DXd。
3.联合其他靶向治疗
已有研究表明,其他致癌靶点与HER2可能同时被抑制,以最大限度地提高抗肿瘤效果。FGFRs的上调是参与HER2靶向治疗耐药的主要旁路机制之一,已成为HER2阴性G/GEJC的新治疗靶点,也被认为是抗HER2治疗的组合靶点。在少数G/GEJC和CRC患者中已检测到HER2和FGFR2在肿瘤组织中的共表达,表明HER2与FGFR2有望成为该患者人群的靶向治疗联合靶点。
此外,PI3K-AKT通路可能是克服对HER2靶向药物耐药的良好靶点。AKT抑制剂与曲妥珠单抗联合使用可在患者来源、HER2扩增的PIK3CAE545G突变胃癌细胞系中产生有意义的抗肿瘤作用。
综上所述,该综述整合了近5年HER2在乳腺癌以外实体瘤中应用的全新进展,概述了HER2靶向治疗耐药性机制,提供了未来有望克服耐药的HER2靶向治疗策略,对HER2靶向治疗领域的发展具有促进意义。
原文链接:
https://www.nature.com/articles/s41571-024-00924-9#Sec23
参考资料:
[1] Popescu, N. C., King, C. R. & Kraus, M. H. Localization of the human erbB-2 gene on normal and rearranged chromosomes 17 to bands q12-21.32. Genomics 4, 362–366 (1989).
[2] Citri, A. & Yarden, Y. EGF-ERBB signalling: towards the systems level. Nat. Rev. Mol. Cell Biol. 7, 505–516 (2006).
[3] Gutierrez, C. & Schiff, R. HER2: biology, detection, and clinical implications. Arch. Pathol. Lab. Med. 135, 55–62 (2011).
[4] Oh, D. Y. & Bang, Y. J. HER2-targeted therapies — a role beyond breast cancer. Nat. Rev. Clin. Oncol. 17, 33–48 (2020).
[5] Yamaguchi, K. et al. Trastuzumab deruxtecan in anti-human epidermal growth factor receptor 2 treatment-naive patients with human epidermal growth factor receptor 2-low gastric or gastroesophageal junction adenocarcinoma: exploratory cohort results in a phase II trial. J. Clin. Oncol. 41, 816–825 (2023).
[6] Ohba, A. et al. Trastuzumab deruxtecan (T-DXd; DS-8201) in patients (pts) with HER2-expressing unresectable or recurrent biliary tract cancer (BTC): an investigator-initiated multicenter phase 2 study (HERB trial). J. Clin. Oncol. (2022).
[7] Nishikawa, T. et al. Trastuzumab deruxtecan for human epidermal growth factor receptor 2-expressing advanced or recurrent uterine carcinosarcoma (NCCH1615): the STATICE trial. J. Clin. Oncol. 41, 2789–2799 (2023).
作者:测序中国
版权声明:
本网站所有注明“来源:梅斯医学”或“来源:MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明“来源:梅斯医学”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言









#乳腺癌# #耐药机制#
44