[摘要] 背景与目的:随着人口老龄化,老年结直肠癌(colorectal cancer,CRC)患者日益增加。目前高龄Ⅱ期CRC患者在接受根治术后通常接受减弱的化疗方案或不化疗,而这是否会引起不良的肿瘤学结局目前仍不明确。本研究旨在通过多因素COX回归分析方法探究去除偏倚后,高龄对于Ⅱ期CRC患者预后的影响。方法:回顾性收集3 314例2008—2019年在复旦大学附属肿瘤医院接受过手术治疗且术后病理学检查结果为Ⅱ期、无既往肿瘤史、术后5年内无第二原发肿瘤且术前未接受新辅助治疗的CRC患者。本研究通过复旦大学附属肿瘤医院医学伦理委员会的审查(伦理编号:050432-4-2108*)。使用R软件(version 3.0)的survminer包(surv_cutpoint算法)计算年龄相对于生存的最佳临界值为73岁。比较高龄组(年龄>73岁)和非高龄组(年龄≤73岁)的临床病理学特征、总生存期(overall survival,OS)和无病生存期(disease-free survival,DFS),并使用survival包和rms包绘制列线图预测模型。结果:高龄组和非高龄组在性别、肿瘤位置、分化、脉管侵犯、神经侵犯和pT分期等方面均衡可比。多因素COX回归分析显示,高龄是OS[风险比(hazard ratio,HR)=3.667(2.946~4.565),P <0.001]和DFS[HR=2.368(1.953~2.872),P<0.001]的独立预后危险因素。根据多因素COX回归分析构建的列线图预测模型可以有效地评估Ⅱ期CRC患者的预后。结论:在Ⅱ期CRC患者中,高龄与较短的OS及DFS相关。足够强度的辅助化疗或许是必要的。治疗决策可根据患者列线图预测模型得分进行调整。
[关键词] 结直肠癌;高龄;预后;化疗方案;预测模型
[Abstract] Background and purpose: With the aging population, the number of elderly patients with colorectal cancer (CRC) is increasing. To date, elderly patients with stage Ⅱ CRC often receive a weakened chemotherapy regimen or even no chemotherapy after radical surgery, and It is still unclear whether this will lead to adverse oncological outcomes. This study aimed to explore the prognostic impact of advanced age on stage Ⅱ CRC patients after removing bias through a multivariate COX regression approach. Methods: We retrospectively collected data of 3314 colorectal cancer patients with postoperative pathology of stage Ⅱ, no history of previous tumors, no secondary primary tumors within 5 years after surgery and no preoperative neoadjuvant therapy. This study was reviewed by the medical ethics committee of Fudan University Shanghai Cancer Center (ethics number: 050432-4-2108*). The optimal threshold for calculating age relative to survival using survminer package of R software (version 3.0) (surv_cutpoint algorithm) was 73 years. We compared the clinical and pathological characteristics, overall survival (OS) and disease-free survival (DFS) between the older group (age>73 years) and the younger group (age≤73 years). The alignment diagram prediction model was drawn using the survival package and RMS package. Results: The elderly and non-elderly groups were evenly comparable in terms of gender, tumor location, differentiation, vascular invasion, perineural invasion and pT stage. Multivariate COX regression showed that advanced age was an independent prognostic risk factor for OS [hazard ratio (HR)=3.725 (3.051-4.549), P<0.001] and DFS [HR=2.431 (2.029-2.912), P<0.001]. The nomogram (alignment diagram) prediction model constructed based on multivariate COX regression could effectively evaluate the prognosis of stage Ⅱ CRC patients and provide guidance for practical clinical work. Conclusion: In stage Ⅱ CRC patients, older age is associated with shorter OS and DFS. Adequate intensity of adjuvant chemotherapy may be necessary. Treatment decisions can be adjusted based on the predicted model scores of the patient’s alignment diagram.
[Key words] Colorectal cancer; Advanced age; Prognosis; Chemotherapy regimen; Prediction model
结直肠癌(colorectal cancer,CRC)是世界第三大常见癌症[1-2]。随着医疗条件的改善,全世界许多地区出现人口老龄化,老年CRC患者的治疗需求也因此日益增加[3-5]。辅助化疗对接受过根治性手术的老年Ⅱ期CRC患者的益处目前仍存在争议[6-7]。多项研究[8-11]已证实,3个月的辅助化疗相比6个月具有非劣效性,因此越来越多的临床工作者倾向于为老年患者制订更为温和的化疗方案,以避免化疗引发的不良反应。然而,有国外研究[12-13]表明,高龄与CRC患者较差的临床结局相关,提示CRC高龄患者可能存在治疗不足。
目前大多数临床试验纳入的患者不超过75岁,然而CRC患者诊断时的中位年龄为68岁,约60%的患者在初次诊断时年龄超过65岁[1,14],因此针对老年CRC患者的循证医学指南亟待完善和补充。本研究旨在探明高龄对Ⅱ期CRC患者预后的影响。
1 资料和方法
1.1 患者选择
复旦大学附属肿瘤医院在2008年1月—2019年12月共收治了18 834例CRC患者。回顾性收集患者手术时的年龄、性别、原发肿瘤位置、肿瘤分化等级、病理学分期以及随访期间患者是否复发或死亡等临床病理学特征。本研究通过门诊随访、电话随访及中国疾病预防控制中心数据随访获取患者生存时间,以上3种随访手段中最后记录的接触记录被定义为末次随访日期,随访截至2021年2月19日。本研究通过复旦大学附属肿瘤医院医学伦理委员会的审查(伦理编号:050432-4-2108*)。
1.2 纳入和排除标准
纳入标准:① 2008—2019年被诊断为CRC并在复旦大学附属肿瘤医院接受过手术治疗;② 术后病理学分期为Ⅱ期。排除标准:① 有既往肿瘤史;② 术后5年内有第二原发肿瘤;③ 术前接受过新辅助治疗。所有患者术前均签署了知情同意书。
1.3 生存数据的定义
总生存期(overall survival,OS)为术后开始至因任何原因死亡的时间。无病生存期(disease-free survival,DFS)为术后开始至肿瘤复发或因任何原因死亡的时间。无局部复发生存期(local recurrence-free survival,LRFS)为术后开始至局部复发或因任何原因死亡的时间。无远位转移生存期(distant metastasis-free survival,DMFS)为术后开始至远位转移或因任何原因死亡的时间。截至统计时尚未发生终点事件及未知终点事件的患者,在末次随访时间点按删失处理。
1.4 统计学处理
使用SPSS 26.0软件进行数据分析,使用GraphPad Prism 9.0软件进行图形绘制。使用R软件(version 3.0)的survminer包(surv_cutpoint算法)计算得出年龄相对于生存的最佳临界值[15]。通过Student t检验比较连续变量之间的差异,并通过Pearson χ2检验进行两组间率的比较。Kaplan-Meier方法被用于估计OS、DFS、LRFS和DMFS,显著性检验采用log-rank法。采用多因素COX回归分析方法探讨影响OS和DFS(似然比)的变量。使用survival包和rms包绘制列线图。P<0.05为差异有统计学意义。
2 结 果
2.1 患者基线特征
回顾性纳入了2008—2019年在复旦大学附属肿瘤医院接受过手术治疗的3 314例术后病理检查结果为Ⅱ期、无既往肿瘤史、术后5年内无第二原发肿瘤且术前未接受过新辅助治疗的CRC患者,患者选择流程图见图1。其中2 081例(62.8%)男性,1 233例(37.2%)女性。中位年龄为61岁(20~94岁)。随访时间为0~4 549 d,中位随访时间为1 921 d。随访期间,430例患者死亡,占整个队列的13.0%。使用surv_cutpoint算法计算年龄相对于OS的最佳临界值,结果显示,73岁是区分生存的最佳临界值(图2A)。根据年龄是否超过73岁对全部患者进行分组,分为高龄组(年龄>73岁,n=494)和非高龄组(年龄≤73岁,n=2 820)(图2B)。
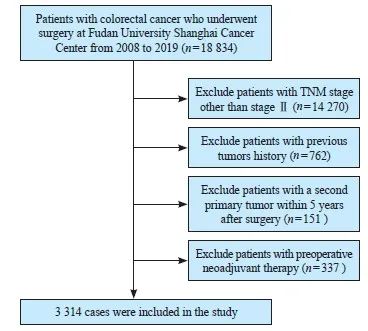
图1 患者选择流程图
Fig. 1 The flowchart of patient selection
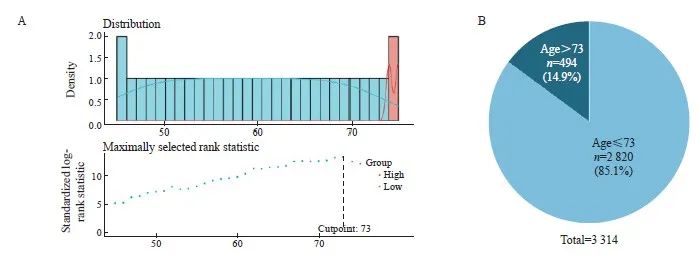
图2 年龄分组的最佳临界值
Fig. 2 The optimal threshold for age grouping
A: The optimal cutoff value calculated by R is 73 years old; B: The proportion of patients in different age groups.
2.2 临床病理学特征
本研究比较了不同年龄分组患者的临床病理学特征。非高龄组相较于高龄组,除年龄差异有统计学意义(57.36±9.995 vs 78.22±3.570,P<0.001,表1)外,其他方面较为一致。两组患者在性别、肿瘤位置、分化、淋巴管血管侵犯、神经侵犯和pT分期方面均衡可比 (P>0.05,表1)。
2.3 生存分析
使用Kaplan-Meier方法比较了不同年龄分组患者的预后。结果显示,高龄组相较于非高龄组,OS显著较差[风险比(hazard ratio,HR)=5.334(4.115~6.915),P<0.001,图3A],与此同时,非高龄组在DFS方面也体现出明显优势[HR=2.564(2.066~3.181),P<0.001,图3B]。进一步分析了两组患者的局部复发和远位转移情况,非高龄组有更长的LRFS[HR=4.837(3.757~6.228),图3C]和DMFS[HR=2.676(2.510~3.332),图3D],差异均有统计学意义(P<0.001)。
纳入单因素生存分析差异有统计学意义的年龄分组、性别、肿瘤分化、淋巴管血管侵犯和神经侵犯等变量,进行多因素COX回归分析。结果显示,年龄是否超过73岁是OS [HR=3.677(2.946~4.565),P<0.001]和DFS[HR=2.368(1.953 ~ 2.872),P<0.001]的独立预后危险因素(表2)。
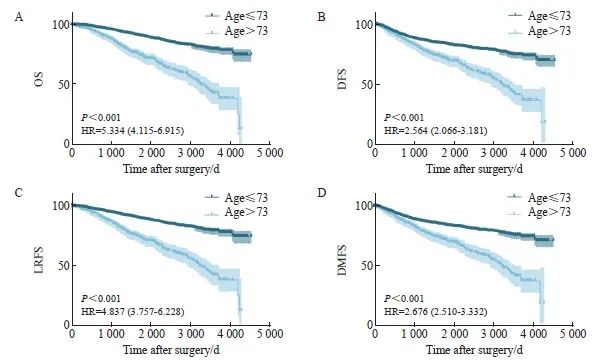
图3 高龄组和非高龄组患者的生存分析
Fig. 3 Survival analysis of the elderly group and the younger group patients
A: The OS of the two groups of patients; B: The DFS of the two groups of patients; C: The LRFS of the two groups of patients; D: The DMFS of the two groups of patients.
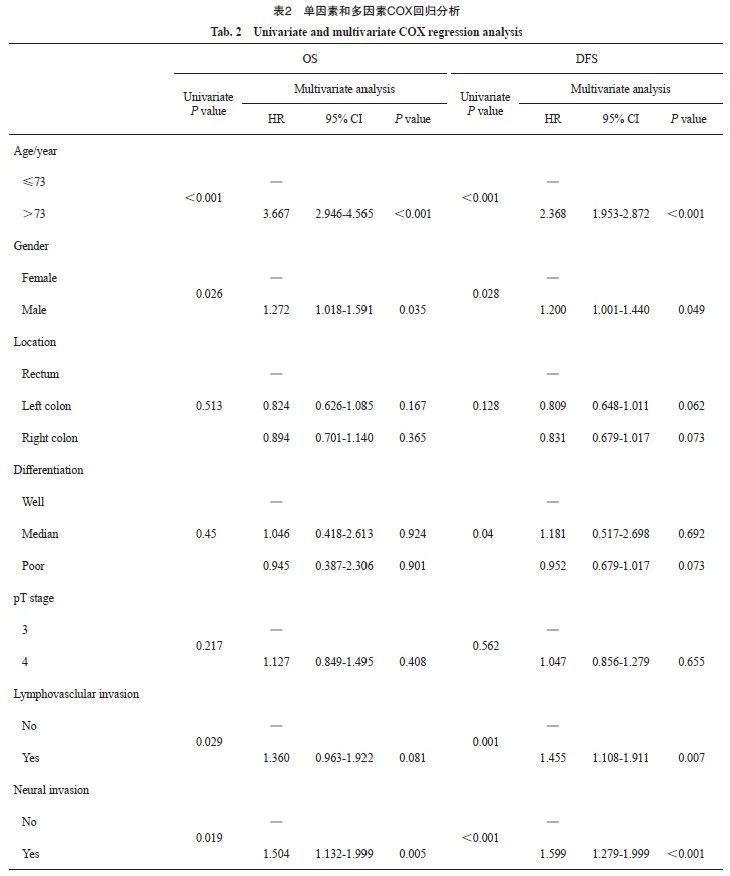
2.4 预测模型列线图
纳入肿瘤分化(1=低分化;2=中分化;3=高分化)、pT分期、肿瘤位置(1=直肠;2=左半结肠;3=右半结肠)、性别(1=男性;0=女性)、淋巴管血管侵犯(1=阳性;0=阴性)、神经侵犯(1=阳性;0=阴性)和年龄分组(1=大于73岁;0=不大于73岁)构建多因素COX回归列线图预测模型(图4)。该列线图有助于医师快速评估患者的3和5年内肿瘤复发及死亡的危险度分级,使临床决策更个体化成为可能。
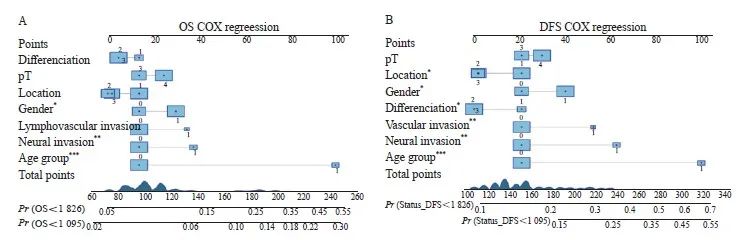
图4 Ⅱ期CRC患者多因素COX回归列线图
Fig. 4 Multivariate COX regression nomogram for patients with stage Ⅱ colorectal cancer
A: A prediction model for OS at 3 and 5 years; B: A prediction model for DFS at 3 and 5 years. *: P< 0.05; **: P<0.01; ***: P<0.001.
3 讨 论
多项研究[16-17]已证实,Ⅱ期CRC患者的预后差异很大。目前国内外临床指南将pT4期、检出淋巴结不足12个、术前肠梗阻或穿孔、淋巴管血管侵犯、神经侵犯、切缘阳性或情况不明、切缘安全距离不足及低分化肿瘤作为Ⅱ期CRC患者的不良预后因素[18-20]。有高危因素的患者术后被建议接受辅助化疗,以巩固手术疗效,减少肿瘤复发[7]。然而,高龄患者常受限于较弱的体质而只能接受减弱的化疗方案。老年患者的免疫功能下降[21],表现为树突状细胞抗原摄取降低[22]、T细胞扩增和分化受损[23]、效应分子功能下降[24]。较差的营养状况和较弱的宿主对肿瘤的免疫反应与不良的预后密不可分,这也部分解释了高龄患者的不良的临床结局。除此以外,高龄患者更容易受到包括高血压、糖尿病和心脑血管疾病等基础疾病的影响[25],这或许也是导致高龄CRC患者预后不良的原因。西方的许多研究[26-28]指出,化疗可能诱发血管内损伤和心脏毒性。考虑到诸多的化疗不良反应,相比于年轻患者,高龄患者接受辅助化疗的可能性较小[29]。
在为Ⅱ期老年CRC患者制订化疗方案时,如何权衡化疗获益和化疗引起的不良反应一直是临床工作中有争议的话题。2018年,IDEA研究[30]指出了3个月的辅助化疗相比6个月的非劣效性,此后大量老年Ⅱ期患者术后仅接受为期3个月的辅助化疗。本研究纳入的患者多数为2018年以前的患者,即便如此,高龄患者仍然更多地接受相对剂量强度较低的化疗方案[3,31]。有研究[13]显示,治疗不足普遍存在于老年Ⅱ期CRC患者中,并鼓励更积极的干预手段。
如何在不降低化疗强度的同时尽可能降低化疗不良反应的发生率同样是临床工作中具有重大意义的研究方向。国内外多项研究[32-34]指出,围手术期营养支持可以减少胃肠道癌症患者的术后并发症并增强宿主免疫力。而Miyata等[35-36]研究指出,肠内营养可以降低CRC患者化疗相关不良反应的发生率。因此,完善的围手术期营养支持也许可以减少化疗相关不良反应的发生,从而改善老年CRC患者的预后。
本研究发现,在其他临床病理学特征均衡可比的情况下,高龄患者相比低龄患者OS和DFS更差。尽管年龄并非可被人为干预的临床特征,但是本研究仍然从侧面反映了可能广泛存在于高龄CRC患者中的治疗不足现象。因此,更加积极的治疗亟待深入研究。临床工作中,需要综合考虑各方面因素从而作出全面的治疗决策。为此,我们构建了多因素COX回归列线图以期为临床实践提供指导。列线图预测模型不仅有助于医师评估患者复发和死亡的风险从而调整化疗强度,其可视化的特点亦可使患者更好地理解医师的意图,有助于医患之间更好的沟通和共同决策。
本研究存在一定局限性。首先,这是一个单中心的回顾性研究,患者的选择可能存在偏倚。其次,包括免疫组织化学及基因检测在内的相关数据尚不完善,这些信息目前在CRC诊疗中也扮演着重要的角色。第三,一些与预后相关的数据未能被收集到,如术前的癌胚抗原水平及糖类抗原19-9(carbohydrate antigen 19-9,CA19-9)水平。最后,高龄患者常伴随更高的基础疾病发病率,而受限于客观条件,包括心脑血管疾病和糖尿病在内的病史未能被详细调查。
尽管存在上述局限,但本研究仍是一项关于高龄患者的大样本的Ⅱ期CRC研究,在控制潜在的混杂因素后能够评估高龄在Ⅱ期CRC患者预后预测中的意义。本研究发现,以是否超过73岁为临界值,可以有效地对患者的预后进行分层。而本研究的列线图模型可以评估患者的危险度分层并为临床实践提供指导。
综上所述,高龄与CRC根治术后Ⅱ期CRC患者较短的OS和DFS相关,提示可能存在于高龄患者中的治疗不足。需要更大范围的年龄纳入标准的临床试验以明确老年Ⅱ期CRC患者复发的危险因素。本研究结果将填补国内相关领域的空白,为临床医师精准判断患者病情并制订适宜的治疗方案提供参考,并为将来制订老年Ⅱ期CRC患者循证医学诊治指南奠定基础。
利益冲突声明:所有作者均声明不存在利益冲突。
作者贡献声明:
张若昕:数据收集和统计分析,文章撰写;
叶紫岚:程序编码及绘图,文章修改;
翁俊勇:数据收集,数据分析指导;
李心翔:课题设计,经费支持及文章修改指导。
[参考文献]
[1] MILLER K D, NOGUEIRA L, DEVASIA T, et al. Cancer treatment and survivorship statistics, 2022[J]. CA Cancer J Clin, 2022, 72(5): 409-436.
[2] SUNG H, FERLAY J, SIEGEL R L, et al. Global cancer statistics 2020: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries[J]. CA Cancer J Clin, 2021, 71(3): 209-249.
[3] KIM J H. Chemotherapy for colorectal cancer in the elderly[J]. World J Gastroenterol, 2015, 21(17): 5158-5166.
[4] ZHANG H, HU H Q, HUANG R, et al. Natural orifice specimen extraction surgery versus conventional laparoscopic-assisted rep for colorectal cancer in elderly patients: a propensityscore matching study[J]. Updates Surg, 2022, 74(2): 599-607.
[5] BETESH A L, SCHNOLL-SUSSMAN F H. Colorectal cancer screening in the elderly[J]. Clin Geriatr Med, 2021, 37(1): 173-183.
[6] KANNARKATT J, JOSEPH J, KURNIALI P C, et al. Adjuvant chemotherapy for stage Ⅱ colon cancer: a clinical dilemma[J]. J Oncol Pract, 2017, 13(4): 233-241.
[7] SCHRAG D, RIFAS-SHIMAN S, SALTZ L, et al. Adjuvant chemotherapy use for medicare beneficiaries with stage Ⅱ colon cancer[J]. J Clin Oncol, 2002, 20(19): 3999-4005.
[8] FONTANA E, MEYERS J, SOBRERO A, et al. Early-onset colorectal adenocarcinoma in the IDEA database: treatment adherence, toxicities, and outcomes with 3 and 6 months of adjuvant fluoropyrimidine and oxaliplatin[J]. J Clin Oncol, 2021, 39(36): 4009-4019.
[9] ANDRÉ T, MEYERHARDT J, IVESON T, et al. Effect of duration of adjuvant chemotherapy for patients with stage Ⅲ colon cancer (IDEA collaboration): final results from a prospective, pooled analysis of six randomised, phase 3 trials[J]. Lancet Oncol, 2020, 21(12): 1620-1629.
[10] PETRELLI F, LABIANCA R, ZANIBONI A, et al. Assessment of duration and effects of 3 vs 6 months of adjuvant chemotherapy in high-risk stage Ⅱ colorectal cancer: a subgroup analysis of the TOSCA randomized clinical trial[J]. JAMA Oncol, 2020, 6(4): 547-551.
[11] IVESON T J, KERR R S, SAUNDERS M P, et al. 3 versus 6 months of adjuvant oxaliplatin-fluoropyrimidine combination therapy for colorectal cancer (SCOT): an international, randomised, phase 3, non-inferiority trial[J]. Lancet Oncol, 2018, 19(4): 562-578.
[12] MIMA K, KURASHIGE J, MIYANARI N, et al. Advanced age is a risk factor for recurrence after rep in stage Ⅱ colorectal cancer[J]. In Vivo, 2020, 34(1): 339-346.
[13] NAGTEGAAL I D. Never too old to fight cancer? What do we know about colorectal cancer in the elderly? [J]. Colorectal Dis, 2017, 19(3): 223.
[14] NITSCHE U, SPÄTH C, MÜLLER T C, et al. Colorectal cancer surgery remains effective with rising patient age[J]. Int J Colorectal Dis, 2014, 29(8): 971-979.
[15] HE J N, BIAN X H, SONG C X, et al. High neutrophil to lymphocyte ratio with type 2 diabetes mellitus predicts poor prognosis in patients undergoing percutaneous coronary intervention: a large-scale cohort study[J]. Cardiovasc Diabetol, 2022, 21(1): 156.
[16]SHI Q, ANDRE T, GROTHEY A, et al. Comparison of outcomes after fluorouracil-based adjuvant therapy for stages Ⅱ and Ⅲ colon cancer between 1978 to 1995 and 1996 to 2007: evidence of stage migration from the ACCENT database[J]. J Clin Oncol, 2013, 31(29): 3656-3663.
[17]HOSHINO N, HASEGAWA S, HIDA K, et al. Nomogram for predicting recurrence in stage Ⅱ colorectal cancer[J]. Acta Oncol, 2016, 55(12): 1414-1417.
[18]BENSON A B 3rd, SCHRAG D, SOMERFIELD M R, et al. American Society of Clinical Oncology recommendations on adjuvant chemotherapy for stage Ⅱ colon cancer[J]. J Clin Oncol, 2004, 22(16): 3408-3419.
[19]BENSON A B, VENOOK A P, AL-HAWARY M M, et al. NCCN guidelines insights: colon cancer, version 2.2018[J]. J Natl Compr Canc Netw, 2018, 16(4): 359-369.
[20]BENSON A B 3rd, VENOOK A P, CEDERQUIST L, et al. Colon cancer, version 1.2017, NCCN clinical practice guidelines in oncology[J]. J Natl Compr Canc Netw, 2017, 15(3): 370-398.
[21]CASTLE S C. Clinical relevance of age-related immune dysfunction[J]. Clin Infect Dis, 2000, 31(2): 578-585.
[22]UHRLAUB J L, SMITHEY M J, NIKOLICH-ŽUGICH J. Cutting edge: the aging immune system reveals the biological impact of direct antigen presentation on CD8 T cell responses[J]. J Immunol, 2017, 199(2): 403-407.
[23]LI G, SMITHEY M J, RUDD B D, et al. Age-associated alterations in CD8α+ dendritic cells impair CD8 T-cell expansion in response to an intracellular bacterium[J]. Aging Cell, 2012, 11(6): 968-977.
[24]CASTLE S, UYEMURA K, WONG W, et al. Evidence of enhanced type 2 immune response and impaired upregulation of a type 1 response in frail elderly nursing home residents[J]. Mech Ageing Dev, 1997, 94(1/2/3): 7-16.
[25]WANG C, YUAN Y, ZHENG M Y, et al. Association of age of onset of hypertension with cardiovascular diseases and mortality[J]. J Am Coll Cardiol, 2020, 75(23): 2921-2930.
[26]SORRENTINO M F, KIM J, FODERARO A E, et al. 5-fluorouracil induced cardiotoxicity: review of the literature[J]. Cardiol J, 2012, 19(5): 453-458.
[27]JENSEN S A, SØRENSEN J B. 5-fluorouracil-based therapy induces endovascular injury having potential significance to development of clinically overt cardiotoxicity[J]. Cancer Chemother Pharmacol, 2012, 69(1): 57-64.
[28]VAN CUTSEM E, HOFF P M, BLUM J L, et al. Incidence of cardiotoxicity with the oral fluoropyrimidine capecitabine is typical of that reported with 5-fluorouracil[J]. Ann Oncol, 2002, 13(3): 484-485.
[29]Surgery for colorectal cancer in elderly patients: a systematic review. Colorectal Cancer Collaborative Group[J]. Lancet, 2000, 356(9234): 968-974.
[30]FORMICA V, ZANIBONI A, LOUPAKIS F, et al. Noninferiority of three months versus six months of oxaliplatin-based adjuvant chemotherapy for resected colon cancer. how should IDEA findings affect clinical practice? [J]. Int J Cancer, 2018, 143(10): 2342-2350.
[31]FELIU J, SERENO M, CASTRO J D, et al. Chemotherapy for colorectal cancer in the elderly: whom to treat and what to use[J]. Cancer Treat Rev, 2009, 35(3): 246-254.
[32]BRAGA M, GIANOTTI L, VIGNALI A, et al. Preoperative oral arginine and n-3 fatty acid supplementation improves the immunometabolic host response and outcome after colorectal rep for cancer[J]. Surgery, 2002, 132(5): 805-814.
[33]GIANOTTI L, BRAGA M, NESPOLI L, et al. A randomized controlled trial of preoperative oral supplementation with a specialized diet in patients with gastrointestinal cancer[J]. Gastroenterology, 2002, 122(7): 1763-1770.
[34]CHEN Y, LIU B L, SHANG B, et al. Nutrition support in surgical patients with colorectal cancer[J]. World J Gastroenterol, 2011, 17(13): 1779-1786.
[35]MIYATA H, YANO M, YASUDA T, et al. Randomized study of clinical effect of enteral nutrition support during neoadjuvant chemotherapy on chemotherapy-related toxicity in patients with esophageal cancer[J]. Clin Nutr, 2012, 31(3): 330-336.
[36]MIYATA H, YANO M, YASUDA T, et al. Randomized study of the clinical effects of ω-3 fatty acid-containing enteral nutrition support during neoadjuvant chemotherapy on chemotherapy-related toxicity in patients with esophageal cancer[J]. Nutrition, 2017, 33: 204-210.
作者:中国癌症杂志
版权声明:
本网站所有注明“来源:梅斯医学”或“来源:MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明“来源:梅斯医学”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言










#结直肠癌# #预测模型# #化疗方案#
7