NAT COMMUN:诺奖CRISPR技术体内靶向癌细胞
2020-10-10 haibei MedSci原创
尽管我们已经在治疗方面取得了进展,但癌症仍然每年在全球范围内造成900多万人的死亡。事实上,关于癌细胞的生物学行为和分子疾病机制,我们还有很多东西需要了解。
尽管我们已经在治疗方面取得了进展,但癌症仍然每年在全球范围内造成900多万人的死亡。事实上,关于癌细胞的生物学行为和分子疾病机制,我们还有很多东西需要了解。从这个意义上说,基因组编辑提供了前所未有的机会,其可以进一步提高我们对癌症生物学的认识,并促进新的临床前模型,以及更有效和定向的治疗策略的发展,以消除癌细胞。
不同于其他遗传性疾病,癌症的发展涉及多个基因突变,很明显,靶向单一基因往往不足以消除癌细胞。然而,许多类型的癌症都依赖于单一致癌事件的存在,其可以通过解除下游分子和(外延)遗传程序重新编程细胞,并启动肿瘤的发生。这就是所谓的融合致癌基因(Fusion oncogenes,FOs)的情况,其是染色体重排导致的两个基因的编码序列的框内融合产生的嵌合基因。
FOs在许多癌症类型中很常见,是肿瘤发展的强大驱动力。由于它们的表达对癌细胞具有排他性,并且在FO驱动的癌症中,它们的消除会诱导细胞凋亡,因此FOs是有吸引力的治疗靶点。

CRISPR/Cas9为基础的技术已经彻底改变了哺乳动物细胞的基因组编辑,并可以在基因组的任何所需位置产生有针对性的断裂,为治疗性基因编辑开辟了新的视野。最近的一项开创性研究利用HDR修复途径,在前列腺和肝癌细胞系的患者特异性FO位点插入自杀基因。虽然该方法非常有吸引力,但是其具有一个极低的编辑效率(1-10%),限制了这一策略的实用性。
最近,基于CRISPR/Cas9技术,研究人员设计了一种简单、高效和非患者特异性的基因编辑策略,通过靶向参与重排的基因的两个内含子,允许在癌细胞中特异性地强力破坏FO。
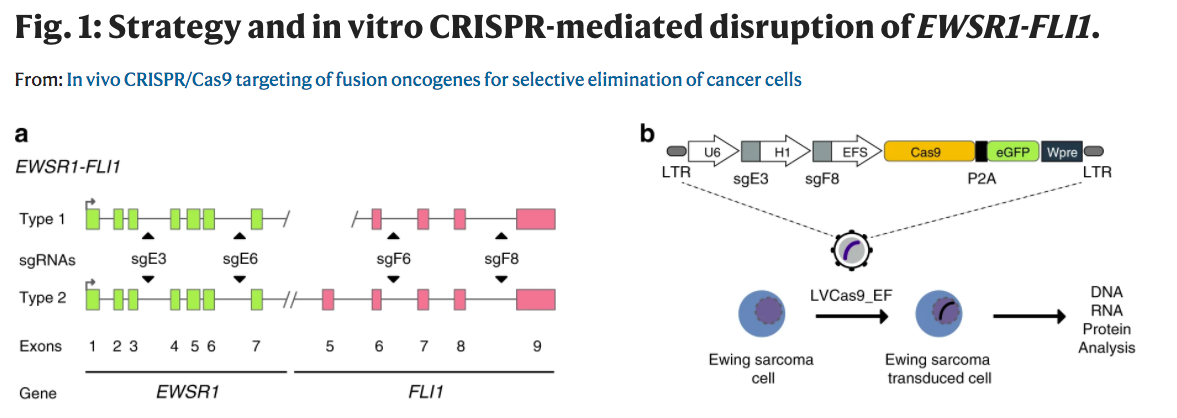
作为其潜力的概念证明,研究人员进一步证明,基于内含子的转录因子或酪氨酸激酶FO的靶向在体内模型中可以降低肿瘤负担/死亡率。
这里提出的FO靶向方法可能为选择性消除癌细胞开辟了新的视野。
原始出处:
M. Martinez-Lage et al. In vivo CRISPR/Cas9 targeting of fusion oncogenes for selective elimination of cancer cells. Nature Communications (2020).
作者:haibei
版权声明:
本网站所有注明“来源:梅斯医学”或“来源:MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明“来源:梅斯医学”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言








#COMMUN#
45
#Nat#
36
#癌细胞#
45
#CRISPR#
55
#诺奖#
51