喝酒后,大脑会发生哪些改变呢?
2016-07-24 佚名 新乡医学影像诊断中心
ht: 1em; box-sizing: border-box !important; word-wrap: break-word !important;"> 慢性酒精中毒性痴呆:缓慢起病,有严重的人格改变,记忆减退及智能障碍;社会功能及生活自理能力下降或消失。脑电图可有低波幅慢波;脑CT示脑室扩大,大脑皮质特别是颞叶显著萎缩。病例特点:上脑干、下丘脑和脑室周
酒精神经毒性损害了下丘脑和垂体所致。神经放射学和神经内分泌学结合研究表明,戒酒1个月患者,第三脑室宽度和脑室脑比率 (VBR)与基础可的松水平呈负相关。
4、心理因素
调查表明,饮酒者往往为了解除焦虑。但是,长期主动饮酒导致日益严重的抑郁,不能正常睡眠及社会孤独。很多酒中毒患者有情感性精神病家族史。
5、社会文化因素
酒滥用与文化背景的关系非常复杂。不同国家、民族嗜酒比例不同。酒中毒与家庭、社会阶层、职业、婚姻状况等有关系,一般单身、离婚、丧偶者易酒依赖和酒中毒。
酒精如何引起中毒
酒精可直接损害大脑皮质和皮质下区,使脑细胞变性、坏死,造成神经细胞胞体萎缩和血流量下降,引起痴呆。
陈淑霞报道,在慢性酒精中毒死亡者尸检中发现,大脑重量减轻,大脑皮质萎缩,大脑周围空间增大,脑室扩大及脑白质容量减少,镜下发现大脑皮质神经细胞萎缩、缺失,神经细胞轴突和树突减少;另外,在慢性酒精中毒患者的脑白质中水分含量增多,类脂减少,并有神经胶质增生、水肿、脱髓鞘等病理改变。
有调查显示,摄入酒精 60g/d 和大量饮酒者发生出血性卒中的危险性增加,特别是发生蛛网膜下腔出血的危险性为不饮酒者的 2~3 倍,但与缺血性卒中没有必然联系。
来自 Framingham 的研究资料提示脑梗死的发病率随饮酒量增加而增加。有人报道白人群体中有一种“J”字型相关曲线,即适量饮酒可预防卒中,较大量饮酒则增加卒中的危险度。对于那些不饮酒者即使少量饮酒也可能使卒中的危险度增加。
然而,日本人和黑人群体中这种相关曲线并不明显。流行病学研究中最引人注目的报道认为近期酒精中毒引起缺血性卒中和蛛网膜下腔出血的相对危险度高达15,但其可信度值得怀疑。饮酒致缺血性卒中机制可能有下列几条途径:
1、诱发心律不齐或心脏内壁异常运动而引起脑栓塞;
2、诱发高血压;
3、增强血小板聚集作用;
4、激活凝血系统;
5、刺激脑血管平滑肌收缩或使脑代谢发生改变是脑血流量减少。
近年来,人们做了大量的研究发现酒依赖患者的发病机制与内源性阿片系统及群体遗传学、分子遗传学之间的关系的确存在着重要的联系。
酒精与阿片类物质
酒精与阿片类物质有相似作用,如引起欣快、出现耐受性及依赖性,两者中毒时亦有诸多相似表现。研究提示,阿片类物质依赖者的酒量随阿片的服用量增加而下降,而阿片戒断后酒量回升。
饮酒与阿片类受体的相互影响,可能通过三种机制增强阿片类受体的活动:
1、酒精的代谢产物乙醛与儿茶酚胺结合,生成阿片类受体激动剂四氢异喹啉碱(TIQ)。TIQ能直接兴奋阿片受体,故摄入酒精能产生吗啡样效应。
2、酒精兴奋内源阿片类物质的释放,如β-内腓肽或脑啡肽,这样酒精间接兴奋阿片类受体。
3、酒精提高阿片类受体对内源性阿片类物质的敏感性,通过改变阿片类受体与阿片肽的亲和力而影响阿片受体的活性。
研究提示,中、高剂量的阿片类物质会降低动物耗酒量,中断长期服用高剂量的阿片物质后,酒量会反弹到比基础酒量更高的水平;相反,低剂量阿片类物质可短暂地增加饮酒量。
少量的酒精又会轻度兴奋阿片类受体的活动,进一步使饮酒加剧。内源性阿片系统可使脑内奖赏敏感区(伏隔核)的多巴胺释放增加,此区多巴胺活动增强是心理强化的生理基础。因此,酒精可能是通过内源性阿片系统激活伏隔核DA活动,来增加愉悦体验、强化饮酒行为。
嗜酒的遗传素质与内源性阿片系统
嗜酒的遗传倾向无疑是由多基因决定的,多个基因调节着神经系统生物学因素。研究表明,嗜酒的遗传素质可能与个体内源性阿片系统对酒精的敏感性增加有关。
家系调查
嗜酒者有明显的家族聚集性,嗜酒者的后代酒精中毒的发病率高。酒依赖家庭成员中,酒依赖的患病率高于一般人群,其一级亲属患酒依赖的危险性较对照组高 4~7 倍。
近来临床研究人员对 6251 例酒依赖和 4083 例非酒依赖患者的家系进行回顾性总结发现,父或母为酒依赖者的子女,其酒依赖的发生率分别为 27% 和4.9%;30.8% 的酒依赖患者,至少有一位双亲同是酒依赖者。
较早的研究提示单卵双生子(MZ)与双卵双生子(DZ)的同病一致率可相差10倍;另一些研究考虑到饮酒的继发症状与“成瘾”症状在内,发现 MZ 和 DZ 的同病一致率并无明显差异。
来自美国弗吉尼亚州 1033 对女性双生子的研究显示,酒依赖的同病一致率 MZ 为 26%~47%,DZ 为 12%~32%,总计遗传度为 50%~61%,提示遗传因素在女性酒依赖的患病中也起有重要作用。
分子遗传学研究
1、乙醇脱氢酶(ADH)和乙醛脱氢酶(ALDH)基因多态性:
ADH 和 ALDH 是参与体内醇代谢的主要酶,与酒依赖的发生有密切关系,乙醇代谢过程在不同个体和不同种族间都存在遗传差异。发现酒精中毒者 ALDH2 2等位基因频率比非酒精中毒者低 5 倍,酒精中毒组酶活性高的 ADH2 2 和 ADH3 1 等位基因的酶活力也比非酒精中毒组低。
2、单胺氧化酶(MAO)基因:
MAO 是分解体内去甲肾上腺素、5-羟色胺和多巴胺等单胺类物质的重要酶,对体内乙醇代谢产生一定影响。MAO-A 对酒依赖的产生可能有一定作用,但不是酒依赖发病与否的主要影响因素。
3、多巴胺(DA)受体基因:
DA 在探索行为和食欲(包括寻酒行为)的神经调节中起着重要作用。DA 转运体(DAT)能够阻止突触末端的神经传递,其基因的改变可引起一些成瘾行为的发生。
4、5-HT 系统基因:5-HT2A 受体的功能及表达水平的不同是由 5-HT2A 受体基因多态性所决定的,5-HT2A 受体基因有 5 种多态性。
酒精中毒的临床表现
常见于 50~60 岁,男性多见,病程可持续数年,预后不良,部分慢性酒精中毒者,即使无严重的中毒史也可产生痴呆。常出现的症状如下:
1、认知障碍:近事记忆减退,有逆行性遗忘,常有定向力尤其是时间定向力障碍,赘述但言语不清,随着病程延长,逐渐出现明显的智能障碍。
2、精神症状:有幻视、幻听等丰富多彩的幻觉症状,错构症、虚构症、妄想加嫉妒妄想等,可有恐惧、兴奋、悲泣等情绪变化,失去自制力,行为怪异。
3、神经症状:周围神经病,共济失调,手、舌及全身震颤。
4、其他症状:面部毛细血管扩张、皮肤营养障碍、慢性胃炎、肝硬化等
那些由酒精导致的脑病
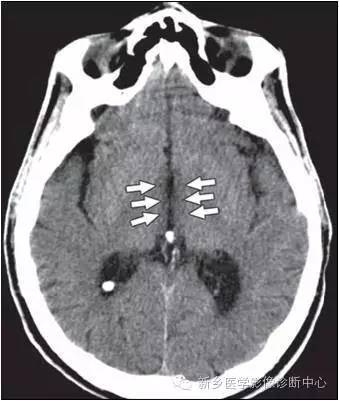
Marchiafave-Bignami 综合征
胼胝体变性,也称为 Marchiafave-Bignami 综合征分急性和慢性。
急性者表现为突发的意识障碍、精神症状、癫痫发作、构音障碍,甚至发展为植物状态。
慢性主要表现为进行性痴呆、情感淡漠、精神运动迟缓、构音障碍、吞咽困难、部分或完全性大脑半球间失联合综合征(一侧半球不能对投射到另一侧半球的视觉或躯体感觉刺激做出反应)。主要为胼胝体脱髓鞘和坏死,可以累及其他部位的脑白质。
病理特点:胼胝体对称性脱髓鞘、坏死和萎缩;也常累及附近白质和脑桥中央。
影像学特征:
CT表现:胼胝体压部、体部或膝部大片对称性低密度影,增强扫描无强化。
磁共振表现:胼胝体压部、体部或膝部大片对称性的弥漫性肿胀;T1WI呈等或稍低信号;T2WI呈高信号,代表水肿和脱髓鞘;增强扫描无强化。慢性期病变:T1WI呈低信号;T2WI呈高信号;部分病例可出现胼胝体囊变和萎缩。
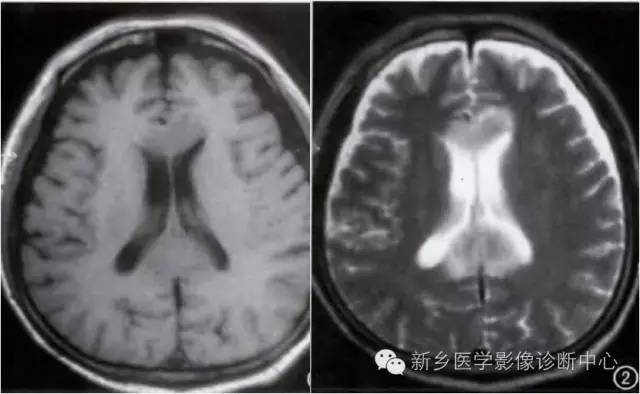
Wernicke 脑病
Wernicke脑病,也称 Wernicke-Korsakoff 综合征,由酒精中毒性痴呆及 Korsakoff 遗忘状态组合而成。临表多为急性起病,典型的三联症为眼肌麻痹、共济失调和精神障碍,并非所有病例都出现,影像学为确诊的主要依据之一。
柯萨可夫精神病:
缓慢起病,以记忆障碍为主,伴虚构或错构、定向力障碍,可有情感和动作迟钝。可发生程度不同的多发性神经炎,检查见肢体感觉障碍、肌萎缩、腱反射减弱或消失,严重时可瘫痪。
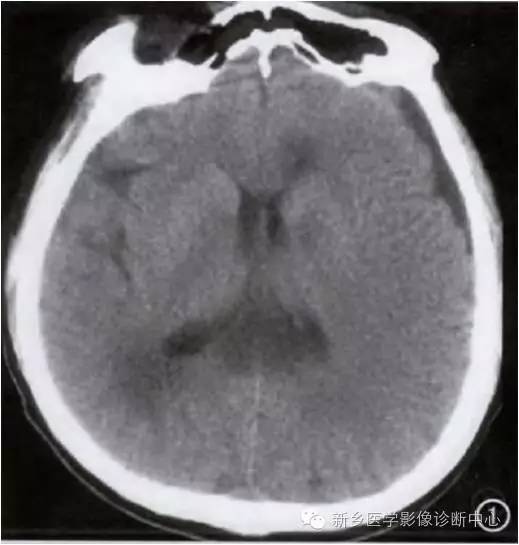
, ht: 1em; box-sizing: border-box !important; word-wrap: break-word !important;">慢性酒精中毒性痴呆:
缓慢起病,有严重的人格改变,记忆减退及智能障碍;社会功能及生活自理能力下降或消失。脑电图可有低波幅慢波;脑CT示脑室扩大,大脑皮质特别是颞叶显著萎缩。
病例特点:
上脑干、下丘脑和脑室周围(第三脑室和导水管)小灶性充血和出血;急性期主要以受累病变部位细胞性水肿为主;亚急性期主要以血管源性水肿为主;慢性期:神经元变性、坏死、缺失;神经纤维的松弛髓鞘结构变性、坏死;星形胶质细胞、少突胶质细胞和毛细血管增生;细胞内水肿和斑点状出血等。
影像学特征:
第三、四脑室旁及导水管周围乳头体、四叠体、丘脑等部位异常密度及信号影。
CT表现:中脑水管区的低密度改变。
磁共振表现:T1WI呈低信号;T2WI呈对称性高信号;液体饱和反转恢复序列(FLAIR)呈明显高信号。急性期可有增强,有些少见部位如小脑齿状核、桥脑被盖、红核、中脑顶盖、尾状核及大脑皮质也可发生类似的影像改变。
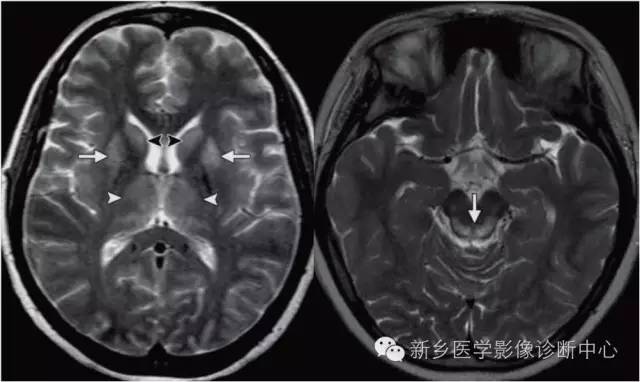
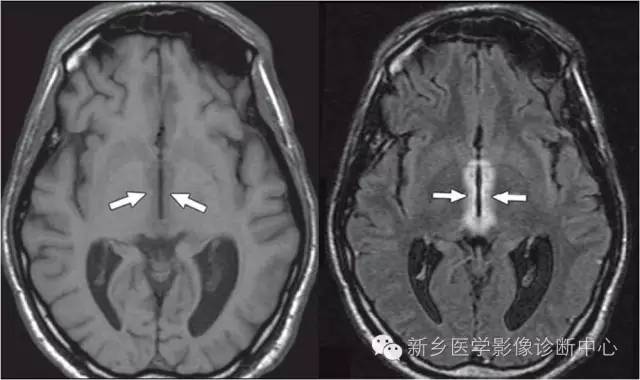
其他后果
广泛皮层性脑萎缩
影像学特征:与年龄不符的广泛的皮层萎缩,皮质变薄,脑沟、脑回增宽,部分伴有白质脱髓鞘,或与其他类型脑损害并存。
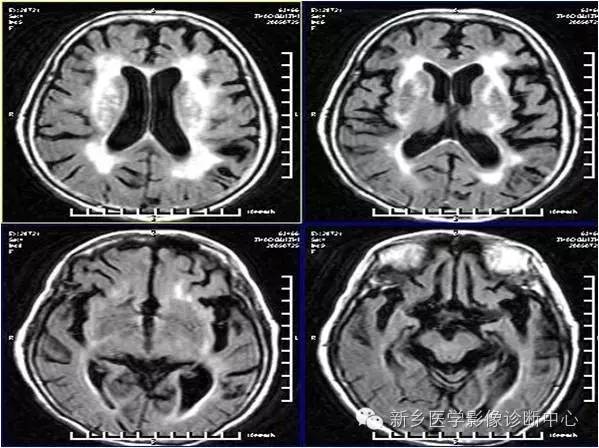
小脑变性
半数以上的患者可以合并大脑萎缩。主要的临床表现为躯干及下肢的共济失调、眼球震颤、言语缓慢、行走不稳,部分患者合并周围神经损害,临床需要与遗传性共济失调鉴别。长期饮酒、伴有其他营养性疾病、影像学提示小脑萎缩、否认家族史为其诊断要点。
影像学特征:小脑萎缩:以小脑蚓部萎缩为主;小脑皮层萎缩,小脑蚓部和橄榄体萎缩;脑池扩大:环池、小脑上池、枕大池等。
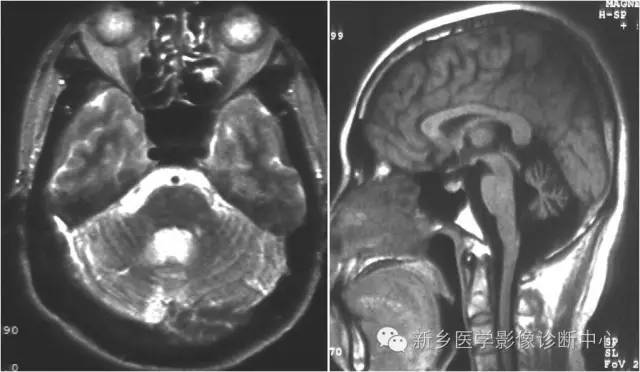
脑白质脱髓鞘
临表为精神障碍、行走困难、肌张力高、病理征阳性等。
磁共振表现:皮层下白质及侧脑室周围:多发的点状或斑片状长T1长T2信号影;可以与其他类型影像学损害并存;胼胝体囊变、空洞、胼胝体分裂:提示胼胝体分层坏死是其典型的表现。
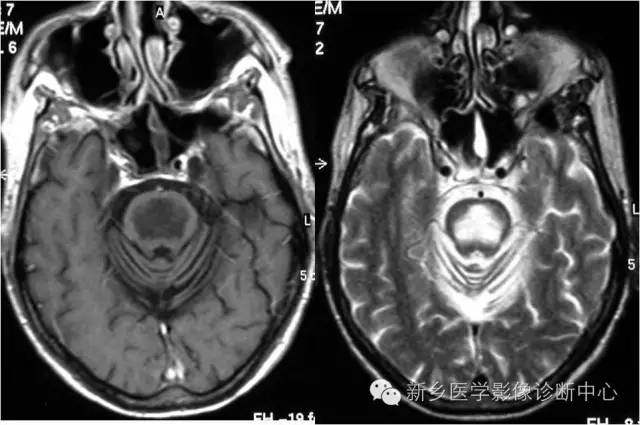
桥脑中央髓鞘溶解症
病理特点:桥脑基底部中央处对称性脱髓鞘;从中缝处开始,向两侧发展;髓鞘脱失严重,但神经细胞与轴突仍相对完整;无炎性反应。病灶可扩散至桥脑被盖,并向上波及中脑;不累及软脑膜下及脑室周围区。
影像学特点:
CT表现:桥脑基底部低密度区,无占位效应; 一般不侵犯中脑和向后侵犯中央纤维束;病灶常累及前额叶;增强扫描病灶无强化。
磁共振表现:急性期桥脑上部中央出现三角形、或对称性圆形卵圆形T1加权像低信号,T2加权像高信号的病灶;增强扫描有显著异常强化;不累及脑室周围白质区;大脑皮层下白质、半卵圆中心、胼胝体、丘脑、纹状 体、中脑和小脑可见散在异常信号病灶。
酒精与人的关系
酒精是一种亲神经的麻醉剂,一次大量饮酒可出现急性神经精神症状。长期饮用可产生酒精依赖,慢性酒精中毒所致各系统损害,特别是中枢神经系统,可产生痴呆,常因合并感染而死亡率高。病因研究涉及遗传学、生物化学、酶学、神经内分泌学及心理、社会文化等因素。
1、遗传因素
遗传因素在酒中毒中起一定作用,酒中毒发生率在一级亲属中比一般人群高 7 倍。酒精对大脑损害的敏感性也受遗传因素的影响。
CT和神经心理测验研究表明,有些酒中毒病人有明显的大脑萎缩和脑功能异常;而另有一些酒中毒者,尽管饮酒时间和量相近,却无明显的大脑萎缩和脑功能异常。临床表现异常也不显著。
酒精对大脑不同部位损害的敏感性也取决于遗传因素,有学者认为酒精神经毒性和硫胺缺乏对脑不同部位损害有程度上差异,它与遗传易感性有关。
一般来说,酒精神经毒性既损害了大脑皮层又损害基底节;而硫胺缺乏却对基底节、间脑、脑干上端和乳头体等部位损害较重,而且乳头体明显萎缩还是硫胺缺乏的特殊标志。
对酒精神经毒性具有高度易感性的人倾向出现大脑萎缩和认知功能障碍;而对硫胺缺乏具有高度易感性的个体,则易于发展成短暂的 Wernicke-Korsakoff 综合征。
还有少数个体对酒精神经毒性和硫胺缺乏具有双重易感性,酒精对这一人群的危害性就更大。酒精神经毒性和硫胺缺乏结合作用使基底节损伤更重。同时硫胺缺乏也会损害大脑皮层,导致大脑结构异常。补充硫胺治疗,亦无明显效果,因而他们容易发展成慢性顽固性 Korsakoff 综合征。
2、生物化学与代谢研究
饮酒后,几乎全部乙醇均在肝内代谢。乙醇脱氢酶将乙醇转变为乙醛,乙醛脱氢酶又使之转变为乙酸,最终氧化为水和二氧化碳。饮酒后酒精很快通过血脑屏障。血中酒精浓度达 5~50mmol/L 时,称为酒精中毒浓度。血中酒精浓度达 110mmol/L 时能致命。
酒精激活某些外援酶,产生毒性物质并蓄积。其产生的乙醛能与各种蛋白质结合成乙醛-蛋白质,乙醛和乙醛-蛋白质都有毒性,均导致大脑细胞死亡。
研究表明,酒精改变神经元突触膜的流动性,改变钠通道,抑制钠内流,影响钙摄取,降低脑中钙含量和突触对钙的摄取,抑制神经突触的功能,导致脑皮层功能障碍。
饮酒致硫胺(VitB1)缺乏,硫胺缺乏主要损害基底节,导致乳头体明显萎缩。硫胺缺乏使转铜酶、丙酮酸脱氢酶等酶活性下降,使类脂和蛋白质合成减少,发生三羧酸循环障碍,导致脑细胞酸中毒。
酒精中毒患者基底节损伤,可致乙酰胆碱含量明显减少,进一步发展为痴呆。酒精抑制海马中 N-甲基-D-天门冬氨酸受体,导致“记忆缺失”,即醒来后有几小时遗忘。
3、神经内分泌学研究
酒中毒性脑萎缩可能与 HPA 轴功能减退有关。可能是由于
作者:佚名
版权声明:
本网站所有注明“来源:梅斯医学”或“来源:MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明“来源:梅斯医学”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言









好文值得点赞!继续关注学习。
82
#喝酒#
42
还是少喝酒!
66