全球**每日1次口服PI3K/CK1抑制剂获FDA批准上市,治疗淋巴瘤
2021-02-08 拾贝 医药魔方
TG公司宣布美国FDA已批准umbralisib(商品名UKONIQ)上市,用于治疗之前至少接受过一种基于抗CD20治疗方案的复发或难治性边缘区淋巴瘤(MZL)成人患者和之前至少接受过三线全身治疗的复
TG公司宣布美国FDA已批准umbralisib(商品名UKONIQ)上市,用于治疗之前至少接受过一种基于抗CD20治疗方案的复发或难治性边缘区淋巴瘤(MZL)成人患者和之前至少接受过三线全身治疗的复发或难治性滤泡性淋巴瘤(FL)成人患者。 Umbralisib是首个也是唯一一个获批上市的每日口服1次的磷酸肌醇3激酶(PI3K ) δ和酪蛋白激酶1 (CK1) ε抑制剂。PI3K-δ在支持细胞增殖和生存、细胞分化、细胞间运输和免疫方面发挥重要作用,在正常和恶性b细胞中都有表达。CK1-ε是一种癌蛋白翻译调节因子,与癌细胞包括淋巴恶性肿瘤发病机制有关。此前,umbralisib治疗 MZL适应症曾获FDA突破性疗法认定,上市申请也被纳入优先审评。umbralisib也被授予治疗MZL和FL的孤儿药认定 (ODD)。
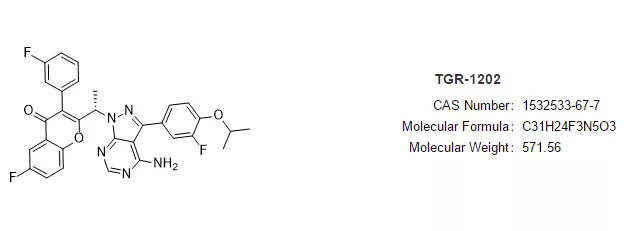
MZL和FL适应症的加速获批是基于一项II期UNITY-NHL (NCT02793583)研究的总缓解率(ORR)数据。UNITY-NHL研究是一项开放标签,多中心,双队列研究,2个队列分别招募了69例 MZL患者和117 例FL患者,受试者接受每日口服1次umbralisib(800mg)治疗,直至疾病进展或不可耐受毒性。研究结果表明,MZL患者的总缓解率(ORR)为49% ,完全缓解率(CR)为16%,中位缓解持续时间(DOR)尚未达到。FL患者ORR为43%,CR为3.4%,DOR为11.1个月。
针对3项单臂,开放标签试验和1项开放标签扩展试验的221例MZL和FL成年患者安全性数据分析结果显示,接受umbralisib治疗的患者中有18%发生了严重不良反应,发生率>2%的严重不良反应包括:腹泻-结肠炎(4%)、肺炎(3%)、脓毒症(2%)和尿路感染(2%)。 边缘区淋巴瘤(MZL)是一组惰性(生长缓慢)成熟的B细胞非霍奇金淋巴瘤(NLS),是第2种最常见的B细胞NHL,约占所有NHL病例的10%。MZL包括脾边缘区淋巴瘤(SMZL)、黏膜相关淋巴组织(MALT型)淋巴瘤和淋巴结边缘区淋巴瘤(NMZL)3种亚型。MZL一般被认为是一种慢性不治之症,美国每年约有8200名新确诊患者。 滤泡性淋巴瘤(FL)是一种典型的惰性非霍奇金淋巴瘤(NHL),起源于B淋巴细胞。是第2种最常见的NHL形式,约占所有NHL病例的17%,在美国每年约有13200名新确诊患者。FL通常是不可治愈的,因为这种形式淋巴瘤患者可存活多年,因此被认为是一种慢性病。 德克萨斯大学安德森癌症中心医学教授Nathan Fowler博士表示,尽管MZL和FL的治疗取得了一定进展,但仍是不可治愈性疾病。既往接受治疗后疾病复发患者的选择十分有限,没有明确的治疗标准。umbralisib的获批使我们有了一种靶向、口服、每日1次的选择,这种选择是患者所需要的。
作者:拾贝
版权声明:
本网站所有注明“来源:梅斯医学”或“来源:MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明“来源:梅斯医学”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言








#抑制剂#
70
#FDA批准#
62
#PI3K#
66
真的是值得高兴的消息,振奋人心
118