Cancer Res:阴险!复旦科学家发现肿瘤能将杀伤性T细胞囚禁在淋巴结中,让调节T细胞成为“猪队友”
2018-10-29 奇点糕 奇点网
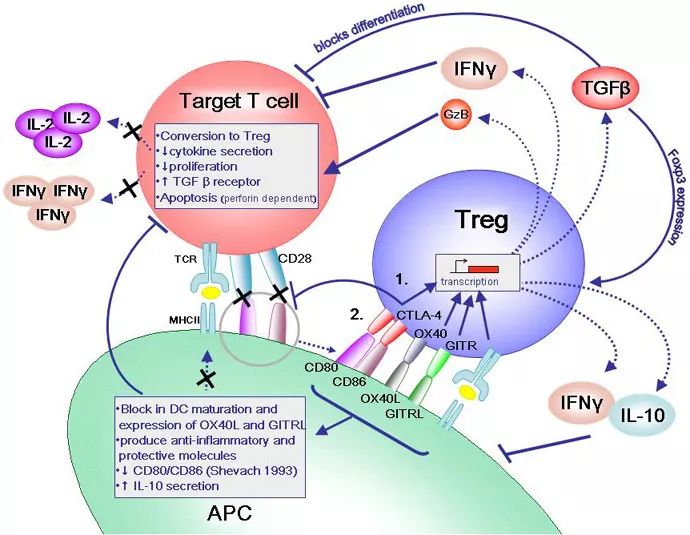
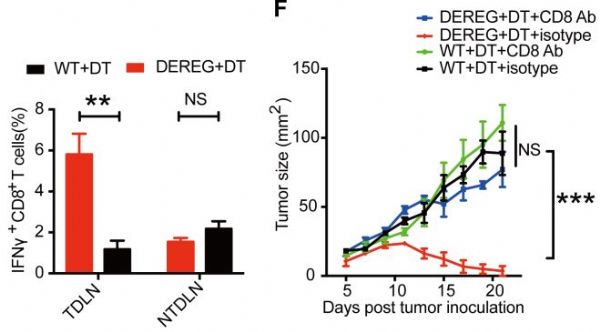
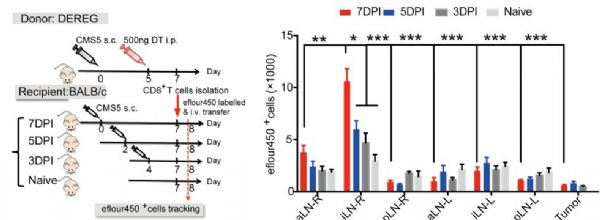
最近,复旦大学王宾教授领导的团队又发现,肿瘤将T细胞囚禁在了淋巴结中,使他们不能出去抗癌。不过,与上次不同的是,这次研究者们终于弄清了肿瘤的阴谋是如何得逞的,并且,他们还找到了解救T细胞的办法!


作者:奇点糕
版权声明:
本网站所有注明“来源:梅斯医学”或“来源:MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明“来源:梅斯医学”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言







我家属免疫治疗后,腹膜后淋巴结肿大,但其他部位控制较好,也许是这个原因吧!很期待……
55
#调节T细胞#
39
#科学家发现#
34
#淋巴结#
35
#复旦#
38