长期压力大,癌细胞更易扩散!Cancer cell:慢性压力使癌细胞转移率增加2-4倍,原因是它!
2024-06-17 梅斯学术 MedSci原创
研究揭示了慢性压力促进弥漫性癌症细胞的肺转移的途径,并确定中性粒细胞及其细胞外陷阱(NET)是这一过程中的关键介质。
压力大的时候,人们往往会经历一系列身体和心理上的反应,比如:过大的压力会影响记忆、认知、行为,以及全身稳态(包括心血管、胃肠道和免疫系统),导致人们更加容易生病。此外,生病会使得患者压力倍增,从而加重疾病,如此一直恶性循环下去。
在癌症治疗中,慢性压力与患者预后不良和转移风险增加有关,但其根本机制仍不清楚。近日,约翰霍普金斯大学研究团队在Cancer cell杂志发表研究成果,揭示了慢性压力促进弥漫性癌症细胞的肺转移的途径,并确定中性粒细胞及其细胞外陷阱(NET)是这一过程中的关键介质。

一、研究内容与思路
1、慢性压力促进肿瘤转移
作者给予乳腺癌小鼠慢性约束压力,发现慢性约束压力使肿瘤大小增加一倍,肿瘤转移率增加2至4倍。此外,原发性肿瘤的免疫微环境显示,T细胞、B细胞、自然杀伤细胞和活化巨噬细胞的浸润减少,而中性粒细胞的浸润增加。进一步,作者采用了慢性不可预测的轻度压力(CUMS)模型来模拟癌症患者所经历的不可预测的压力,结果发现,暴露于CUMS的小鼠肺转移率增加了一倍。
当小鼠受到压力的时候,血浆皮质酮水平升高。对此,作者检测了皮质酮是否会促进肿瘤转移。结果发现,原发肿瘤切除后,与安慰剂颗粒相比,植入缓释皮质酮颗粒可增加转移病灶的数量和总转移负荷,但敲除肿瘤细胞糖皮质激素受体(GR)对肿瘤转移无影响。也就是说,慢性压力会促进肿瘤转移,但不依赖于GR。

研究思路1:在日常生活中,研究者发现压力会导致肿瘤患者病情加重;对此,开展了研究探讨压力与肿瘤增大及转移的关系。首先,将慢性约束压力小鼠模型与肿瘤小鼠模型结合起来,探讨肿瘤小鼠受到慢性约束压力的影响,进一步换了另外一种压力模型来佐证,最终表明压力会促进肿瘤转移,且不依赖GR。
2、慢性压力诱发促癌转移的微环境
GR在慢性压力诱导的癌转移中没有发挥作用,是不是因为微环境发生了改变导致的癌转移增加?对此,作者通过RNA-seq分析了慢性压力小鼠的肺部组织后发现,慢性压力显著上调了与细胞外基质(ECM)组织相关的基因的表达,同时下调了参与T细胞活化和适应性免疫反应的基因。
同样,与GO分析一致,慢性压力小鼠或用皮质酮或地塞米松治疗的小鼠肺部的纤连蛋白沉积明显增加,慢性压力小鼠肺部的T细胞浸润减少,中性粒细胞浸润和介导中性粒细胞募集的趋化因子(Cxcl2和Cxcl5)表达升高。
接着,作者将T细胞与中性粒细胞一起培养,发现中性粒细胞能够激活CD8+ T细胞;但在用GR激动剂或地塞米松处理后,中性粒细胞失去激活T细胞的功能。此外,在中性粒细胞缺失的乳腺癌小鼠模型中,慢性压力诱导不能促进肿瘤转移。
以上数据表明,慢性压力会诱发促转移的肺微环境;中性粒细胞在协调压力诱导的转移中起着关键作用。
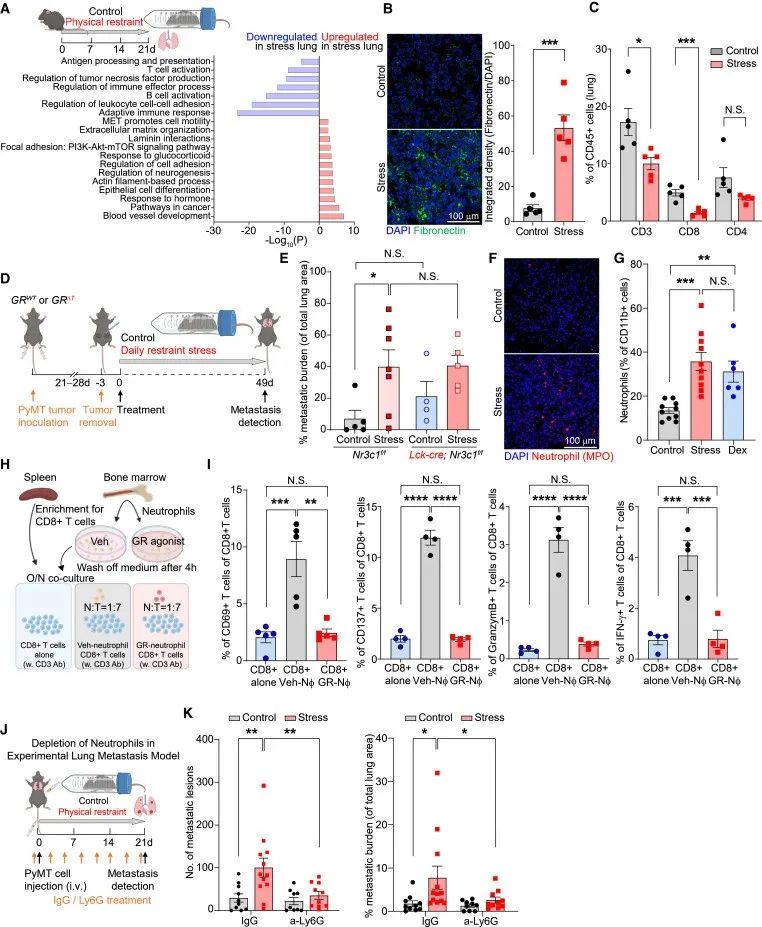
研究思路2:在第一部分研究中发现,肿瘤小鼠在慢性约束压力下,GR及免疫微环境发生了改变;此外,进一步的研究显示,GR对肿瘤转移没有影响,所以作者探讨了免疫微环境在肿瘤小鼠收到慢性约束压力中发挥的作用。这一环节中,作者从基因角度入手,通过测序发现了发生变化的基因,之后结合免疫反应一步一步分析锁定T细胞和中性粒细胞。
3、压力改变中性粒细胞昼夜衰老,并通过GR信号传导诱导NET形成
为了研究压力如何影响中性粒细胞从而促进肿瘤转移,作者分析了从压力小鼠肺部分离的中性粒细胞的基因表达变化。结果显示,压力小鼠许多上调基因与用地塞米松或GR激动剂处理的精神压力小鼠中性粒细胞中部分上调的基因重叠,提示精神压力小鼠中性粒细胞基因表达变化主要由GCs引起。
进一步分析发现,在精神压力小鼠中,中性粒细胞GR的激活,能够上调中性粒细胞中与昼夜节律以及氧化压力反应相关的基因(低Cxcr2和高Cxcr4),引起中性粒细胞出现异常的昼夜变化,表现出异常的衰老表型,并且中性粒细胞ROS生成增加,诱导中性粒细胞细胞外陷阱(NET)形成。
与对照组相比,在中性粒细胞条件敲除GR的小鼠中,精神压力不能引起NET形成的增加,并且皮质酮、地塞米松和GR激动剂也不能诱导小鼠中性粒细胞形成NET。通过分离中性粒细胞并进行体外刺激,作者发现糖皮质激素(GCs)在中性粒细胞中诱导ROS生成,导致细胞周期蛋白D3上调和p38 MAPK磷酸化,同时增加细胞周期蛋白依赖性激酶4/6的活性,最终形成NET。
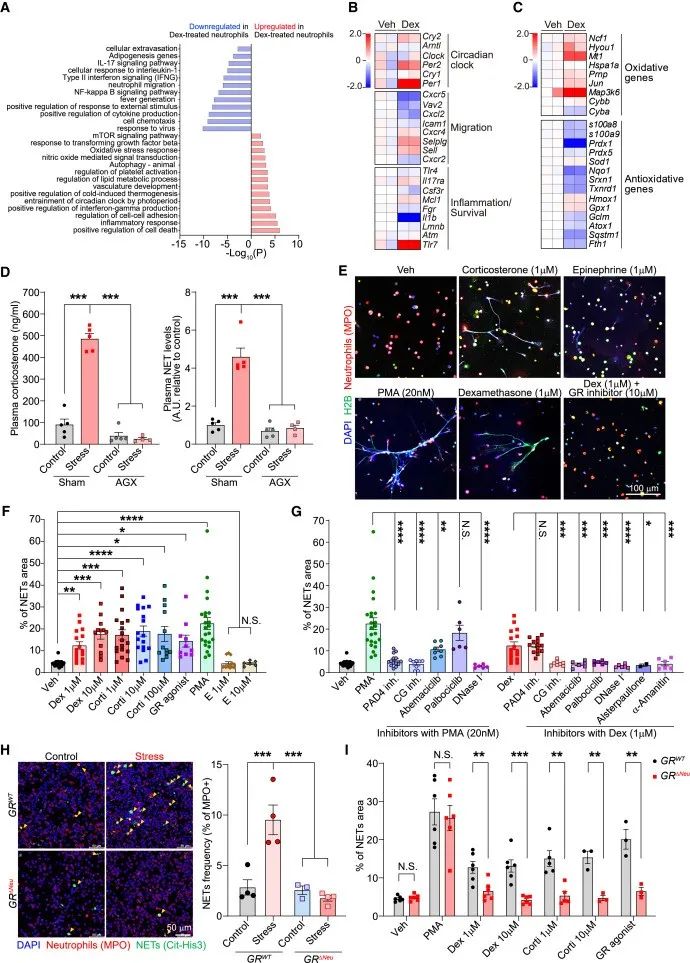
研究思路3:锁定中性粒细胞后,慢性压力对于中性粒细胞的影响是什么?作者依然从源头出发,靶向基因,探讨基因变化,结果发现中性粒细胞基因变化是由于GCs引起的,这时候将第一环节的GCs联系起来了。进一步挖掘探讨中性粒细胞是如果发生的变化,以及对于后续产生什么影响。
4、靶向压力诱导的NET可挽救转移瘤
作者检测了衰老标记物的表达,发现GR沉默小鼠的中性粒细胞与正常小鼠的中性粒细胞一样,没有经历压力诱导的异常昼夜衰老。此外,慢性压力不会诱导GR沉默或中性粒细胞耗竭野生型小鼠肺部的纤维粘连蛋白沉积。然而,中性粒细胞中的GR缺失消除了慢性压力诱导的乳腺DCC肺转移。
考虑NET的促转移作用以及在慢性压力小鼠中观察到的GR依赖性NET水平升高,作者采用DNase I消耗NET,测试了压力诱导的转移是否需要NET。结果显示,压力诱导的纤连蛋白沉积需要NET——在自发播散模型中,使用手术切除时肿瘤大小相当的小鼠,DNase I介导的NET消化减少了压力诱导的肺转移——与压力对照小鼠肺部的高度增殖转移相比,DNase I处理的压力小鼠肺部的DCCs基本上没有增殖,DNase I导致压力诱导的转移显著减少。
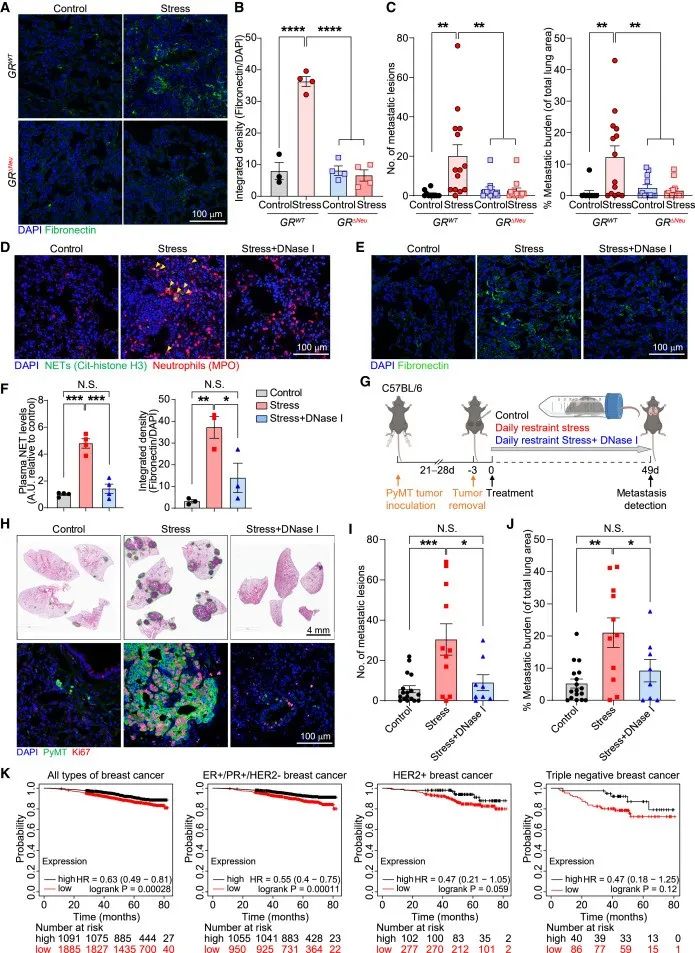
研究思路4:发现中性粒细胞通过昼夜节律以及NET发挥作用后,作者进一步挖掘并验证NET是否在这一环节中有着重要作用。对此,给予处理消耗NET后探讨相关指标,结果表明NET在肿瘤转移环节发挥重要作用。
小结
综上所述,作者的数据揭示:慢性压力暴露通过释放GCs推动转移,而这些GCs通过诱导中性粒细胞形成NET,来建立一个有利于转移的微环境。
该研究团队发现,慢性压力使小鼠癌细胞转移率增加2-4倍。慢性压力会显著改变肺微环境,包括纤连蛋白积累、T细胞浸润减少和中性粒细胞浸润增加。消耗中性粒细胞可消除压力诱导的转移。同时,慢性压力会改变中性粒细胞的正常昼夜节律,并通过GCs释放导致NET形成增加;但在特异性GR缺失的小鼠中,慢性压力不能增加NET和转移。此外,用DNase I消化NET可防止慢性压力诱导的转移。
参考文献:
[1]He XY, Gao Y, Ng D, et al. Chronic stress increases metastasis via neutrophil-mediated changes to the microenvironment. Cancer Cell. 2024;42(3):474-486.e12. doi:10.1016/j.ccell.2024.01.013
作者:梅斯学术
版权声明:
本网站所有注明“来源:梅斯医学”或“来源:MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明“来源:梅斯医学”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言











#癌细胞# #慢性压力#
12