Nat Neurosci:哈佛大学揭示“渐冻症”(ALS)的潜在治疗靶标
2019-01-30 佚名 生物通
哈佛大学干细胞科学家领导的研究指出了肌萎缩侧索硬化症(ALS)的一个潜在的新生物标记物和药物靶点,ALS是一种非常难以诊断和治疗的神经疾病。发表在Nature Neuroscience杂志的该研究利用人类运动神经元的干细胞模型揭示了STMN2基因作为潜在的治疗靶点,证明了这种人类干细胞模型方法在药物发现中的价值。
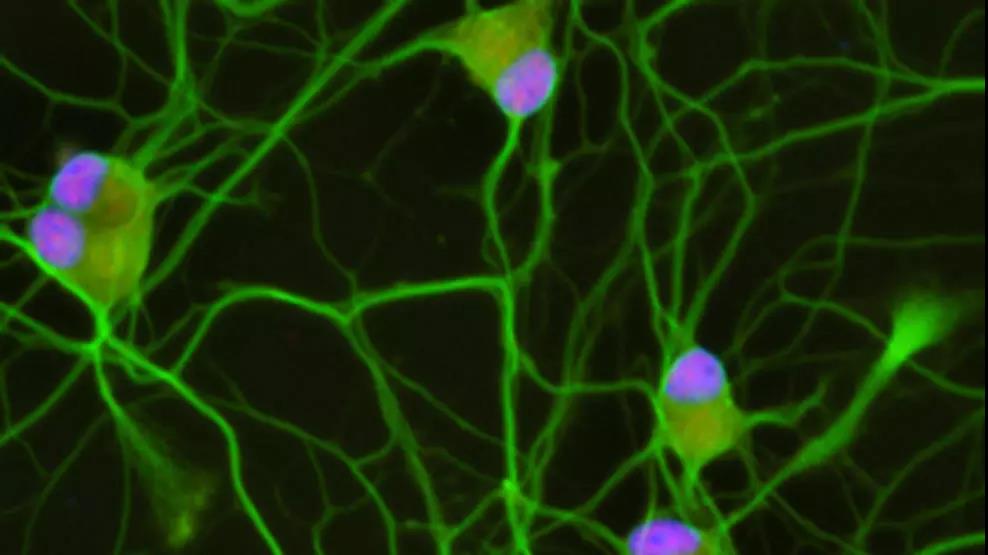
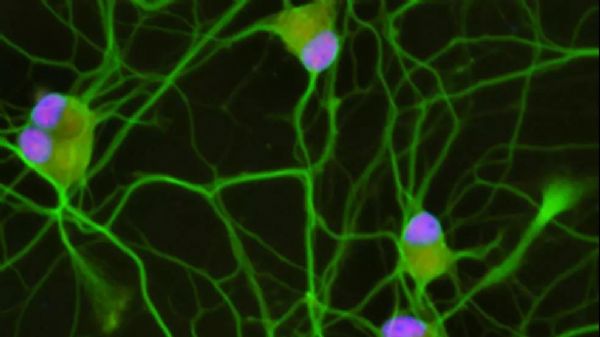
Credit: Joseph Klim
哈佛大学干细胞科学家领导的研究指出了肌萎缩侧索硬化症(ALS)的一个潜在的新生物标记物和药物靶点,ALS是一种非常难以诊断和治疗的神经疾病。发表在Nature Neuroscience杂志的该研究利用人类运动神经元的干细胞模型揭示了STMN2基因作为潜在的治疗靶点,证明了这种人类干细胞模型方法在药物发现中的价值。
ALS的诊断和治疗
ALS患者会出现运动神经元丧失和进行性麻痹。经过一段漫长的诊断过程,他们可能存活5年。美国食品药品监督管理局(FDA)已经批准了两种ALS药物,但它们只能减缓病情。
除了对更多的ALS患者有效的治疗之外,还迫切需要对ALS进行有力的测试。为了实现这一点,科学家们需要找到一个可靠的疾病生物标志物。
TDP-43:ALS的生物标志物
大约10年前,科学家在ALS患者的死后神经元中发现了一种叫做TDP-43的蛋白聚集物。这种蛋白质本应存在于这些神经元的细胞核中,但它却被冲出去,并在细胞质中积聚起来。
很明显,神经元垃圾处理系统(称为蛋白酶体)中的一些基因与TDP-43的相互作用导致了ALS。但是,涉及哪些基因以及它们在做什么还不得而知。
编码TDP-43的基因发生突变,从而引发ALS。它被传给后代,然后他们发展成肌萎缩侧索硬化症,或在某些情况下,发展成额颞部痴呆症(FTD)。自从在肌萎缩侧索硬化症患者中发现TDP-43聚集物以来,它们一直被认为是该病的标志。
研究人员在做什么
TDP-43是许多与RNA结合的蛋白质之一,RNA负责传递遗传信息,并将信息转变成特定的蛋白,比如一些神经元生长所需的蛋白。
研究人员首次确定了在人类神经元中由TDP-43蛋白调节的所有可能的RNA类型。到目前为止,类似的研究只在老鼠和癌细胞系中进行。
然后,他们研究了当他们操纵TDP-43时每个基因发生了什么。
研究人员的发现
研究人员降低了来自人类干细胞的运动神经元中TDP-43蛋白的水平。然后,利用RNA测序,他们分析了这些细胞中基因表达的变化。
在TDP-43被操纵时大约有1000个基因发生改变,其中有一个基因很突出:Stathmin2 (STMN2),一个在神经生长和修复中起重要作用的基因。
“一旦我们将TDP-43与另一个关键基因STMN2的缺失联系起来,我们就能看到运动神经元在ALS中是如何开始衰竭的。”哈佛大学干细胞与再生生物学系(HSCRB)博士后Joseph Klim说。
“随着我们的人类干细胞模型已经准确预测了患者的病情,Joseph继续在这个系统中进行测试,以确定修复Stathmin2是否能够挽救由干扰TDP-43引起的运动神经元细胞变性。在我相信能给病人带来巨大希望的一系列漂亮的实验中,他继续证明了事实确实如此:挽救Stathmin2的表达挽救了运动神经元的生长。” 哈佛大学干细胞与再生生物学教授Kevin Eggan说。
研究人员观察到,如果没有TDP-43,STMN2完美的蛋白质制造指令会变成无意义的指令。
“我们发现,当TDP-43在细胞核中的水平降低时,一个神秘的外显子被拼接到STMN2信使RNA中。基本上删除了它制造功能蛋白的指令,”Klim解释说。“这导致STMN2蛋白的缺失从而不能创造运动神经元轴突修复或生长所需的成分。”
双重和三重检查
下一步是看看他们的发现是否真实反映了病人的生物学特征。他们利用ALS患者尸检样本的RNA测序研究的数据。与对照组相比,这些罕见的数据集与研究小组在人类干细胞模型中的原始发现相呼应。来自ALS患者脊髓的数据反映出存在隐藏的外显子,但来自对照组的数据没有。
“因为我们有人来源的多能干细胞,我们可以在培养皿中制造与肌萎缩侧索硬化症相关的细胞,并在适当的环境中研究这个非常具体的问题:人类中所有能调节运动神经元的基因和遗传因子有哪些。”Q-State Biosciences公司的Luis Williams补充说,他在哈佛大学干细胞与再生生物学的博士论文是这项研究的第一个主要步骤。
为什么该研究很重要
“这些实验指向一条明确的道路,以测试患者修复Stathmin2是否能减缓或停止其疾病。”Eggan教授说,“我们的发现表明了一种开发ALS潜在治疗方法的明确方法——一种可以干预除极少数个体以外的所有个体,不管其疾病的遗传原因如何。”
原始出处:Joseph R. Klim, Luis A. Williams, Francesco Limone, et al. ALS-implicated protein TDP-43 sustains levels of STMN2, a mediator of motor neuron growth and repair. Nat Neurosci, 14 January 2019
作者:佚名
版权声明:
本网站所有注明“来源:梅斯医学”或“来源:MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明“来源:梅斯医学”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言








如果想要研究这个,应该学习哪个专业?
39
#治疗靶标#
40
祈求科研人员早日攻克渐冻症ALS(肌萎缩侧索硬化),救救痛苦的病人和家属
70
#Nat#
39
#渐冻症#
39