学习2024.V5版NCCN非小细胞肺癌指南,详解基因检测指导靶向治疗疗效数据
2024-06-09 苏州绘真医学 苏州绘真医学
生物标志物检测对于指导治疗选择和确保NSCLC患者获得最佳疗效至关重要,尤其是对于晚期或转移性疾病患者。
肺癌是美国癌症相关死亡的主要原因。2024年,预计将有234,580例新病例(男性116,310例,女性118,270例)被诊断为肺癌和支气管癌,125,070例(男性65,790例,女性59,280例)将死于该疾病。据估计,25.4%的肺癌和支气管癌患者在确诊后存活5年或更长时间;这包括2013年至2019年美国的非小细胞肺癌(NSCLC)患者和小细胞肺癌(SCLC)患者。腺癌组织学患者的总体5年相对生存率为32.2%。自2006年以来,男性肺癌发病率每年下降2.5%,女性肺癌发病率每年下降1%。预计2024年81%的肺癌死亡将直接由吸烟引起。
肺癌治疗取得了重大进展,包括筛查方面的进展;诊断和治疗的微创技术;放射治疗(RT),包括立体定向消融放射治疗(SABR);以及新的靶向治疗和免疫疗法。这些新疗法的出现与NSCLC患者生存率的提高有关。2015年至2016年,NSCLC的2年相对生存率为42%,而 2009年至2010年为34%。适合接受靶向疗法或免疫疗法的NSCLC患者的生存期更长;5年生存率范围为15%-62.5%,具体取决于生物标志物。因此,生物标志物检测对于指导治疗选择和确保NSCLC患者获得最佳疗效至关重要,尤其是对于晚期或转移性疾病患者。
晚期或转移性NSCLC
对于晚期或转移性NSCLC患者,NCCN指南建议在治疗前确定组织学亚型,以便选择合适的治疗方案。戒烟咨询(如有必要)和姑息治疗也应纳入疾病管理策略。数据表明,早期姑息治疗与转移性NSCLC患者较高的生活质量相关。
作为广泛分子分析的一部分,应进行针对体细胞、疾病相关的致癌驱动突变或变异的分子检测,这是专家组强烈推荐的。广泛分子分析是指通过单一检测或有限数量的检测组合,识别指南中规定的所有可干预分子生物标志物的分子检测,并且最好还能识别新兴生物标志物。基于共存生物标志物低发生率的分层方法是可以接受的。广泛分子分析的目标是确定驱动变异,从而指导现有靶向治疗的使用,或者就可能的临床试验向患者提供适当的建议。因此,广泛分子分析被认为是改善NSCLC患者治疗的关键组成部分。
建议通过活检和/或血浆检测进行分子检测;同时或先后进行组织和血浆检测的组合是可接受的。有证据表明,同时检测可缩短检测结果的时间,应根据临床情况考虑。一种方法的阴性结果(定义为无明确的驱动突变)提示可使用补充方法。
建议对所有晚期或转移性非鳞状NSCLC(即腺癌、大细胞癌)和未另作规定的NSCLC患者进行EGFR、ALK、KRAS、ROS1、BRAF、NTRK1/2/3、METex14跳跃、RET和ERBB2 (HER2)变异的分子检测。对于非鳞状NSCLC或未另作规定的NSCLC患者,EGFR突变和ALK重排检测是第1类推荐,依据现有数据可为这些生物标志物推荐靶向治疗。在所有变异中,鳞状细胞癌中可作为治疗靶点的分子变异的累积发生率为2%-10%,因此所有晚期或转移性NSCLC鳞状细胞癌患者都应考虑相同的分子检测,而不仅仅是具有某些临床特征(如从不吸烟状态和混合组织学类型)的患者。
如果发现了临床可干预的生物标志物,指南将提供适当的治疗建议。如果结果未知或尚待确定,则可将患者视为无驱动癌基因。然而,回顾性数据表明,在晚期非鳞状NSCLC患者中,治疗开始前进行分子检测与较长的总生存期(OS)相关。如果患者需要紧急开始治疗,临床医师应考虑将免疫治疗推迟一个周期(即仅使用铂类化疗方案)。临床医师需要了解免疫检查点抑制剂的半衰期长,并且将某些靶向疗法(如奥希替尼)与免疫检查点抑制剂联用或在免疫检查点抑制剂之后使用,副作用发生率可能较高。
如果在一线全身性治疗期间发现了有临床指导意义的生物标志物,则可以中断或完成计划的全身性治疗(包括维持治疗),然后转换为适当的靶向治疗。可考虑用于指导这一决策的因素包括患者正在经历的毒性水平,以及是否观察到临床或影像学反应。
对于晚期或转移性NSCLC患者,在一线治疗前进行PD-L1表达检测也是第1类建议(不论组织学类型如何),目的是评估在未发现有指导意义的分子生物标志物的情况下,免疫检查点抑制剂(ICI)的使用情况。对于没有可作为治疗靶点的分子生物标志物的晚期或转移性NSCLC,可选择的治疗方案根据PD-L1水平进行分层,并包括全身治疗方案,如免疫治疗联合或不联合化疗(见NSCL-37和NSCL-38页)。

NSCL-37
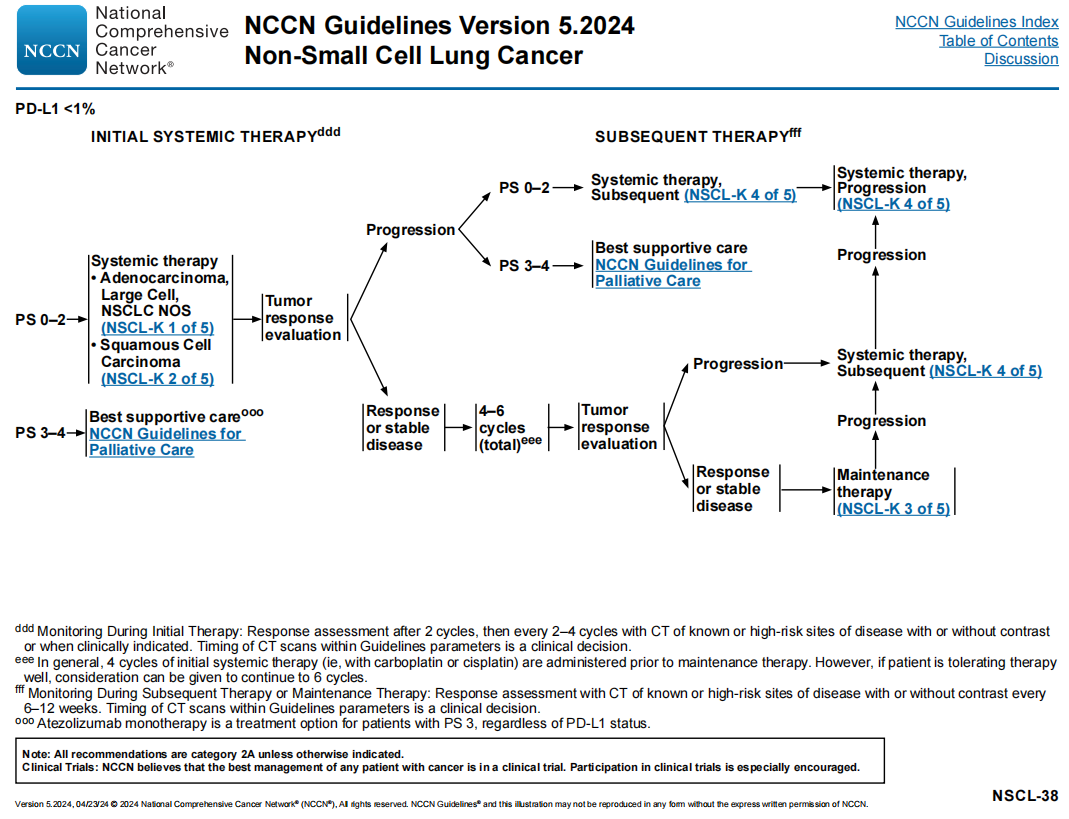
NSCL-38
在NCCN指南中,不论PD-L1水平如何,对于携带一些(但不是全部)致癌驱动基因的晚期或转移性NSCLC患者,均推荐一线适应证的靶向治疗作为初始治疗,而不是一线ICIs。其基本原理是,在一线治疗中,靶向治疗的缓解率(如奥希替尼,80%)通常高于ICIs(缓解率较低),并且靶向治疗的耐受性较好。需要指出的是,在一线治疗中,对于具有某些可干预生物标志物的NSCLC,目前尚无靶向治疗,也不推荐靶向治疗。例如,有KRAS G12C突变的NSCLC患者可能从一线免疫治疗(联合或不联合化疗)中获益。对于有KRAS G12C突变的患者,仅推荐将靶向治疗用于二线或更晚的治疗。
建议在初始治疗期间进行监测,在2个周期后,使用CT(造影或非造影)对已知或高风险疾病部位(如胸部、腹部和骨盆)进行反应评估,然后每2至4个周期进行一次。同样,还建议在维持治疗或后续治疗期间,每6-12周进行1次CT(加或不加造影剂),监测已知或高危疾病部位。
关于晚期或转移性NSCLC的完整治疗建议,见图1。

图1
EGFR变异NSCLC:
EGFR是一种受体酪氨酸激酶,在部分NSCLC患者中发生变异。NSCLC中最常见的两种EGFR变异是外显子19的缺失(LREA序列的保守缺失)和外显子21的点突变(L858R)。这两种变异占NSCLC中所有EGFR变异的85%-90%。两者均可激活酪氨酸激酶结构域,并与对小分子EGFR酪氨酸激酶抑制剂(TKI)的敏感性相关。这些EGFR变异见于约10%的白种人NSCLC患者、高达19%的黑种人患者和50%的亚洲患者。
其他不太常见的EGFR突变(约10%)包括外显子20 S768I、外显子21 L861Q和/或外显子18 G719X。这些突变对第一代(厄洛替尼/吉非替尼)、第二代(阿法替尼/达可替尼)和第三代(奥希替尼)EGFR TKI有不同程度的敏感性。
EGFR T790M是与EGFR TKI获得性耐药相关的EGFR外显子20突变,据报道,约60%的患者在接受阿法替尼、厄洛替尼或吉非替尼初始治疗后出现疾病进展。如果在未接受过EGFR TKI治疗的情况下发现EGFR T790M,则需要进行遗传咨询和可能的胚系基因检测。无论吸烟状况如何,胚系EGFR T790M的发现均提示肺癌的高风险。
EGFR第20号外显子插入突变是第三常见的EGFR突变类型;约2%的NSCLC患者和4%-12%的EGFR突变患者会出现此类突变。EGFR第20号外显子插入突变具有异质性;虽然有这些变异体的NSCLC对早期EGFR TKI的缓解率通常较低,但据报道,根据变异体的不同,新疗法的缓解水平各不相同。
临床数据:EGFR外显子19缺失或外显子21 L858R突变的NSCLC
奥希替尼是美国FDA批准的第三代口服EGFR TKI,用于治疗EGFR变异的NSCLC。奥希替尼单药治疗以及奥希替尼联合铂类和培美曲塞化疗均适用于EGFR外显子19缺失或外显子21 L858R突变的转移性NSCLC成人患者的一线治疗。
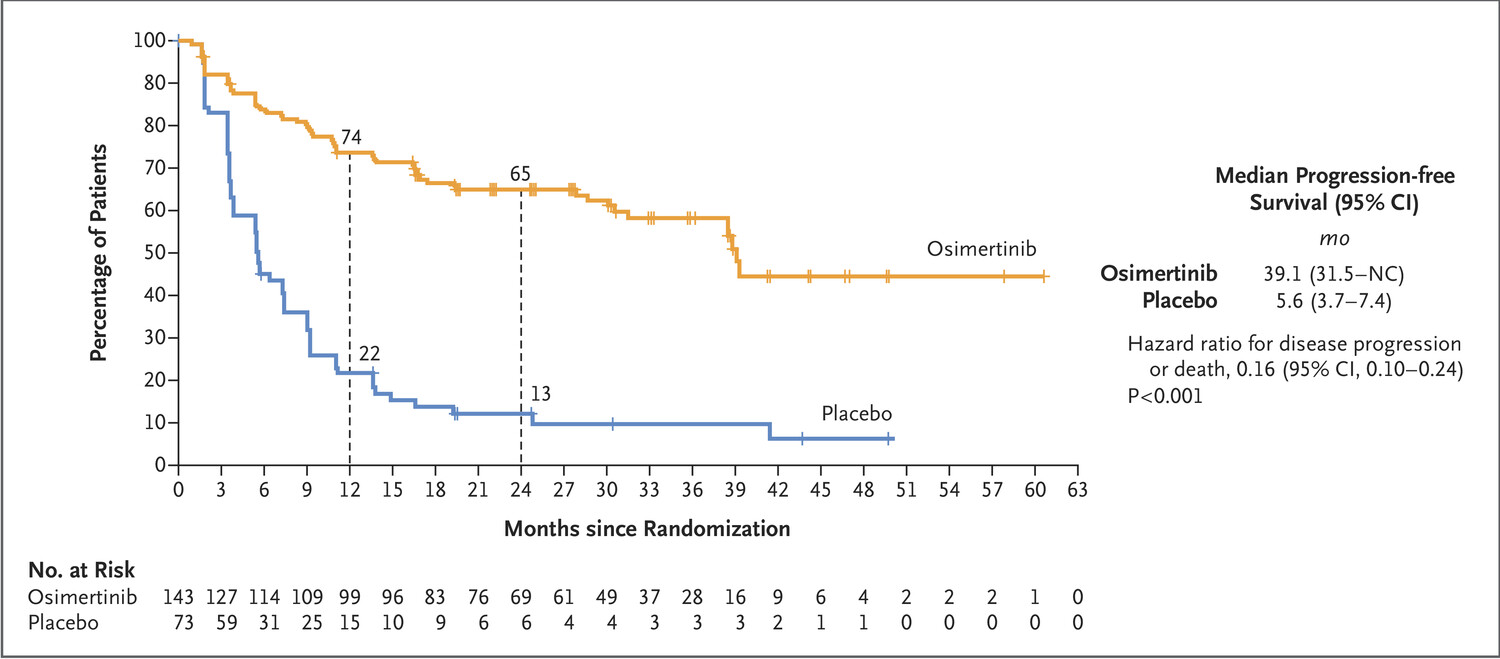
FLAURA是一项III期随机试验,在EGFR突变(外显子19缺失或L858R)的转移性NSCLC患者中比较了奥希替尼与厄洛替尼或吉非替尼的一线治疗疗效。与厄洛替尼或吉非替尼相比,奥希替尼的中位无进展生存期(PFS)较长(18.9个月vs 10.2个月;风险比[HR],0.46;P<.001)。奥希替尼组的中位缓解持续时间超过厄洛替尼或吉非替尼组(中位缓解时间,17.2个月vs 8.5个月)。奥希替尼组仅6%的患者发生了中枢神经系统(CNS)进展事件,而厄洛替尼或吉非替尼组为15%。奥希替尼组34%的患者和厄洛替尼或吉非替尼组45%的患者报告了3级或更高级别的不良事件(AEs)。一项最新分析表明,奥希替尼组的中位OS为38.6个月,而厄洛替尼或吉非替尼组的中位OS为31.8个月(HR,0.8;P=.046)。
FLAURA2是一项III期开放标签随机研究,评估了奥希替尼联合化疗(培美曲塞和顺铂或卡铂)与奥希替尼单药一线治疗的效果,研究对象为557名EGFR外显子19缺失或L858R的晚期NSCLC患者。83%的患者组织学类型为腺癌。与仅接受奥希替尼治疗的患者相比,在接受奥希替尼联合化疗的患者中,研究者判定的中位PFS较长(25.5个月 vs 16.7个月;HR,0.62;P<.001)。奥希替尼+化疗组的中位缓解持续时间也超过奥希替尼单药治疗组(24.0个月vs 15.3个月)。奥希替尼+化疗组的3级AEs数量高于奥希替尼单药治疗组,主要原因是已知的化疗相关AEs。
埃万妥单抗(Amivantamab-vmjw)是EGFR和MET的双特异性人源抗体,已在多种EGFR突变的NSCLC患者中进行了研究。对于有EGFR外显子19缺失或L858R突变,并且在奥希替尼单药治疗期间或之后疾病进展的晚期NSCLC患者,III期随机试验MARIPOSA-2评估了埃万妥单抗联合化疗(卡铂和培美曲塞)作为后续治疗的疗效,并与化疗进行了比较。埃万妥单抗+化疗组的中位PFS长于化疗组(6.3个月 vs 4.2个月;HR,0.48;P<.001)。埃万妥单抗+化疗组的客观缓解率为64%,而单独化疗组为36%。在中期分析中,OS无统计学显著差异。最常见的3级及以上AEs为中性粒细胞减少、血小板减少、贫血和白细胞减少。
多项研究表明,其他EGFR抑制剂单药或联合方案对EGFR变异的晚期或转移性NSCLC患者也有效。厄洛替尼、吉非替尼和达可替尼均已被FDA批准用于治疗肿瘤有EGFR外显子19缺失或外显子21(L858R)替换突变的转移性NSCLC。厄洛替尼联合雷莫芦单抗或贝伐珠单抗也可作为选择。
一些研究已经报告,不论PD-L1表达情况如何,二线治疗中PD-1/PD-L1抑制剂单药治疗EGFR外显子19缺失或外显子21 L858R阳性NSCLC的疗效较差。最近的数据还提示,在EGFR外显子19缺失或外显子21 L858R的转移性NSCLC患者中,与单独化疗相比,PD-1抑制剂(帕博利珠单抗)联合化疗作为后续治疗可能并无OS或PFS获益。
NCCN建议:EGFR外显子19缺失或外显子21 L858R突变的晚期或转移性NSCLC
本节讨论图2-4。在一线治疗中,NCCN NSCLC专家组建议,对于有EGFR外显子19缺失或外显子21 L858R突变的晚期或转移性NSCLC患者,奥希替尼单药治疗是首选治疗方案。厄洛替尼、阿法替尼、吉非替尼或达可替尼单药治疗是其他推荐的一线治疗方案。所有这些都是第1类建议,适用于体能状态0-4分的患者。

图2

图3

图4
对于EGFR外显子19缺失或外显子21 L858R突变的晚期或转移性NSCLC,以下联合治疗方案也被纳入指南,作为一线治疗的“其他推荐”方案:奥希替尼联合培美曲塞、顺铂或卡铂(第1类;非鳞状上皮)、厄洛替尼联合贝伐珠单抗(非鳞状上皮且近期无咯血病史),或者厄洛替尼联合雷莫芦单抗。FDA批准的生物仿制药是贝伐珠单抗的合适替代品。
如果在一线全身治疗期间发现EGFR外显子19缺失或EGFR外显子21 L858R突变,也推荐靶向治疗作为一种选择。对于接受一线ICI联合或不联合化疗的患者,肿瘤科医师应注意ICI的半衰期长,和将奥希替尼(或其他TKIs)与ICI联用时或在ICIs后使用时的可能AEs。例如,在某些ICIs治疗后3个月内开始奥希替尼治疗时,肺炎等不良事件的发生率较高。
在接受奥希替尼一线治疗后发生疾病进展的患者中,后续治疗的决策是根据疾病症状和进展部位做出。如果患者出现有症状的全身进展和/或多发病变,一般建议改变全身治疗。在考虑二线全身治疗时,理想情况下应对患者进行再次活检,以排除向小细胞组织学类型转化,这一现象发生于约5%的EGFR TKI耐药肿瘤。埃万妥单抗联合卡铂和培美曲塞是多发性病灶(非鳞状)患者的首选1类治疗方案。对于有症状的全身性进展患者,还推荐使用化疗等全身性治疗方案。二线治疗的数据提示,不论PD-L1表达情况如何,PD-1/PD-L1抑制剂单药治疗EGFR外显子19缺失或外显子21 L858R NSCLC的疗效均较差。
确定性局部治疗在转移性EGFR阳性NSCLC的治疗中具有一定作用。对于初始转移部位数量有限(寡转移;数量有限并非普遍定义,临床试验包括3-5个转移灶)的患者,如果在EGFR TKI治疗前未给予确定性局部治疗(如SABR或手术),则应考虑在开始EGFR TKI治疗(局部巩固治疗)后进行确定性局部治疗(如SABR或手术)作为巩固治疗。对于EGFR TKI初始治疗后疾病进展的某些患者,局部治疗可能也是合适的后续治疗选择。对于无症状进展或有症状全身进展有限(寡进展)的患者,无论既往是否接受过TKI治疗,局限病变均应考虑确定性局部治疗(如SABR或手术);图像引导热消融(IGTA)治疗也可能是一种选择。对于CNS进展的患者,应考虑对有症状的病变进行确定性局部治疗(如立体定向放射外科[SRS]联合或不联合手术切除),并根据大小、位置和水肿等因素,对有症状进展风险的无症状病变考虑SRS。
临床数据:EGFR S768I、L861Q和/或G719X突变的NSCLC
对于携带较少见EGFR S768I、L861Q和/或G719X突变的患者,治疗建议是基于非随机研究。阿法替尼是第二代口服TKI,可不可逆地抑制包括EGFR和 HER2在内的ErbB/HER受体家族。对几项LUX-Lung试验(LUX-Lung 2、3和6)进行的一项事后分析评估了阿法替尼治疗携带最常见罕见EGFR突变(L861Q、G719X和S768I)的晚期NSCLC患者。中位OS为19.4个月。8例(100%)EGFR S768I突变患者接受阿法替尼治疗后达到缓解。在携带EGFR G719X突变的患者中,14例(77.8%)患者接受阿法替尼治疗后达到客观缓解,而在携带EGFR L861Q突变的患者中,9例(56.3%)患者接受阿法替尼治疗后达到缓解。
奥希替尼也已被研究用于携带较不常见EGFR突变(包括S768I、L861Q和G719X)的患者。韩国的一项II期试验KCSG-LU15-09评估了奥希替尼对携带这些突变的转移性或复发性NSCLC患者的一线治疗效果。中位PFS为8.2个月,客观缓解率为50%。奥希替尼治疗后,观察到EGFR L861Q患者中78%(7/9)、EGFR G719X患者中53%(10/19)和EGFR S768I患者中38%(3/8)的客观缓解。L861Q组、G719X组和S768I组的中位PFS分别为15.2个月、8.2个月和12.3个月。可控制的AEs包括皮疹、瘙痒、食欲下降、腹泻和呼吸困难。
回顾性数据提示,奥希替尼和阿法替尼治疗后的临床应答可能不同,这取决于检出的确切EGFR突变。例如,EGFR L861Q的NSCLC对奥希替尼的反应可能比对阿法替尼的反应更大。
NCCN建议:EGFR S768I、L861Q和/或G719X突变的晚期或转移性NSCLC
对于携带较少见EGFR S768I、L861Q和/或G719X突变的晚期或转移性NSCLC患者,NCCN NSCLC专家组建议将阿法替尼或奥希替尼作为首选一线治疗方案(图5)。所有这些均适用于体力状态评分为0-4分的患者。

图5
对于在接受阿法替尼、奥希替尼、厄洛替尼、吉非替尼或达可替尼一线治疗后发生进展的EGFR S768I、L861Q和/或G719X变异的晚期或转移性NSCLC,后续治疗选择与较常见的EGFR变异相同,参见图3和图4以及上述详细介绍的针对EGFR外显子19缺失或外显子21 L858R的晚期或转移性NSCLC的后续治疗建议。
临床数据:EGFR外显子20插入突变的NSCLC
对于EGFR外显子20插入的NSCLC患者,早代的EGFR TKIs治疗通常与疾病缓解无关。EGFR外显子20插入阳性转移性NSCLC患者常接受以铂类为基础的一线化疗。免疫治疗方案的缓解率(0%-25%)因特定的EGFR外显子20插入突变而异。莫博赛替尼是一种专门为EGFR外显子20插入患者开发的EGFR TKI,此前美国FDA已加速批准其上市。然而,莫博赛替尼于2023年退出美国市场,并且基于III期EXCLAIM-2试验(该试验比较了莫博赛替尼一线治疗与铂类化疗)的数据,专家组不再推荐其作为后续治疗方案,因为未达到主要终点。
美国FDA已批准埃万妥单抗单药治疗有EGFR外显子20插入突变,并且疾病在铂类化疗期间或之后发生进展的局部晚期或转移性NSCLC成人患者。I期CHRYSALIS研究在既往接受过一线或多线治疗的81例EGFR外显子20插入阳性转移性NSCLC患者中评估了埃万妥单抗的后续治疗。总缓解率为40%,其中3例完全缓解。中位PFS为8.3个月。常见的治疗相关AEs包括皮肤反应、输液相关反应和甲沟炎。最常见的3-4级不良反应包括低钾血症、肺栓塞、中性粒细胞减少、腹泻和皮疹。安全性评估报告了8例死亡(7%)。
埃万妥单抗联合卡铂和培美曲塞也被FDA批准用于治疗有EGFR外显子20插入突变的局部晚期或转移性NSCLC成人患者。III期随机试验PAPILLON在308例既往未接受过全身性治疗、有EGFR外显子20插入的晚期NSCLC患者中,评估了埃万妥单抗联合化疗(培美曲塞和卡铂)与单独化疗一线治疗的疗效和安全性。埃万妥单抗+化疗组的中位PFS超过单独化疗组(11.4个月vs 6.7个月;HR,0.40;P< .001)。根据中期OS分析,与单独化疗相比,埃万妥单抗联合化疗的HR为0.67(P=0.11)。埃万妥单抗联合化疗最常见的不良反应为血液学反应和皮肤相关的EGFR相关毒性事件(如皮疹、甲沟炎、痤疮样皮炎)。
NCCN建议:EGFR外显子20插入突变的晚期或转移性NSCLC
NCCN NSCLC专家组建议将埃万妥单抗联合卡铂和培美曲塞作为晚期或转移性非鳞状EGFR外显子20插入突变阳性NSCLC患者的1类首选治疗方案(图6)。指南中列出的其他全身治疗方案(如化疗)也被推荐作为一线治疗方案。数据表明,在有EGFR变异的NSCLC中,ICI单药治疗与低活性相关。
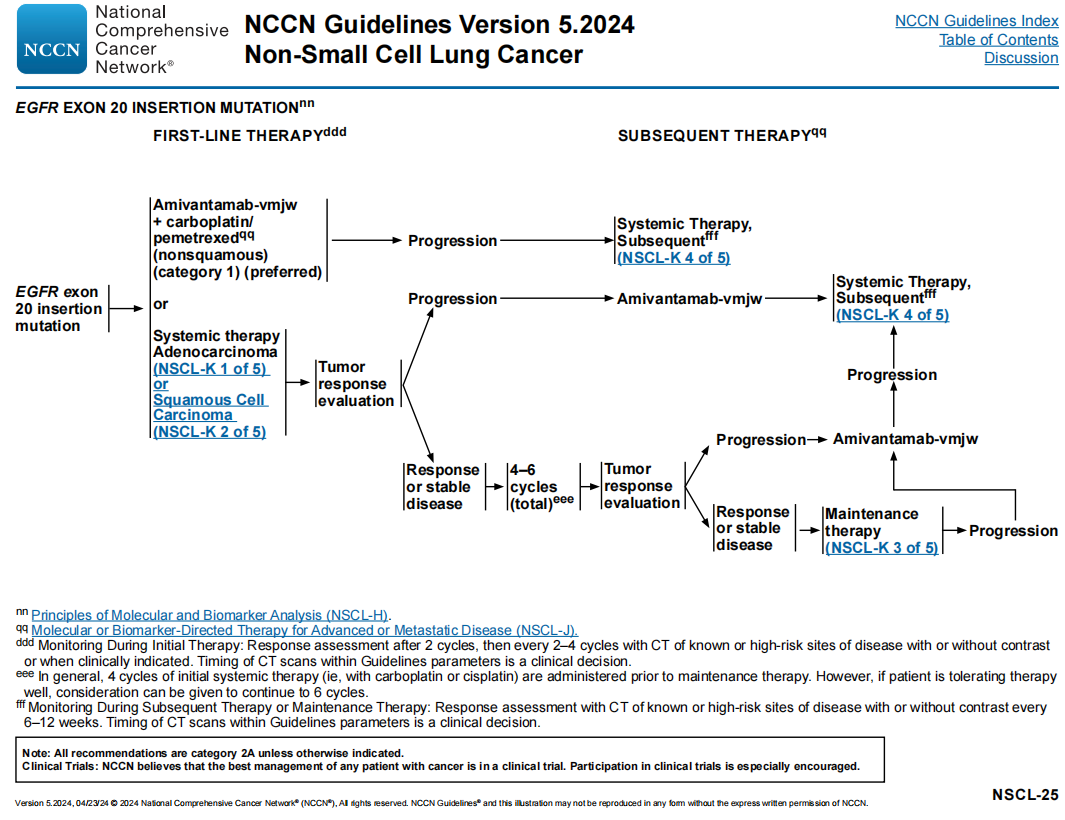
图6
对于既往未接受过埃万妥单抗治疗的EGFR外显子20插入突变阳性晚期或转移性NSCLC患者,NCCN NSCLC专家组建议将埃万妥单抗作为后续治疗方案。对于埃万妥单抗联合化疗一线治疗后疾病进展的患者,建议采用指南中NSCL-K 4/5列出的后续治疗选择。

NSCL-K 4/5
KRAS G12C突变的NSCLC:
KRAS是一种具有内在GTPase活性的蛋白质,在肺癌中通常发生突变。这些突变可通过MAP/ERK通路导致不受调控的信号传导。KRAS G12C是一种可导致下游致癌通路激活增加的激活突变。数据提示,北美人群中约25%的腺癌患者携带KRAS突变,是该人群中最常见的突变。与许多其他可干预的突变(如EGFR突变、ALK重排)不同,一些(但不是全部)KRAS突变与吸烟相关。
临床数据:
与大多数其他可干预的变异不同,靶向治疗不推荐作为携带KRAS G12C突变的晚期或转移性NSCLC的一线治疗方案。数据表明,有KRAS突变的晚期或转移性NSCLC患者可能从一线免疫治疗方案中获益。此外,一项研究报告,在接受ICI单药治疗的KRAS突变晚期NSCLC患者中,PFS和PD-L1表达呈正相关。
有两种靶向疗法可作为KRAS G12C突变的NSCLC的后续治疗选择。阿达格拉西布(Adagrasib)和索托雷塞(sotorasib)是靶向KRAS G12C的口服小分子药物,FDA已加速批准这两种药物用于治疗既往接受过至少1种全身治疗的KRAS G12C突变局部晚期或转移性NSCLC成人患者。
一项II期研究在既往接受过铂类化疗(±PD-1或PD-L1免疫治疗)的126例KRAS G12C突变阳性晚期NSCLC患者中评估了索托雷塞作为后续治疗的疗效。中位OS为12.5个月,客观缓解率为37.1%;4例患者报告完全缓解。19.8%的患者发生了与治疗相关的3级不良事件,包括腹泻、丙氨酸转氨酶和天冬氨酸转移酶水平升高;发生了1起与治疗相关的4级事件(呼吸困难和肺炎)。
一项II期研究评估了阿达格拉西布作为116例KRAS G12C突变阳性晚期NSCLC患者的后续治疗,这些患者之前接受过至少一种基于铂的化疗和免疫治疗。中位OS为12.6个月,客观缓解率为42.9%。颅内缓解率为33.3%。44.8%的患者发生3级或以上不良事件,包括贫血、肺炎、呼吸困难、急性肾损伤、低钠血症、疲劳、恶心、谷丙转氨酶和天冬氨酸转移酶水平升高。有 2 例死亡(心力衰竭和肺出血)。
一项随机III期试验在345例KRAS G12C突变阳性晚期NSCLC患者的后续治疗中比较了索托雷塞和多西他赛治疗,这些患者先前接受过铂基化疗加PD-1或PD-L1抑制剂。接受索托雷塞的患者中位PFS为5.6个月,而接受多西他赛的患者中位PFS为4.5个月(HR,0.66;P=0.0017)。报告的OS无差异。
NCCN建议:
NCCN NSCLC专家组建议,对于有KRAS G12C突变的晚期或转移性NSCLC患者,根据PD-L1水平来确定合适的一线全身治疗方案(如免疫治疗和/或化疗)(图7)。基于PD-L1水平的治疗建议见NSCL-37和NSCL-38。
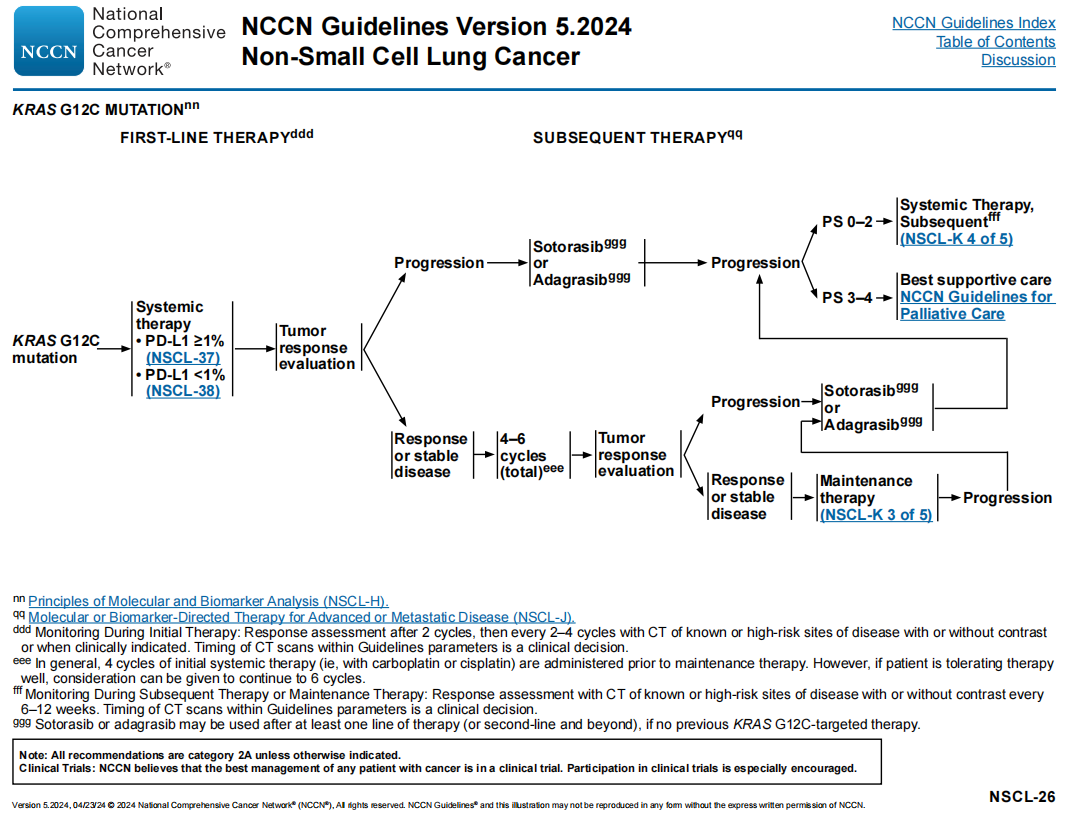
图7
专家组推荐阿达格拉西布和索托雷塞作为一线全身治疗后出现疾病进展的患者的后续治疗选择。如果患者之前没有接受过靶向KRAS G12C治疗,阿达格拉西布和索托雷塞也可以用作三线治疗或其他治疗。专家组指出,不建议在病情进展时更换具有类似作用机制的药物。
ALK重排的NSCLC:
约5%的NSCLC患者存在导致基因融合的ALK基因重排。这些事件可导致失调和不恰当的ALK信号传导。
临床数据:
初步研究表明,对于有ALK重排的晚期或转移性NSCLC患者,单药ALK抑制剂(克唑替尼和塞瑞替尼)优于化疗。FDA已经批准克唑替尼和塞瑞替尼用于治疗ALK阳性转移性NSCLC成人患者。随后的试验比较了较新的药物与克唑替尼。
阿来替尼是一种ALK抑制剂,已被FDA批准用于治疗ALK阳性转移性NSCLC患者。III期随机试验ALEX在303例ALK阳性晚期NSCLC患者(包括无症状CNS疾病患者)中评估了阿来替尼和克唑替尼的一线治疗疗效。与克唑替尼相比,接受阿来替尼治疗的患者发生疾病进展或死亡的比例较低(41% vs 68%)。阿来替尼组中研究者评估的PFS率高于克唑替尼组(68.4% vs 48.7%;HR,0.47;P< .001)。与克唑替尼相比,阿来替尼在11.1个月时未达到中位PFS。阿来替尼组发生CNS进展的患者(12%)少于克唑替尼组(45%)。阿来替尼组的缓解率为82.9%,克唑替尼组为75.5%(P=0.09)。接受阿来替尼治疗的患者比接受克唑替尼治疗的患者有较少的3级或更高级别AEs(分别为41% vs 50%),尽管患者接受阿来替尼治疗的持续时间比接受克唑替尼治疗的患者长(中位数,17.9个月 vs 10.7个月)。阿来替尼组(3.3%)报告的死亡率低于克唑替尼组(4.6%);克唑替尼组报告了2例与治疗相关的死亡,阿来替尼组无一例死亡。对该试验进行的最新分析报告,阿来替尼组和克唑替尼组的5年OS率分别为62.5%和45.5%。
J-ALEX是一项III期开放标签随机试验,评估了207名日本ALK阳性晚期NSCLC患者(未接受过ALK抑制剂治疗)使用阿来替尼与克唑替尼进行一线治疗的效果。阿来替尼组未达到中位PFS,克唑替尼组为10.2个月(HR,0.34;分层对数秩P <.0001)。阿来替尼组3级或4级AEs发生率(26%)低于克唑替尼组(52%)。与克唑替尼组(20%)相比,因AEs而停止服用阿来替尼的患者较少(9%)。
布格替尼是一种ALK抑制剂,已被FDA批准用于治疗ALK阳性转移性NSCLC成人患者。ALTA-1L是一项III期随机试验,在275例ALK阳性转移性NSCLC患者中评估了布格替尼与克唑替尼作为一线治疗的疗效。在第一次中期分析中,接受布格替尼治疗患者的PFS率(67%)高于克唑替尼患者(43%)(HR,0.49;P<.001)。布格替尼组的颅内缓解率(78%)也高于克唑替尼组(29%)。在第二次期中分析时(中位随访24.9个月),与克唑替尼相比,布格替尼继续显示出盲法独立审查委员会评估的PFS改善(48% vs 26%;HR,0.49;P<.0001)。3年后,布格替尼组的PFS为43%,克唑替尼组为19%(HR,0.48)。两组均未达到中位OS。然而,一项事后分析提示,颅内转移患者有生存获益(HR,0.43;95%CI,0.21-0.89)。
劳拉替尼是一种ALK抑制剂,已被FDA批准用于治疗ALK阳性转移性NSCLC成人患者。CROWN是一项III期随机试验,在296例ALK阳性晚期NSCLC患者中评估了劳拉替尼和克唑替尼一线治疗疗效。12个月时,劳拉替尼组78%的患者无疾病进展生存,而克唑替尼组39%的患者无疾病进展(HR,0.28;P< .001)。劳拉替尼组和克唑替尼组的客观缓解率分别为76%和58%。对于有可测量脑转移的患者,劳拉替尼组82%的患者和克唑替尼组23%的患者报告了颅内缓解。劳拉替尼组71%的患者达到了颅内完全缓解。高脂血症、水肿、体重增加、周围神经病变和认知影响是劳拉替尼组中最常见的AEs。劳拉替尼组的3级或4级AEs(主要是血脂水平改变)发生率高于克唑替尼组(分别为72%和56%)。对CROWN研究进行的事后分析表明,在基线时有脑转移的患者中,劳拉替尼组的12个月CNS进展累积发生率为7%,而克唑替尼组为72%。12个月PFS率分别为78%和22%。在基线时无脑转移的患者中,劳拉替尼组的12个月CNS进展累积发生率为1%,而克唑替尼组为18%。12个月PFS率分别为78%和45%。CROWN试验的最新数据表明,劳拉替尼组和克唑替尼组的3年PFS率分别为64%和19%。此外,在基线时有脑转移的患者中,劳拉替尼组与克唑替尼组相比,至颅内进展时间的HR为0.10,在基线无脑转移的患者中为0.02。
数据提示,劳拉替尼可作为其他ALK抑制剂治疗后疾病进展的患者(包括有CNS转移的患者)的后续治疗。一项II期试验在ALK抑制剂治疗后疾病进展的ALK阳性或ROS1阳性晚期NSCLC患者中评估了劳拉替尼。许多患者有无症状的CNS转移。在既往接受过至少一种ALK抑制剂治疗的ALK阳性患者队列中,47%的患者达到了客观缓解:完全缓解4例,部分缓解89例。在基线时有可测量的CNS病变的患者中,63%的患者达到了客观颅内缓解。劳拉替尼对既往接受过高达3种ALK抑制剂治疗的患者有效。3-4级AEs包括高胆固醇血症和高甘油三酯血症。7%的患者发生了与治疗相关的严重AEs,包括1%的认知影响;认知效应导致劳拉替尼永久性停药。
该试验的数据还表明,劳拉替尼作为ALK G1202R耐药突变患者的后续治疗有效,ALK G1202R耐药突变常在第二代ALK TKI(如布格替尼、阿来替尼或塞瑞替尼)治疗进展后检出。对于有ALK耐药突变并且第二代ALK TKI治疗后疾病进展的患者,突变基于血浆ctDNA检测时劳拉替尼的客观缓解率为62%(基于组织检测时为69%),而在无ALK突变的患者中,客观缓解率为32%(血浆)和27%(组织)。然而,其他研究的数据提示,劳拉替尼对耐药的复合ALK突变(如L1196M和G1202R共突变)的NSCLC可能无效。
NCCN建议:
NCCN NSCLC专家组推荐阿来替尼、布格替尼或劳拉替尼作为有ALK重排的晚期或转移性NSCLC患者的首选一线治疗方案。塞瑞替尼是“其他推荐”的一线选择,而克唑替尼被认为在某些情况下有用(图8-10)。所有这些选择均适用于体能状态评分0-4分的患者,并且如果在一线全身性治疗前发现ALK重排,则属于第1类推荐。

图8

图9

图10
在疾病进展方面,NCCN专家组建议考虑采用广泛的分子分析进行血浆和/或组织检测,以确定基因组耐药机制,并指导后续治疗方案的使用。
阿来替尼、布格替尼或塞瑞替尼治疗进展后,专家组建议将治疗转换为劳拉替尼。对于在一线治疗中使用劳拉替尼时或之后发生疾病进展的患者,继续使用劳拉替尼是一种选择。劳拉替尼可用于ALK G1202R或L1196M等耐药突变的NSCLC,但不能用于检测到复合耐药突变(即L1196M和G1202R)的NSCLC。继续一线治疗中使用的TKI是另一种选择,但有症状的全身进展和多处病变的患者除外。
对于有症状的全身疾病进展和多病灶患者,建议将化疗等全身性治疗方案作为额外的后续治疗方案。数据提示,不论PD-L1表达情况如何,PD-1/PD-L1抑制剂单药治疗ALK阳性NSCLC的疗效均较差。
确定性局部治疗在转移性ALK阳性NSCLC的治疗中有一定作用。对于初始转移部位有限的患者(寡转移;有限数量并非普遍定义,但临床试验中包括3-5个转移灶),如果在ALK TKI治疗前未给予确定性局部治疗(如SABR或手术),则应考虑在开始ALK TKI治疗(局部巩固治疗)后进行确定性局部治疗(如SABR或手术)作为巩固治疗。对于ALK TKI初始治疗后发生进展的某些患者,局部治疗也可能是适当的后续治疗选择。对于无症状进展或有症状的局限性全身进展(寡进展)的患者,应考虑局限性病变的确定性局部治疗(如SABR或手术);IGTA治疗(如冷冻疗法、微波消融、射频消融)也可能是某些患者的一种选择。对于CNS进展的患者,应根据大小、位置和水肿等因素,对有症状的病变考虑确定性局部治疗(如SRS伴或不伴手术切除),对有症状进展风险的无症状病变考虑SRS。
ROS1重排的NSCLC:
据估计,ROS1基因重排发生于约1%-2%的NSCLC患者。ROS1重排可导致ROS1激酶失调和不恰当的信号传导。虽然ROS1是一种独特的受体酪氨酸激酶,但它与ALK和胰岛素受体家族成员相似。几种(但不是全部)用于治疗ALK阳性转移性NSCLC的靶向治疗也被推荐用于治疗ROS1阳性转移性疾病(如塞瑞替尼,克唑替尼,劳拉替尼)。
临床数据:
克唑替尼是抑制ALK、ROS1和MET的第一代口服TKI。克唑替尼被批准用于治疗ROS1阳性和ALK阳性的转移性NSCLC成人患者。克唑替尼对ROS1重排患者有效,缓解率约为70%-80%,包括完全缓解。一项II期单组试验在127例接受过3线或更少全身性治疗的ROS1阳性东亚晚期NSCLC患者中评估了克唑替尼。客观缓解率为71.7%,其中17例完全缓解;中位缓解持续时间为19.7个月。中位PFS为15.9个月。
PROFILE 1001是一项I期研究,在50例有ROS1重排的晚期NSCLC患者中评估了克唑替尼的疗效。克唑替尼的客观缓解率为72%,其中3例完全缓解,33例部分缓解,中位缓解持续时间为17.6个月,中位PFS为19.2个月。PROFILE 1001的最新结果报告,克唑替尼治疗53例ROS1阳性晚期NSCLC患者的客观缓解率为72%,包括6例经证实的完全缓解。中位OS为51.4个月。未报告4级或更高级别的治疗相关AEs。
II期单组EUCROSS研究报告,克唑替尼治疗30例ROS1阳性晚期NSCLC患者的客观缓解率为70%,中位PFS为20个月。97%的患者发生了与治疗相关的AEs。一项基于欧洲数据的回顾性研究也评估了克唑替尼对ROS1重排的IV期肺腺癌患者(n=30,可评估)的疗效。5例患者完全缓解(总缓解率为80%;疾病控制率为86.7%)。中位PFS为9.1个月。许多患者(n=26)接受了培美曲塞治疗(单独或联合铂类,在克唑替尼之前或之后),缓解率为57.7%,中位PFS为7.2个月。
恩曲替尼是一种口服TKI,可抑制多种激酶(包括ROS1、ALK和TRK),并被FDA批准用于治疗ROS1阳性转移性NSCLC。恩曲替尼已在ROS1阳性转移性NSCLC患者的数项I期和II期试验中进行了评估(即II期STARTRK-2试验、I期STARTRK-1试验、I期ALKA-372-001试验)。这3项试验的汇总数据显示,在接受恩曲替尼一线治疗的53例ROS1阳性转移性NSCLC患者中,客观缓解率为77%(3例完全缓解)。在20例基线时有CNS转移的患者中,颅内总缓解率为55%(4例完全缓解,7例部分缓解)。在较大的ROS1人群(n=134)中,34%的患者发生了3-4级AEs。15例患者存在神经系统、心脏等严重AEs。恩曲替尼虽然具有比克唑替尼更好的CNS渗透性,但毒性更大。
瑞普替尼(Repotrectinib)是新一代ROS1、TRK和ALK TKI,已被FDA批准用于治疗局部晚期或转移性ROS1阳性NSCLC成人患者。I期和II期TRIDENT-1试验在71例既往未接受过ROS1 TKI的ROS1融合阳性NSCLC患者和56例既往接受过ROS1 TKI(克唑替尼、恩曲替尼或塞瑞替尼)但从未接受过化疗的ROS1融合阳性NSCLC患者中评估了瑞普替尼。在未接受过ROS1 TKI治疗的患者和接受过1种ROS1 TKI治疗的患者中,瑞普替尼经证实的客观缓解率分别为79%和38%。未接受ROS1 TKI治疗的患者的中位缓解持续时间为34.1个月,中位PFS为35.7个月。既往接受过1种ROS1 TKI且未接受过化疗的患者的中位缓解持续时间为14.8个月,中位PFS为9个月。对于基线时有可测量脑转移的患者,在既往未接受过ROS1 TKI治疗的患者中,瑞普替尼的颅内客观缓解率为89%(8/9),在既往接受过1次TKI治疗且未接受过化疗的患者中,为38%(5/13)。最常见的治疗相关不良反应为头晕、味觉障碍和感觉异常。
劳拉替尼是一种口服TKI,对ALK和ROS1均有活性,并且可穿透血脑屏障。一项I-II期试验在69例ROS1阳性转移性NSCLC患者中评估了劳拉替尼。许多患者(58%)既往接受过克唑替尼治疗,部分患者未接受过TKI治疗(TKI-naïve,30%)。克唑替尼组和TKI-naïve组的客观缓解率分别为35%(14/40)和62%(13/21)。既往接受过克唑替尼治疗的患者中50%(12/24)观察到颅内反应,而既往TKI-naïve的患者中64%(7/11)观察到颅内反应。7%的患者发生了与治疗相关的严重不良事件。
数据表明,塞瑞替尼,一种同时具有抗ALK和ROS1活性的口服TKI,也可以考虑作为伴有ROS1重排的NSCLC患者的治疗选择。
NCCN建议:
NCCN NSCLC专家组推荐恩曲替尼、克唑替尼或瑞普替尼作为ROS1阳性晚期或转移性NSCLC患者的首选一线治疗方案,而塞瑞替尼被认为是“其他推荐”的一线治疗方案。所有药物均适用于体能状态0-4分的患者;然而,恩曲替尼或瑞普替尼可能更适合脑转移患者。(这些建议见图11和12)

图11

图12
在疾病进展时,应考虑通过广泛的分子分析进行基于血浆或组织的检测,以确定基因组耐药机制。如果血浆检测结果为阴性,专家组强烈建议使用再次活检材料进行基于组织的检测。
对于恩曲替尼、克唑替尼、瑞普替尼或塞瑞替尼治疗后无症状进展的患者,NCCN NSCLC专家组推荐瑞普替尼(如果之前未给药)或劳拉替尼作为后续治疗选择。对于CNS进展的患者,推荐使用恩曲替尼(如果之前接受过克唑替尼或塞瑞替尼治疗)、瑞普替尼(如果之前接受过克唑替尼、塞瑞替尼或恩曲替尼治疗)或劳拉替尼。对于有症状的全身进展伴多系统病变,推荐使用瑞普替尼(如果之前未给药)或劳拉替尼作为靶向治疗方案。在这种情况下也可考虑全身性治疗(如化疗联合或不联合免疫治疗)。数据表明,ICI单药治疗对有ROS1变异的NSCLC疗效较差。
恩曲替尼、克唑替尼、瑞普替尼或塞瑞替尼也可用于某些疾病进展的患者;对于有症状的全身进展和多发病灶或脑转移的患者,不建议继续接受这些治疗。
确定性局部治疗在ROS1阳性转移性NSCLC的治疗中有一定作用。对于初始转移部位有限的患者(寡转移;有限数量并非普遍定义,但临床试验中包括3-5个转移灶),如果在ROS1 TKI治疗前未给予确定性局部治疗(如SABR或手术),则应考虑在开始ROS1 TKI治疗(局部巩固治疗)后进行确定性局部治疗(如SABR或手术)作为巩固治疗。对于ROS1 TKI初始治疗后发生进展的某些患者,局部治疗也可能是适当的后续治疗选择。对于无症状或有症状的局限性全身进展(寡进展)患者,应考虑确定性局部治疗(如SABR或手术)。冷冻疗法、微波消融或射频消融等IGTA治疗也可作为特定患者的一种选择。对于CNS进展的患者,应考虑对有症状的病变进行确定性局部治疗(如SRS伴或不伴手术切除),并根据大小、位置和水肿等因素,对有症状进展风险的无症状病变考虑SRS。
BRAF V600E突变的NSCLC:
BRAF V600E突变发生于1%-2%的肺腺癌患者。当考虑到所有类型的肿瘤时,BRAF V600E突变是最常见的BRAF点突变。少见的BRAF突变包括V600K和V600D。BRAF基因编码BRAF,一种丝氨酸/苏氨酸激酶;BRAF的激活突变可通过MAP/ERK通路导致不受调节的信号传导。
临床数据:
达拉非尼和康奈非尼都是口服BRAF激酶抑制剂。达拉非尼联合MEK1/2抑制剂曲美替尼已被FDA批准用于治疗有BRAF V600E突变的转移性NSCLC。康奈非尼联合MEK1/2抑制剂比美替尼已被美国FDA批准用于治疗有BRAF V600E突变的转移性NSCLC。
一项II期试验在36例有BRAF V600E突变的转移性NSCLC患者中评估了达拉非尼联合曲美替尼一线治疗。总缓解率为63.9%,2例患者完全缓解,中位PFS为10.8个月。许多患者(69%)有1个或多个3级或4级AEs。严重AEs包括ALT升高、AST升高、发热和射血分数降低。一项最新分析报告,接受达拉非尼联合曲美替尼治疗的患者的中位OS为17.3个。5年后,OS率为22%。
该试验还在57例有BRAF V600E突变且化疗后疾病进展的晚期NSCLC患者中评估了达拉非尼+曲美替尼方案作为后续治疗的疗效。总缓解率为68.4%,中位PFS为10.2个月。56%的患者发生了严重AEs,包括发热、贫血、意识错乱、咯血、高钙血症和皮肤鳞状细胞癌。3-4级AEs包括中性粒细胞减少、低钠血症和贫血。一项最新分析报告,中位OS为18.2个月。5年后,OS率为19%。
一项II期、开放标签、单组研究在BRAF V600E阳性转移性NSCLC患者的一线治疗和后续治疗中评估了康奈非尼联合比美替尼。未经治疗的患者的客观缓解率为75%,既往接受过治疗的患者为46%。未经治疗患者的中位PFS无法估计,既往接受过治疗的患者中位PFS为9.3个月。最常见的治疗相关不良反应为恶心、腹泻和疲劳。报道了1例5级治疗相关AE(颅内出血)。
数据提示,BRAF抑制剂(如维莫非尼)单药治疗也可用于治疗BRAF V600E阳性的转移性NSCLC患者。回顾性研究的结果表明,有BRAF突变的晚期NSCLC患者也可能从PD-1/PD-L1抑制剂中获益。因此,可以考虑使用基于ICI的方案进行一线治疗,特别是对于疾病负荷较轻和/或PD-L1水平高的患者。
NCCN 建议:
NCCN NSCLC专家组建议,将达拉非尼+曲美替尼或康奈非尼+比美替尼作为BRAF V600E突变阳性晚期或转移性NSCLC患者的首选一线治疗方案(图13)。如果有BRAF V600E突变的患者既往未接受过BRAF抑制剂治疗,专家组还建议将达拉非尼+曲美替尼或康奈非尼+比美替尼作为后续治疗方案。对于不耐受达拉非尼联合曲美替尼的患者可考虑达拉非尼或维莫非尼单药治疗。这些方案均适用于体能状态0-4分的患者。

图13
其他一线治疗方案中列出的全身性治疗方案(如化疗联合或不联合免疫治疗),被指定为“其他推荐”方案。对于接受包括BRAF抑制剂的一线治疗后发生疾病进展的患者,这些治疗方案也可作为后续治疗方案。
NTRK基因融合的NSCLC:
NTRK1/2/3基因融合编码的TRK融合蛋白是多种实体肿瘤(包括肺癌、唾液腺癌、甲状腺癌和肉瘤)的致癌驱动因子。据估计,NTRK1/2/3融合发生于0.2%的NSCLC患者,并且通常不与EGFR、ALK或ROS1等其他致癌驱动基因重叠。
临床数据:
恩曲替尼和拉罗替尼是口服TRK抑制剂,两种药物均获得FDA加速批准,用于治疗有NTRK基因融合的实体瘤患者。恩曲替尼也被批准用于治疗ROS1阳性转移性NSCLC。
多项I期和II期临床试验已对NTRK基因融合阳性转移性NSCLC患者进行了恩曲替尼评估(II期STARTRK-2试验、I期STARTRK-1试验和I期ALKA-372-001试验)。来自这3项试验的10例NTRK基因融合阳性NSCLC患者的汇总数据显示,恩曲替尼产生了70%(7/10)的总缓解率。22例NTRK阳性局部晚期或转移性NSCLC患者的最新数据发现,客观缓解率为64.5%;16.1%的患者达到完全缓解。在基线时有CNS转移的15例患者中,颅内客观缓解率为60%。治疗相关不良反应多为1-2级。
一项对55例NTRK基因融合阳性实体瘤患者进行的研究表明,拉罗替尼的总缓解率(经独立审核)为75%。在对15例NTRK融合阳性肺癌患者进行的分析中,研究者评估的客观缓解率为73%。1例患者完全缓解,10例部分缓解。中位OS为40.7个月,中位PFS为35.4个月。在基线时有CNS转移的患者中,客观缓解率为63%。报道的不良反应多为1-2级。
NCCN建议:
NCCN NSCLC专家组推荐拉罗替尼或恩曲替尼作为NTRK1/2/3基因融合阳性晚期或转移性NSCLC患者(体能状态0-4)的首选一线治疗方案(图14)。对于NTRK1/2/3基因融合阳性的转移性NSCLC,如果拉罗替尼或恩曲替尼既往未作为一线治疗,上述两种方案均可作为后续治疗选择。

图14
指南中的其他全身性治疗(如化疗联合或不联合免疫治疗)被归类为一线治疗方案,在某些情况下可能对NTRK阳性晚期或转移性NSCLC有用。对于拉罗替尼或恩曲替尼治疗后疾病进展的患者,也推荐这些治疗方案作为后续治疗方案。数据表明,ICI单药治疗对NTRK突变的NSCLC可能疗效较差。
MET外显子14跳跃突变的NSCLC:
MET外显子14(METex14)跳跃突变发生于3%- 4%的腺癌NSCLC患者和1%-2%的其他NSCLC组织学类型患者。METex14跳跃突变导致MET受体酪氨酸激酶失调和不正常的信号传导。这种类型突变的存在与口服MET TKIs的反应性相关。NCCN指南建议将METex14跳跃突变检测作为广泛分子分析的一部分,因为FDA批准了针对此生物标志物的靶向疗法。
相反,在NCCN指南中,高水平MET扩增被指定为一种新兴的生物标志物,因为使用靶向这一生物标志物的治疗药物证据较少。此外,FDA尚未批准任何疗法用于治疗MET扩增的转移性NSCLC。
临床数据:
卡马替尼和特泊替尼是选择性抑制MET激酶的口服TKI,两种药物均被FDA批准用于治疗肿瘤有MET ex14跳跃突变的转移性NSCLC成人患者。
GEOMETRY是一项II期研究,在有不同MET基因变异的患者队列(包括有METex14跳跃突变的患者)中评估了卡马替尼。患者患IIIB期或IV期NSCLC,并且EGFR和ALK基因变异为野生型。GEOMETRY的最新数据表明,在28例携带METex14跳跃突变的患者中,卡马替尼一线治疗的总缓解率为68%。一线治疗的中位PFS为12.4个月。在69例携带METex14跳跃突变的患者中,后续卡马替尼治疗的总缓解率为41%。后续治疗的中位PFS为5.4个月。GEOMETRY的数据还提示,卡马替尼对脑转移患者有效。在脑转移患者中,据报告54%的患者接受卡马替尼治疗后达到缓解。4例患者脑部完全缓解。然而,在疾病缓解的患者中,有43%既往接受过放疗(RT)。在所有队列中,METex14跳跃突变患者的常见AEs包括外周水肿、恶心和呕吐,但这些事件大多为1-2级。有1例患者发生了与治疗相关的死亡。
II期研究VISION在METex14跳跃突变患者中评估了特泊替尼。患者主要为IV期NSCLC,并且EGFR和ALK基因变异为野生型(阴性)。特泊替尼的缓解率为46%。联合活检组(组织活检+血浆ctDNA)的PFS为8.5个月。28%接受特泊替尼治疗的患者发生了3级或更高级别AEs,如外周水肿。11%的患者因外周水肿、胸腔积液或呼吸困难而不得不永久性停用特泊替尼。1例患者发生治疗相关死亡。对VISION进行的18个月随访分析证实了特泊替尼对MET ex14阳性晚期/转移性NSCLC患者的疗效。在初治患者中,特泊替尼的客观缓解率为57.3%,中位缓解持续时间为46.6个月。在既往接受过治疗的患者中,客观缓解率为45%,中位缓解持续时间为12.6个月。
克唑替尼是一种可抑制多种激酶(包括ALK、ROS1和MET)的口服TKI,数据提示,对于有METex14跳跃突变的晚期NSCLC患者,克唑替尼也是一种可行的治疗方案。
NCCN建议:
NCCN NSCLC专家组推荐卡马替尼、特泊替尼或克唑替尼作为有METex14跳跃突变的晚期或转移性NSCLC患者的一线治疗选择(图15)。如果患者既往未接受过卡马替尼、特泊替尼或克唑替尼治疗,也建议将这些治疗方案作为后续治疗方案。卡马替尼和特泊替尼被列为首选,克唑替尼被认为在某些情况下有用。专家组指出,不建议在疾病进展时在具有类似作用机制的药物之间切换。

图15
指南中列出的其他全身性治疗方案(如化疗联合或不联合免疫治疗)在某些情况下可用于一线治疗。对于接受卡马替尼、特泊替尼或克唑替尼治疗后发生疾病进展的患者,也建议将这些治疗方案作为后续治疗方案。数据表明,对于有MET变异的NSCLC,ICI单药治疗的效果可能较差。
RET重排的NSCLC:
RET重排见于约1%-2%的NSCLC患者,且在腺癌组织学患者中更为常见。RET与其他基因(包括KIF5B和CCDC6)之间可能发生重排,从而导致RET激酶的过表达和失调以及不正常的信号传导。
临床数据:
塞普替尼(selpercatinib)和普拉替尼(pralsetinib)是抑制RET的口服TKI,并且均被FDA批准用于治疗有RET基因融合的转移性NSCLC。
I–II期研究Libretto-001在有RET重排的NSCLC患者中评估了塞普替尼。该试验的最新结果表明,塞普替尼一线治疗的客观缓解率为85%。塞普替尼二线治疗的客观缓解率为64%;中位PFS为18.4个月。在脑转移患者中,91%(10/11)的患者接受塞普替尼治疗后达到缓解。塞普替尼的常见3级或更高级别AEs包括高血压、肝酶水平升高、低钠血症和淋巴细胞减少。
随机III期试验Libretto-431在212例有RET基因融合的晚期NSCLC患者中评估了塞普替尼与对照(铂类化疗联用或不联用帕博利珠单抗)作为一线治疗的效果。根据期中分析,塞普替尼组的中位PFS超过对照治疗组(24.8个月 vs 11.2个月;HR,0.46;P<.001)。至CNS进展时间的HR为0.28。在基线时有脑转移的患者中,塞普替尼组达到颅内缓解的患者比例高于对照组(82% vs 58%)。
ARROW是一项I-II期研究,在233例有RET重排的转移性NSCLC患者中评估了普拉替尼。普拉替尼一线治疗的总缓解率为70%,3例患者(11%)达到完全缓解。普拉替尼二线治疗的总缓解率为61%(53/87),5例患者(6%)达到完全缓解。在有可测量脑转移的9例患者中,56%的患者经普拉替尼治疗后达到缓解。3例患者达到颅内完全缓解。普拉替尼的3级或更高级别AEs包括贫血、中性粒细胞减少和高血压。普拉替尼的常见AEs包括天冬氨酸转移酶水平升高、丙氨酸转氨酶水平升高、贫血、高血压、便秘和中性粒细胞减少。ARROW试验的最新数据表明,在初治患者和既往接受过铂类化疗的患者中,普拉替尼治疗的总缓解率分别为72%和59%。10例颅内转移患者(均为既往接受过全身治疗的患者)的颅内缓解率为70%。
卡博替尼是一种口服激酶抑制剂,对多种受体酪氨酸激酶(包括RET、MET、VEGFR2等)有活性,数据提示卡博替尼是RET阳性转移性NSCLC患者的另一种可行治疗方案。
NCCN建议:
NCCN NSCLC专家组推荐塞普替尼或普拉替尼作为有RET重排的晚期或转移性NSCLC患者的首选一线治疗方案。专家组推荐卡博替尼作为一线治疗方案,在某些情况下可能有用(图16)。所有药物都适用于体能状态0-4的患者。对于RET重排阳性转移性NSCLC患者,如果塞普替尼、普拉替尼或卡博替尼既往未作为一线治疗,则建议将这些药物作为后续治疗方案。专家组指出,不建议在疾病进展时在具有类似作用机制的药物之间切换。

图16
指南中的其他全身治疗(如化疗联合或不联合免疫治疗)被归类为RET阳性晚期或转移性NSCLC的“其他推荐”一线治疗方案。对于塞普替尼、普拉替尼或卡博替尼治疗后疾病进展的患者,也建议将这些药物作为后续治疗方案。数据表明,ICI单药治疗对有RET重排的NSCLC可能疗效较差。
ERBB2(HER2)突变的NSCLC:
ERBB2编码HER2,HER2是一种在正常上皮细胞表面发现的受体酪氨酸激酶,在多种人类恶性肿瘤中经常过度表达或突变。约3%的晚期NSCLC(腺癌)有ERBB2(HER2)突变。有一些数据库(如oncoKB.org)可以评估特定的ERBB2(HER2)突变是否具有致癌性或可能具有致癌性。
临床数据:
FDA加速批准了德曲妥珠单抗用于治疗有激活性ERBB2(HER2)突变,并且既往接受过全身性治疗的不可切除或转移性NSCLC成人患者。德曲妥珠单抗是人源化单克隆抗体-药物偶联物,由靶向HER2的曲妥珠单抗与拓扑异构酶I抑制剂deruxtecan连接构成。该药物在被癌细胞中的肽裂解之前保持稳定。
DESTINY-Lung01是一项II期研究,在ERBB2突变(非ERBB2扩增)的91例转移性非鳞状NSCLC患者中评估了德曲妥珠单抗。大多数患者存在ERBB2(HER2)第20外显子插入突变(86%);66%为女性,57%从未吸烟,36%在基线时有CNS转移,且均为非鳞状NSCLC。德曲妥珠单抗治疗的客观缓解率为55%。大多数患者既往接受过治疗。中位OS为17.8个月。46%的患者发生了3级或更高级别的不良反应,包括中性粒细胞减少(19%)。2例患者死于药物相关性间质性肺疾病。
数据显示,恩美曲妥珠单抗(也称为T-DM1)是一种由曲妥珠单抗和微管抑制剂emtansine组成的人源化抗体-药物偶联物,对有ERBB2(HER2)突变的转移性或复发性NSCLC患者也有效。
NCCN建议:
NCCN NSCLC专家组推荐使用指南中列出的全身治疗方案(如化疗联合或不联合免疫治疗),用于有ERBB2(HER2)突变的晚期或转移性NSCLC的一线治疗。数据表明,ICI单药治疗对有ERBB2(HER2)突变的NSCLC可能疗效较差(图17)。
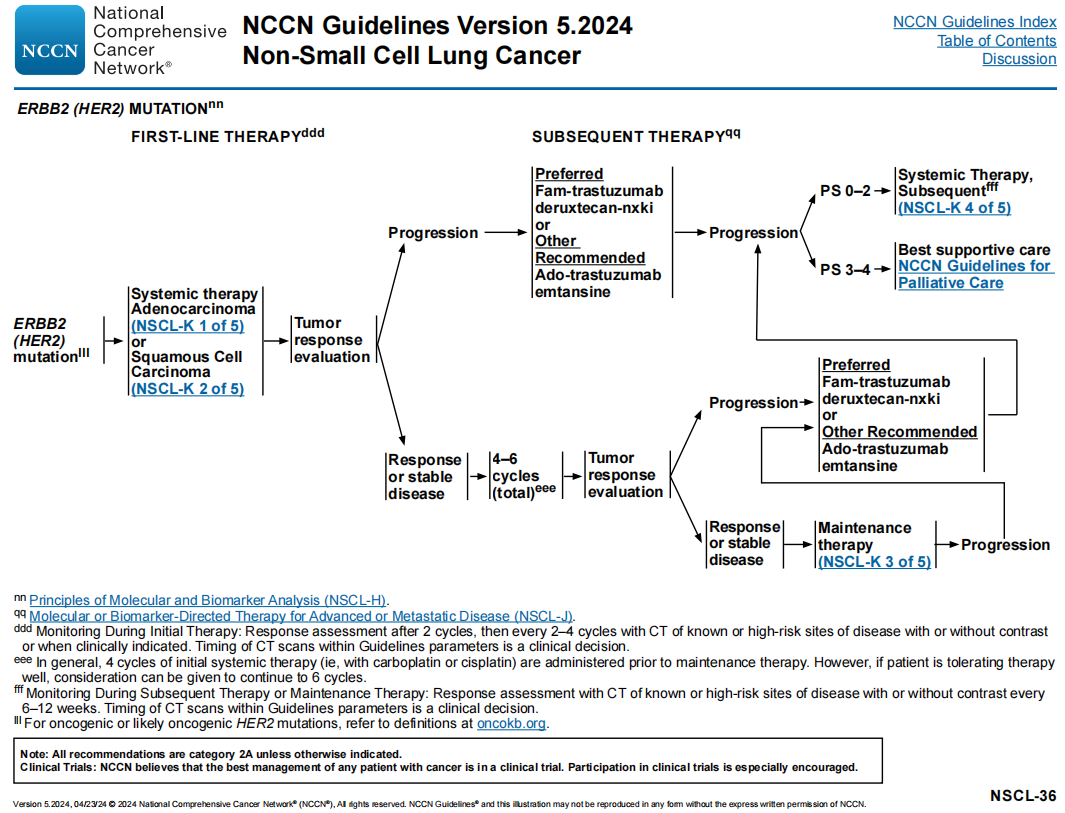
图17
疾病进展后,德曲妥珠单抗被推荐为首选后续治疗方案,而恩美曲妥珠单抗被归类为“其他推荐”方案。专家组指出,不建议在疾病进展时在具有类似作用机制的药物之间切换。
分子检测可指导使用适当的靶向疗法,这是晚期或转移性NSCLC患者治疗的重要组成部分。

作者:苏州绘真医学
版权声明:
本网站所有注明“来源:梅斯医学”或“来源:MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明“来源:梅斯医学”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言









#非小细胞肺癌# #靶向治疗# #基因检测#
7