刚刚!CDE发布中国新药注册临床试验进展年度报告(2022年)
2023-09-10 药研网 药研网
9月7日,CDE官方公告显示,国家药监局药审中心发布《中国新药注册临床试验进展年度报告(2022年)》。
9月7日,CDE官方公告显示,国家药监局药审中心发布《中国新药注册临床试验进展年度报告(2022年)》。
为全面掌握中国新药注册临床试验进展,运用信息化手段提升药品监管能力,及时对外公开临床试验进展信息,为新药研发、资源配置和药品审评审批提供参考,药审中心根据药物临床试验登记与信息公示平台的新药临床试验登记信息,对2022年中国新药注册临床试验现状进行了全面汇总和分析,编制了《中国新药注册临床试验进展年度报告(2022年)》。
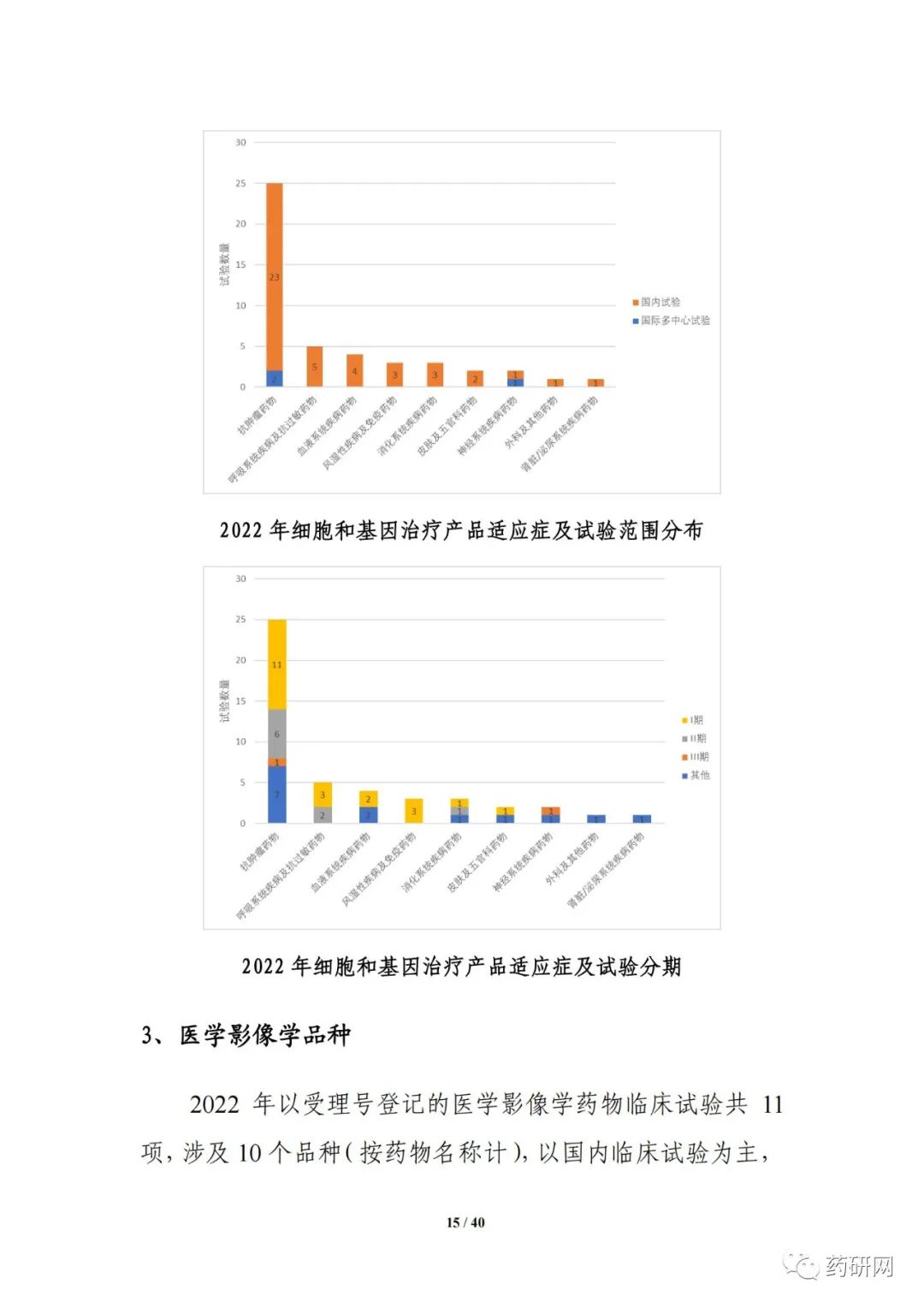
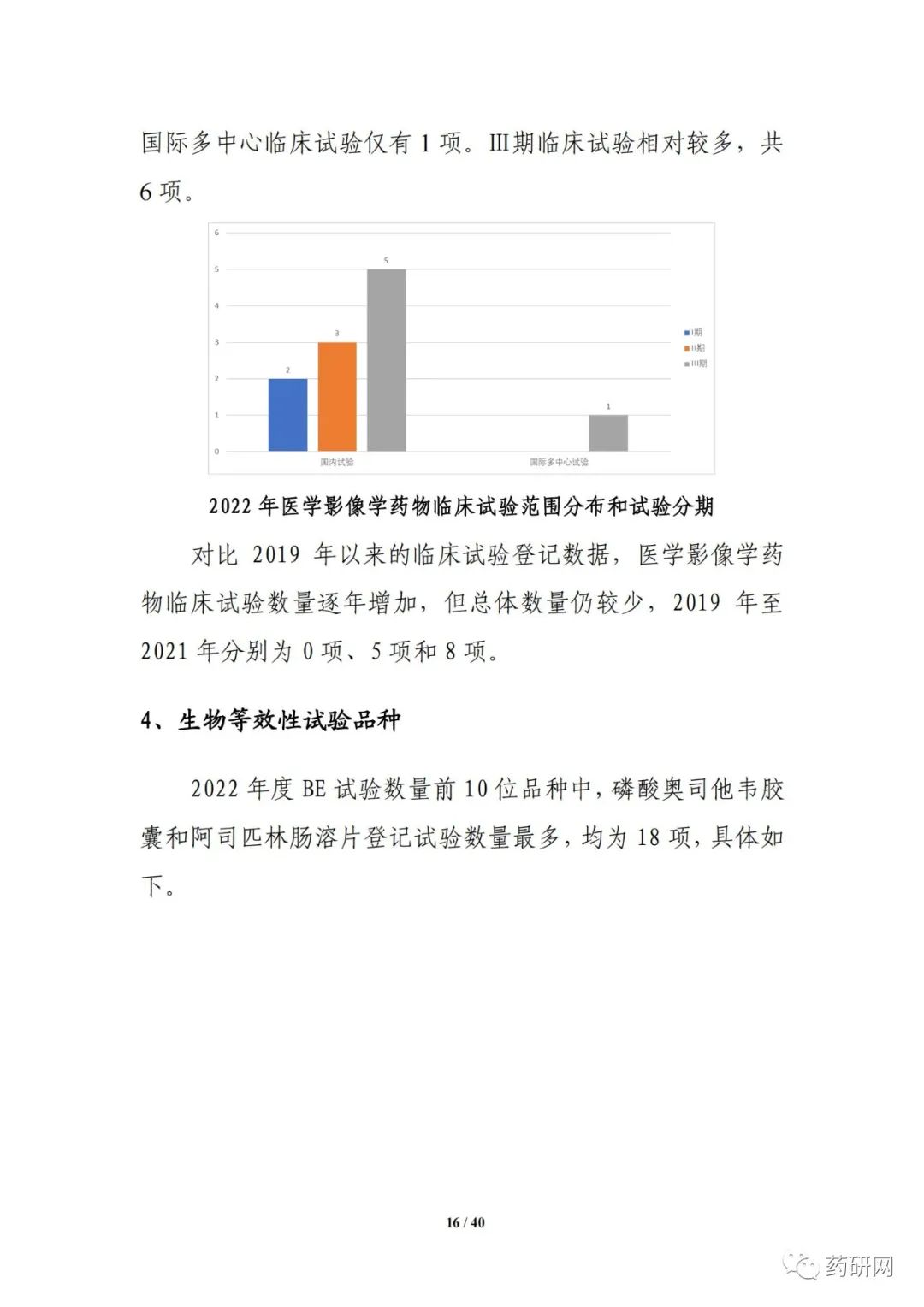
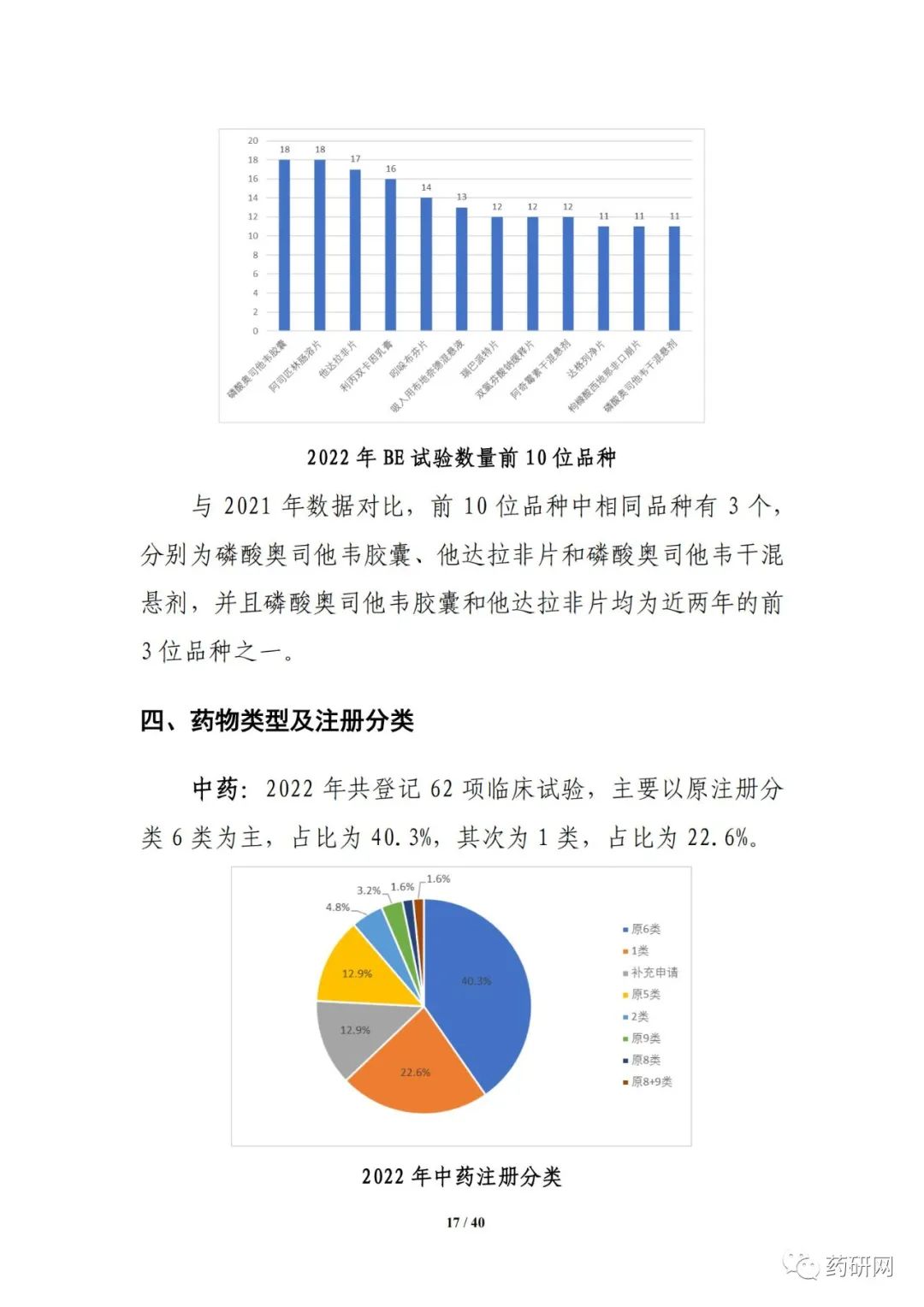
本年度报告根据2022年度登记的药物临床试验信息,从药物类型、品种、适应症、申办者类型、注册分类、试验分类、试验分期、特殊人群试验、临床试验单位、临床试验首次登记用时、启动用时、数据监查委员会(DMC)、试验完成情况等角度对临床试验的总体趋势、主要特点等进行汇总分析。此外,增加了细胞和基因治疗品种、医学影像学品种的分析、申请人首次提交临床试验登记的用时分析,以及2022年度获批上市创新药的临床试验分析等。
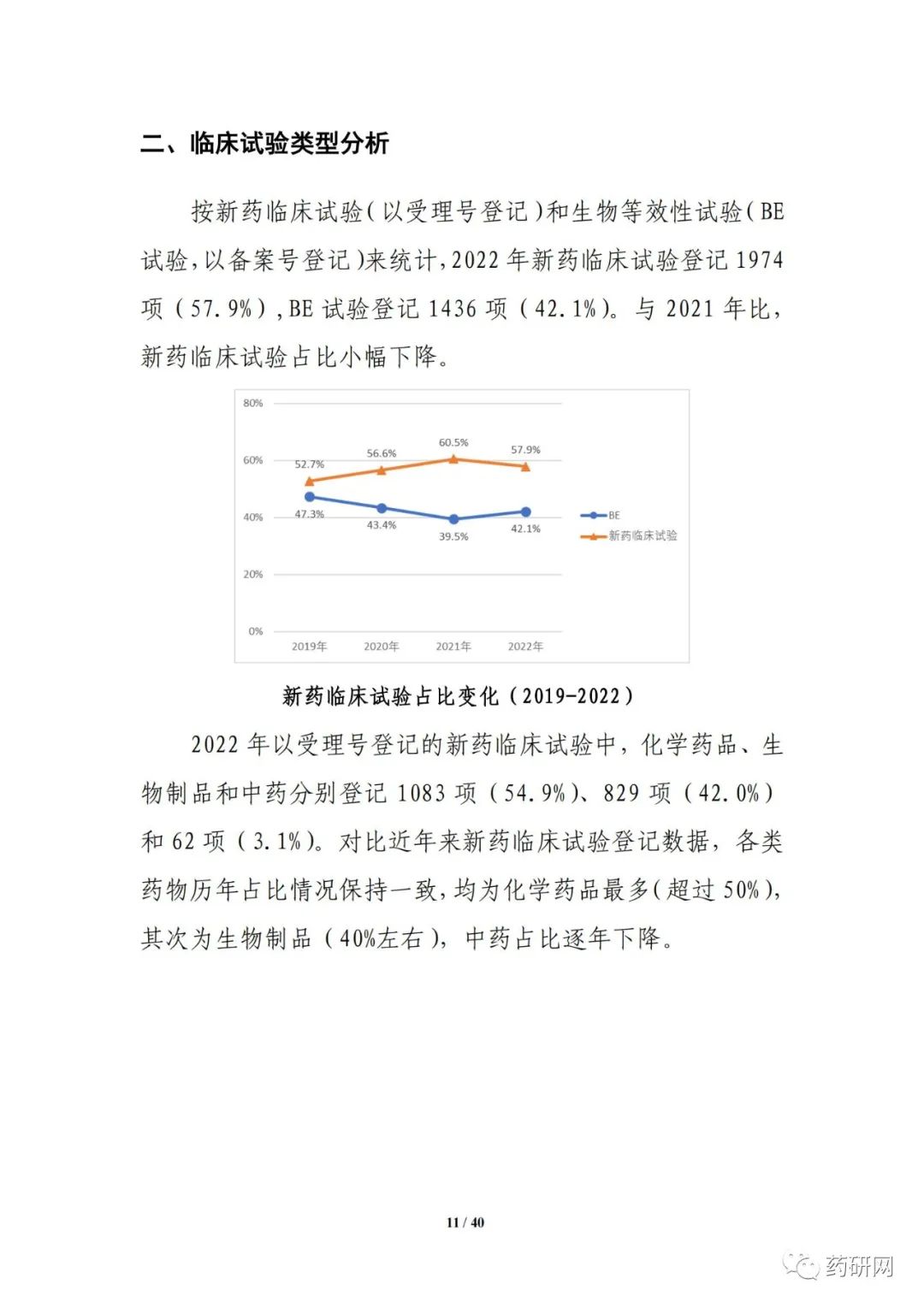
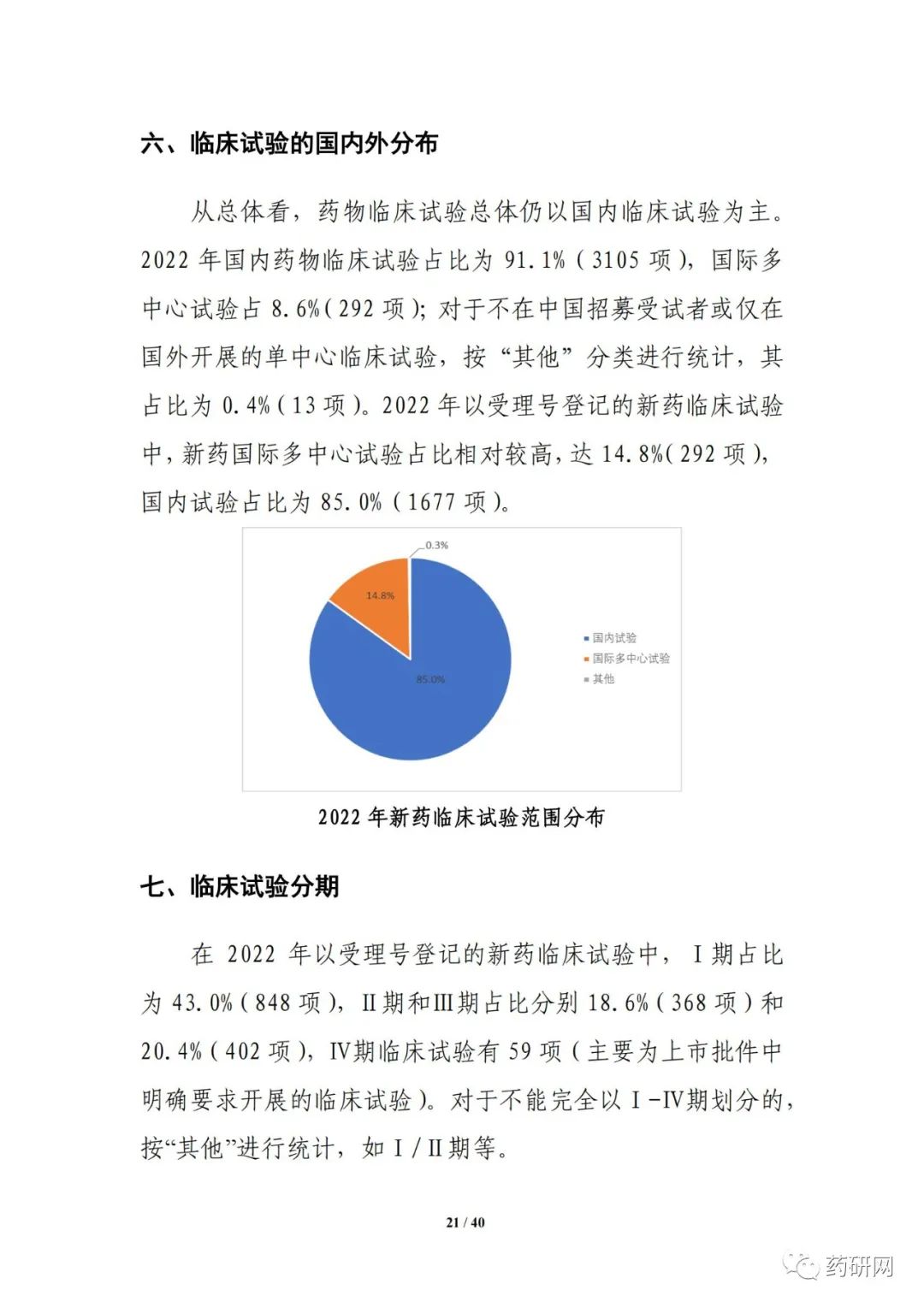
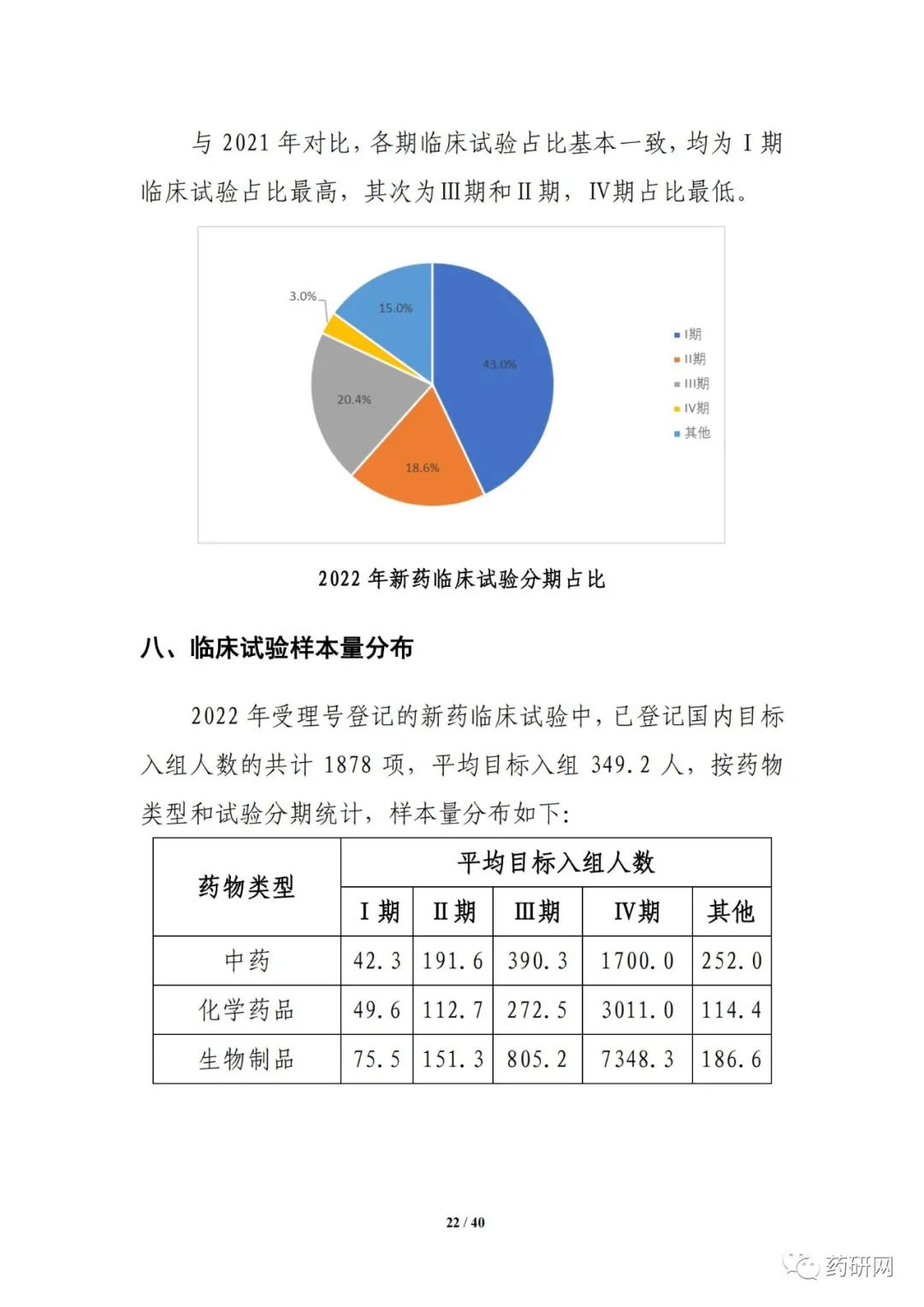
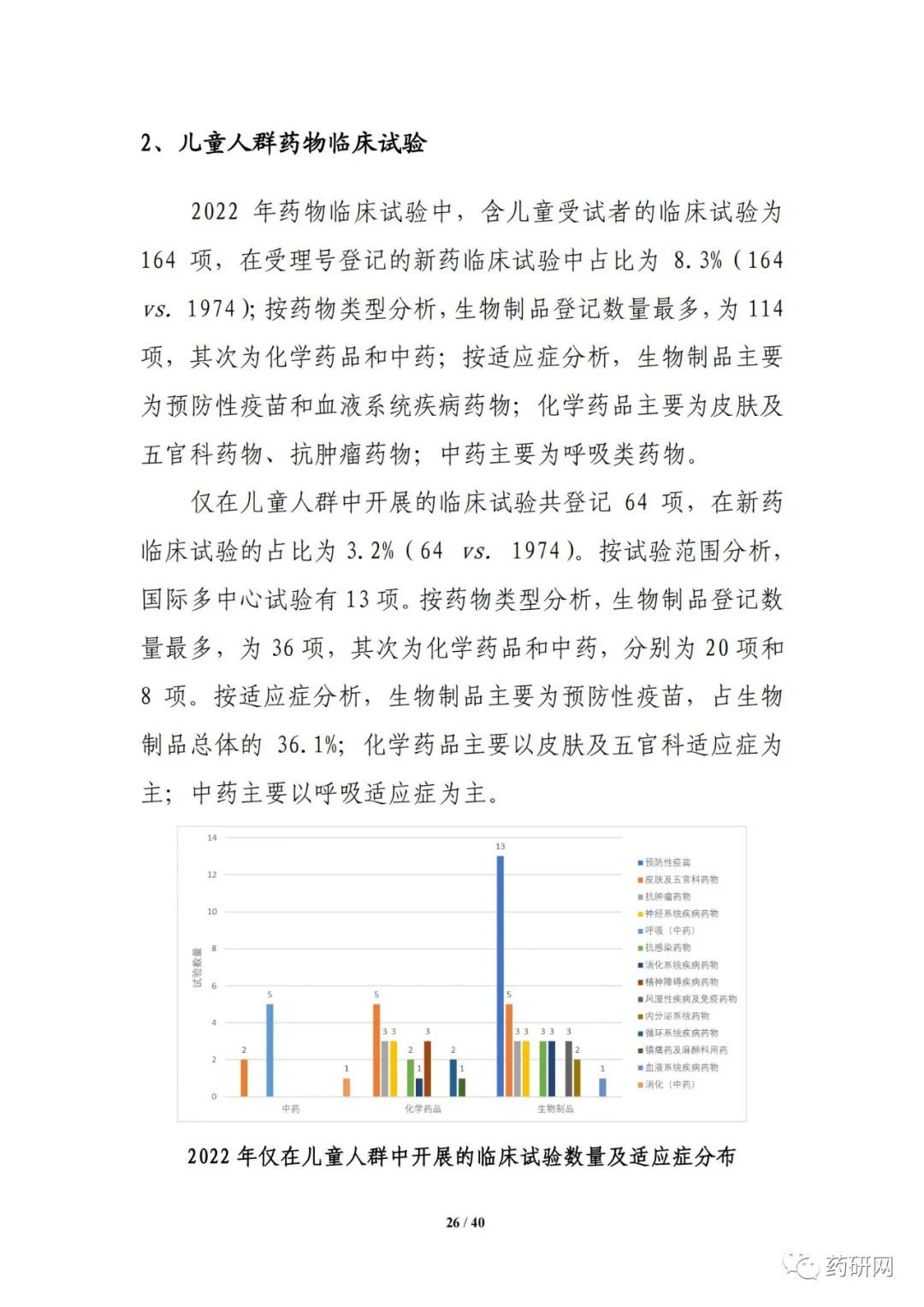
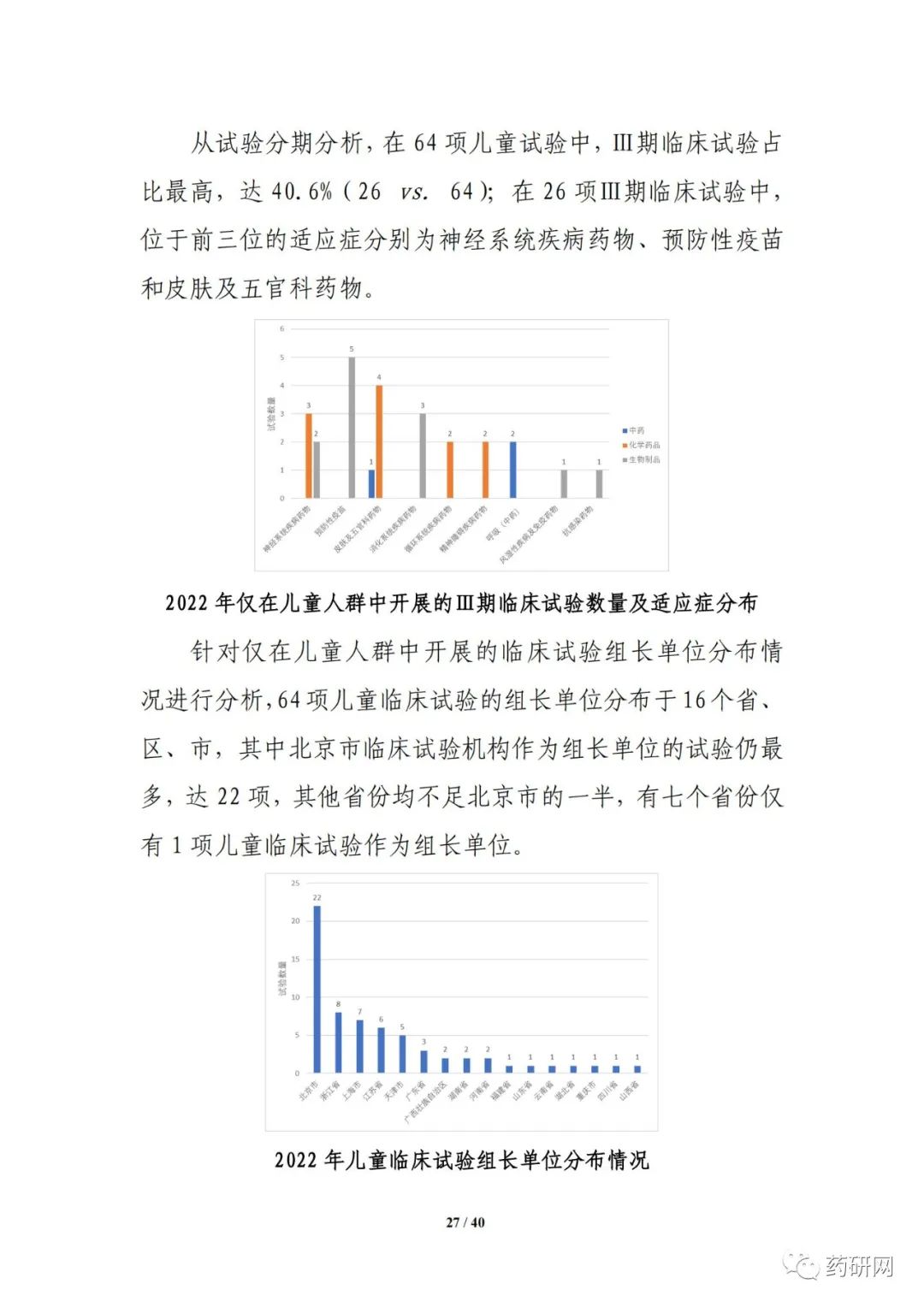
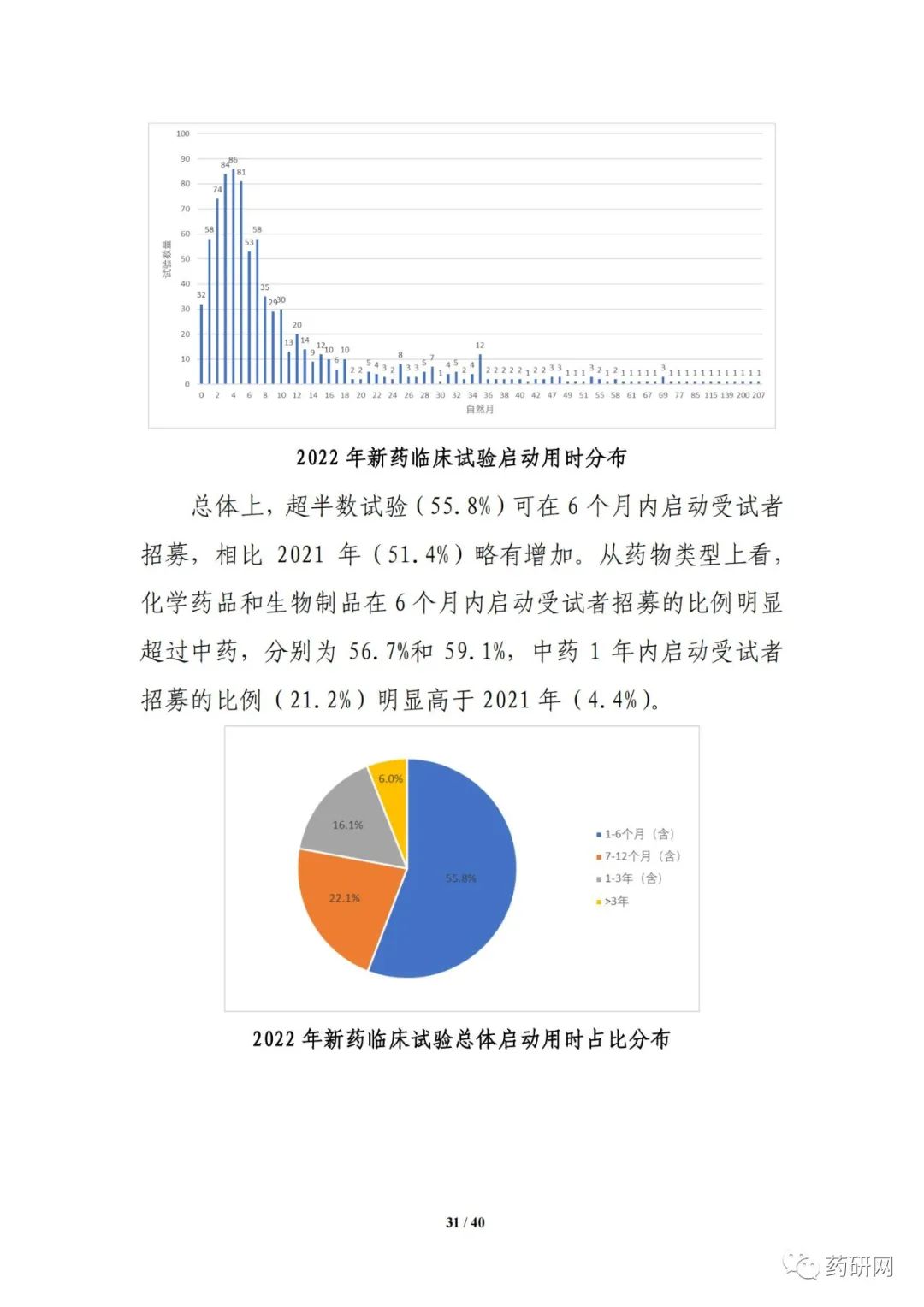
新药注册临床试验数量方面,2022年临床试验登记总量达3410余项,为历年最高,其中,新药临床试验数量1974项,较2021年小幅下降(2033项 vs 1974项)。其中,1期占比仍然最高,达43%;与2021年相比,儿童人群试验(64项 vs 61项),罕见病药物临床试验(68项 vs 43项)均有增加。
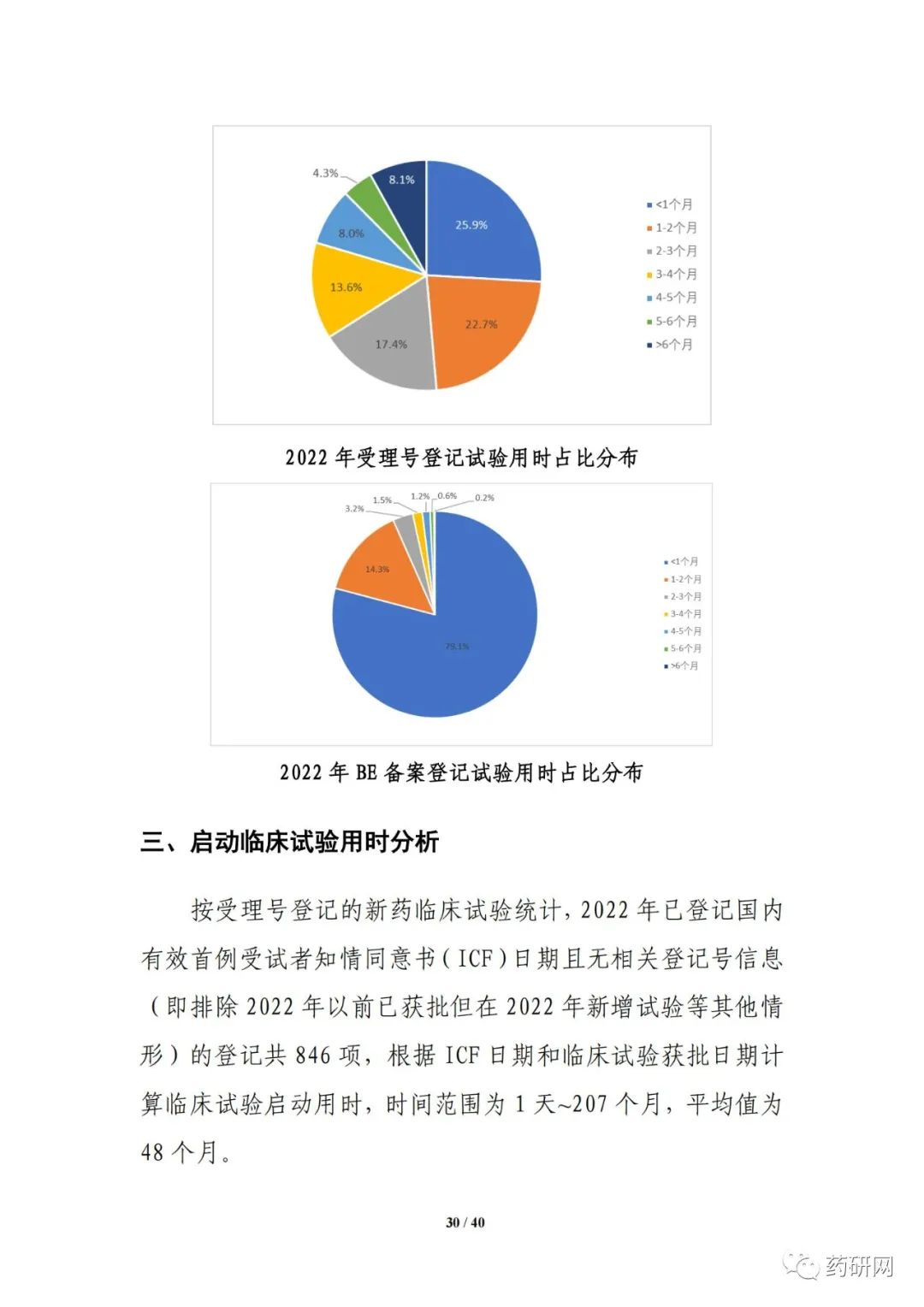
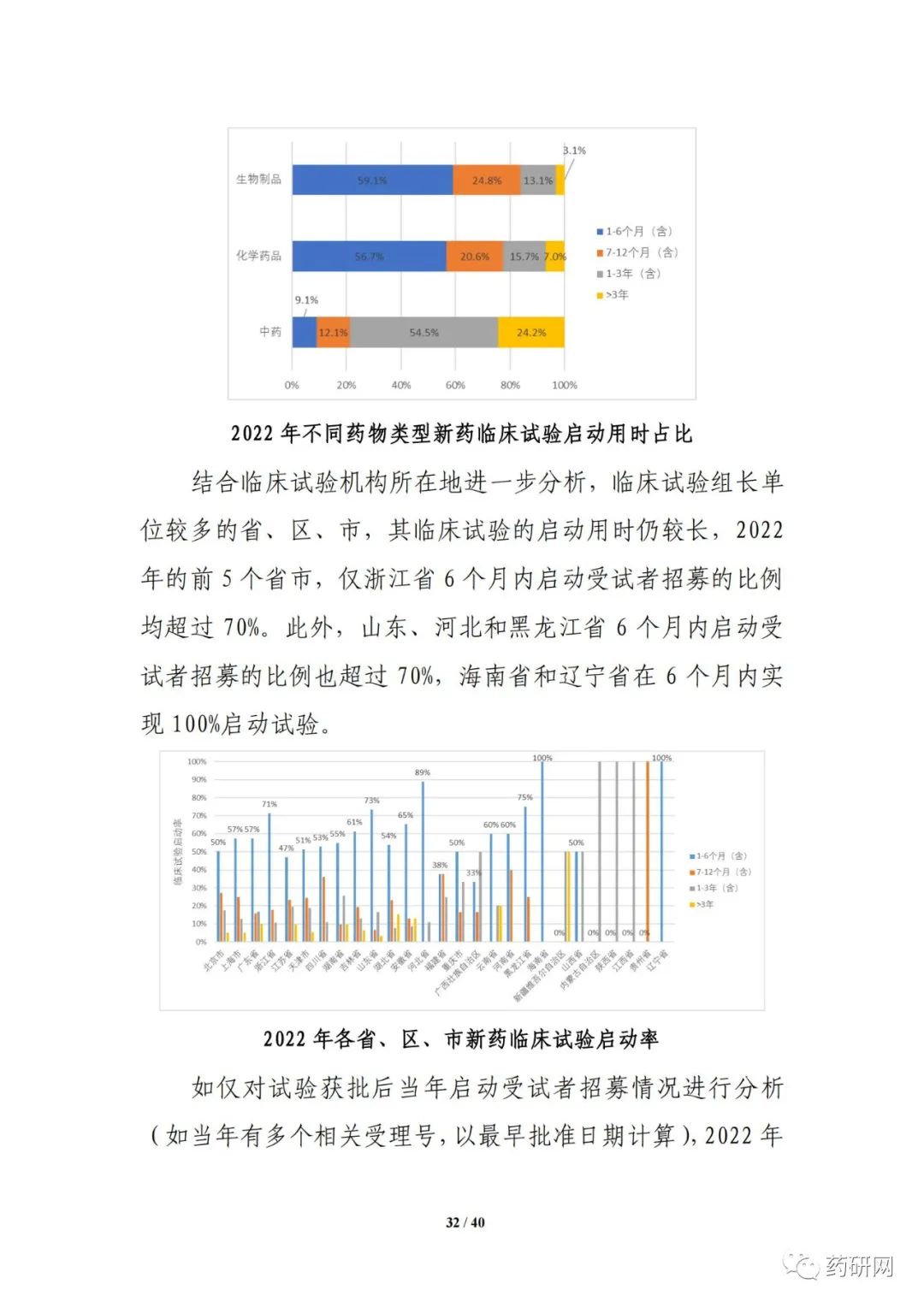
临床试验实施效率分析显示,2022年,新药临床试验可在6 个月内启动受试者招募的比例进一步提高,总体占比达55.8%;与2021年相比,2022 年临床试验获批后当年启动受试者招募的用时进一步缩短(3.3个月 vs 3.8个月),6个月内启动招募的比例也进一步提高(91.5% vs 85.7%)。
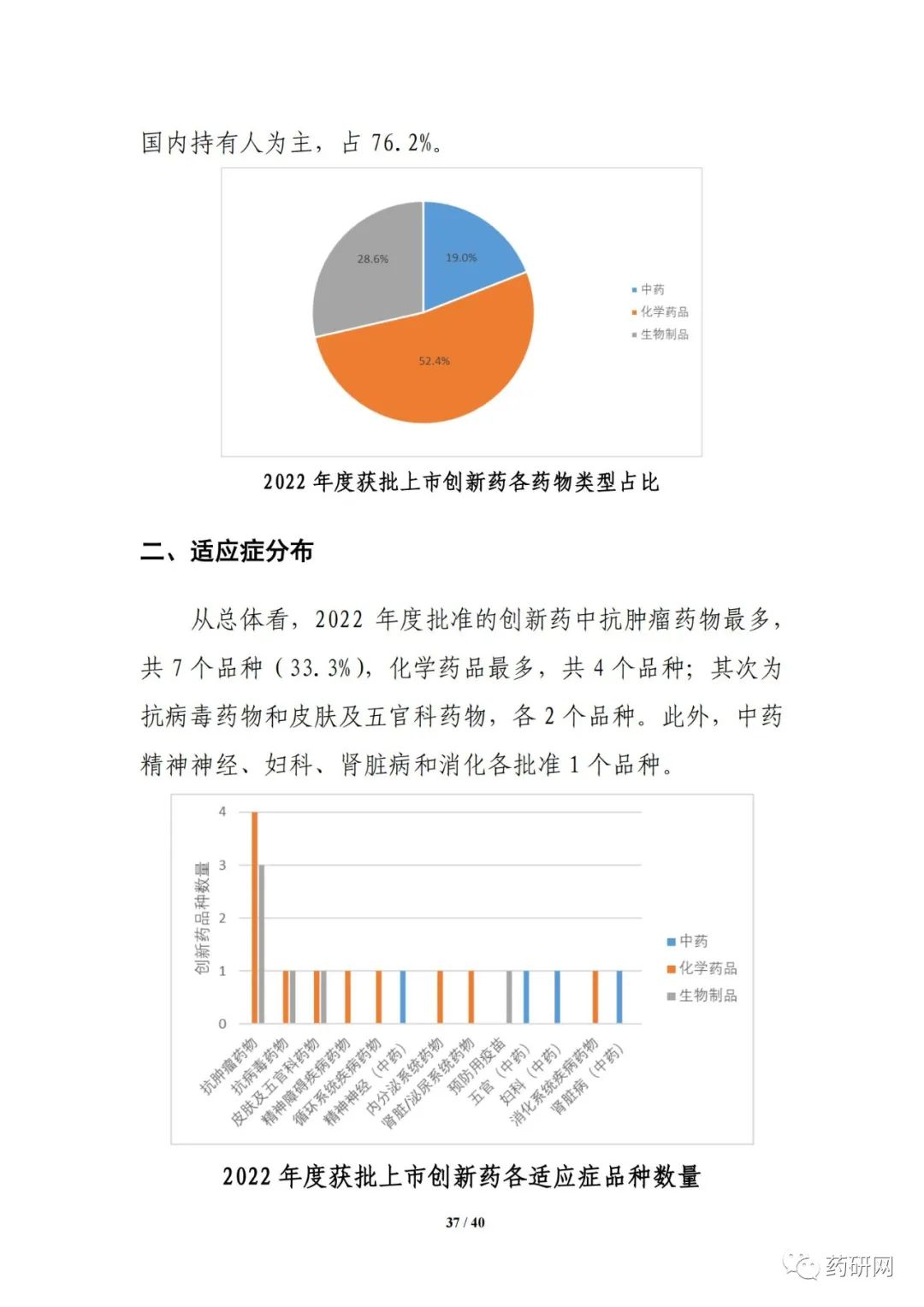
2022年度共批准21个创新药,(不含中药提取物和新增适应症品种),以国内上市许可持有人为主,占比达76.2%。化学药品占比较高(52.4%),共有11个品种。创新药中抗肿瘤药物最多,中药精神神经、妇科、肾脏病和消化各批准1个品种。
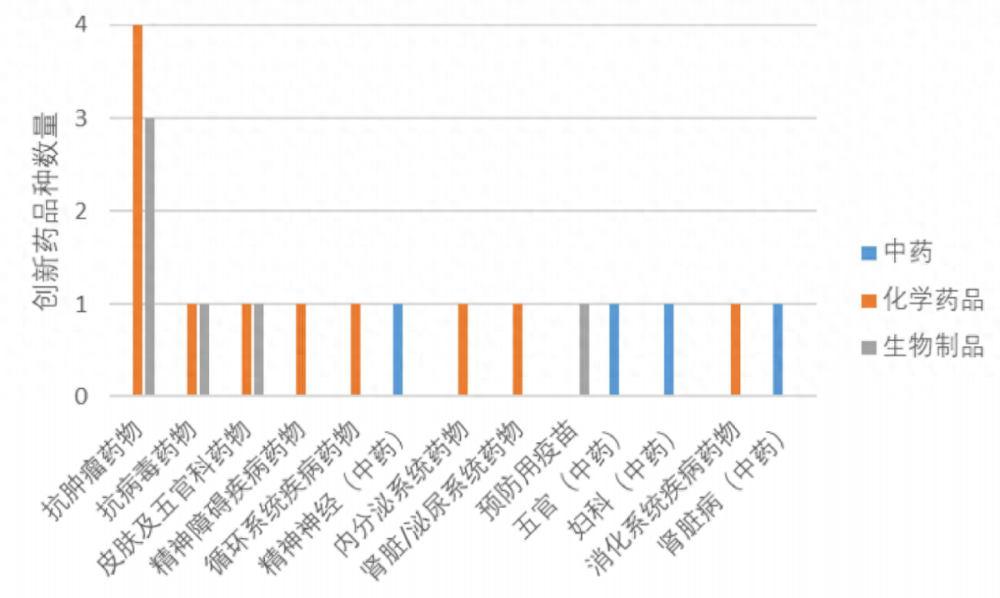 2022年度获批上市创新药各适应症品种数量。报告截图
2022年度获批上市创新药各适应症品种数量。报告截图
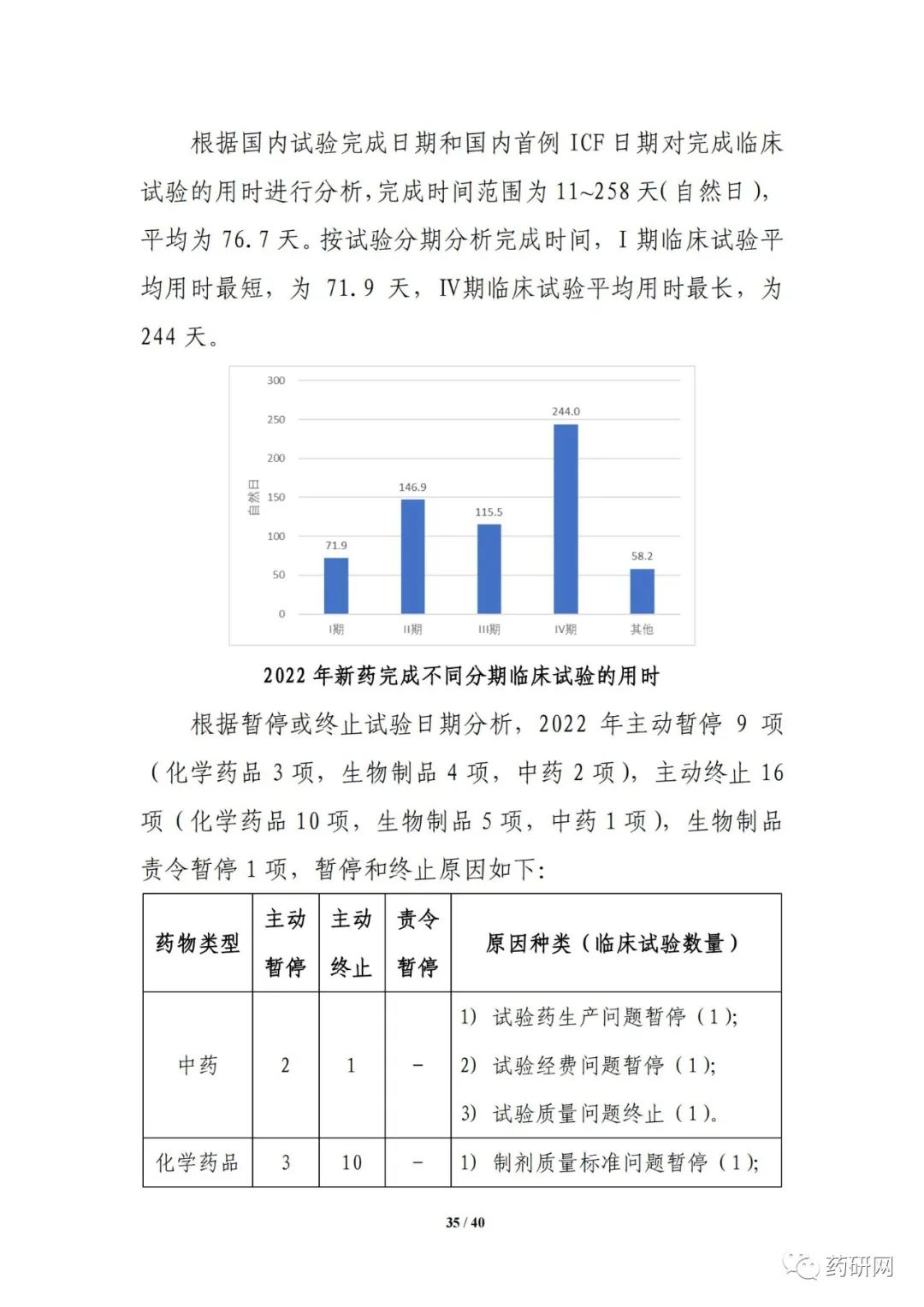
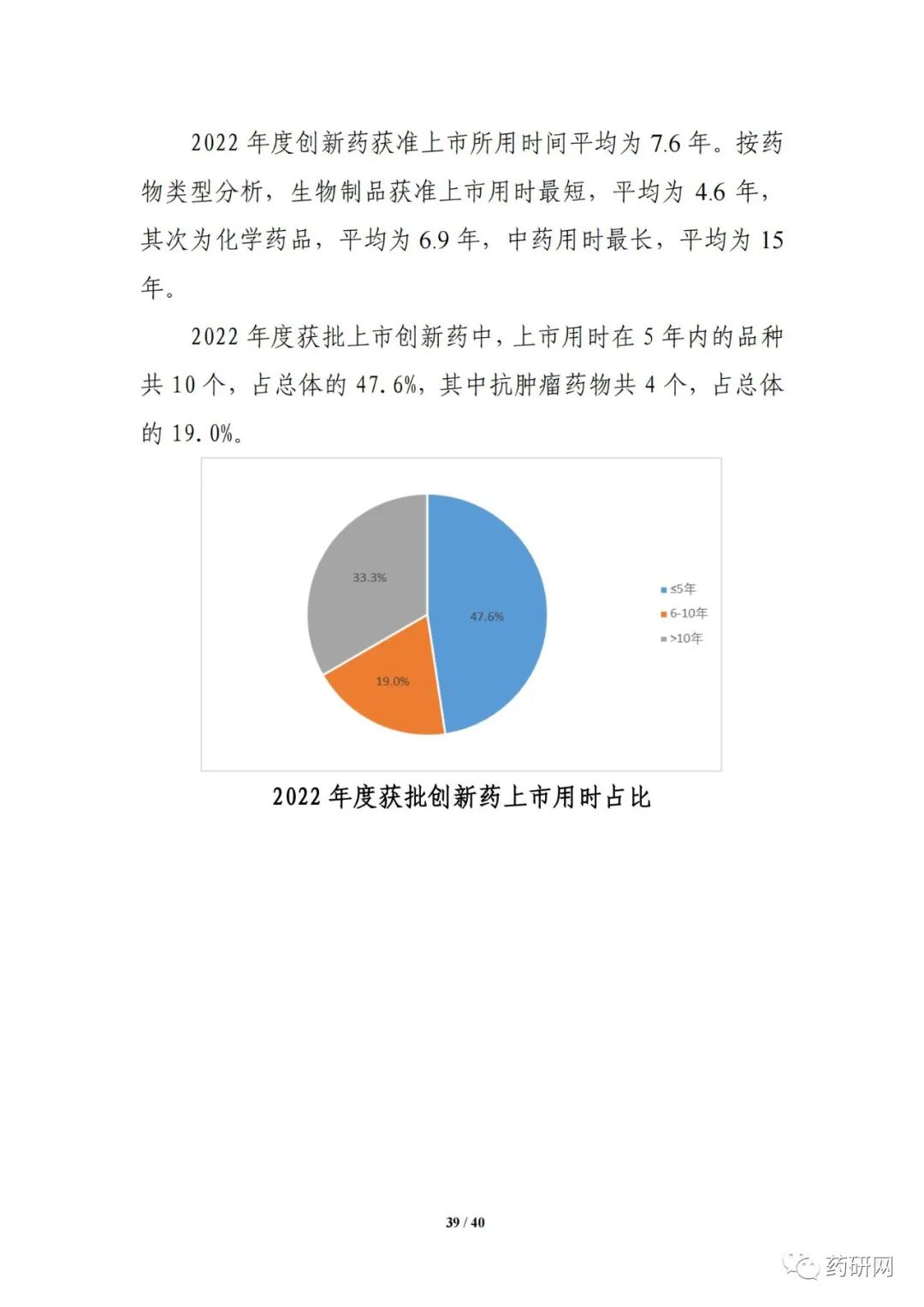
上市用时方面,根据品种境内首次获批临床试验日期和上市申请审批结论日期分析,2022年度创新药获准上市所用时间平均为7.6年。按药物类型分析,生物制品获准上市用时最短,平均为4.6年,其次为化学药品,平均为6.9年,中药用时最长,平均为15年。2022年度获批上市创新药中,上市用时在5年内的品种共10个,占总体的47.6%,其中抗肿瘤药物共4个,占总体的19.0%。
“在新药研发方面,我们国家正在从模仿慢慢过渡到真正的创新。”药盾公益基金理事解奕炯向人民日报健康客户端表示,创新药物更加强调药物的化学结构新颖、拓展新的治疗用途,具有研发风险大、研发周期长、技术要求高、资本投入大等特点,我国在新药研发方面的基础性研究相对薄弱,新药质量还有待进一步提高。
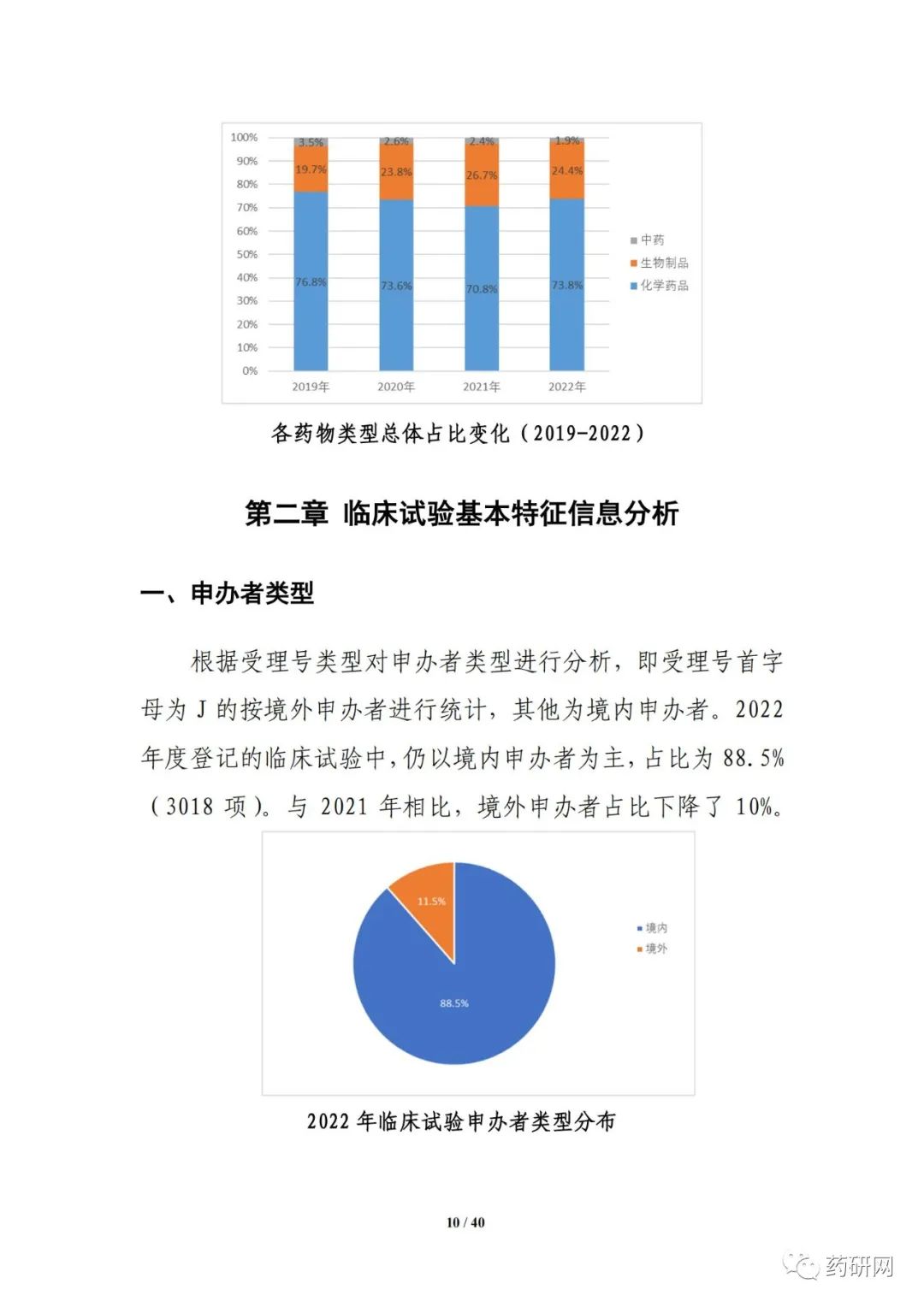
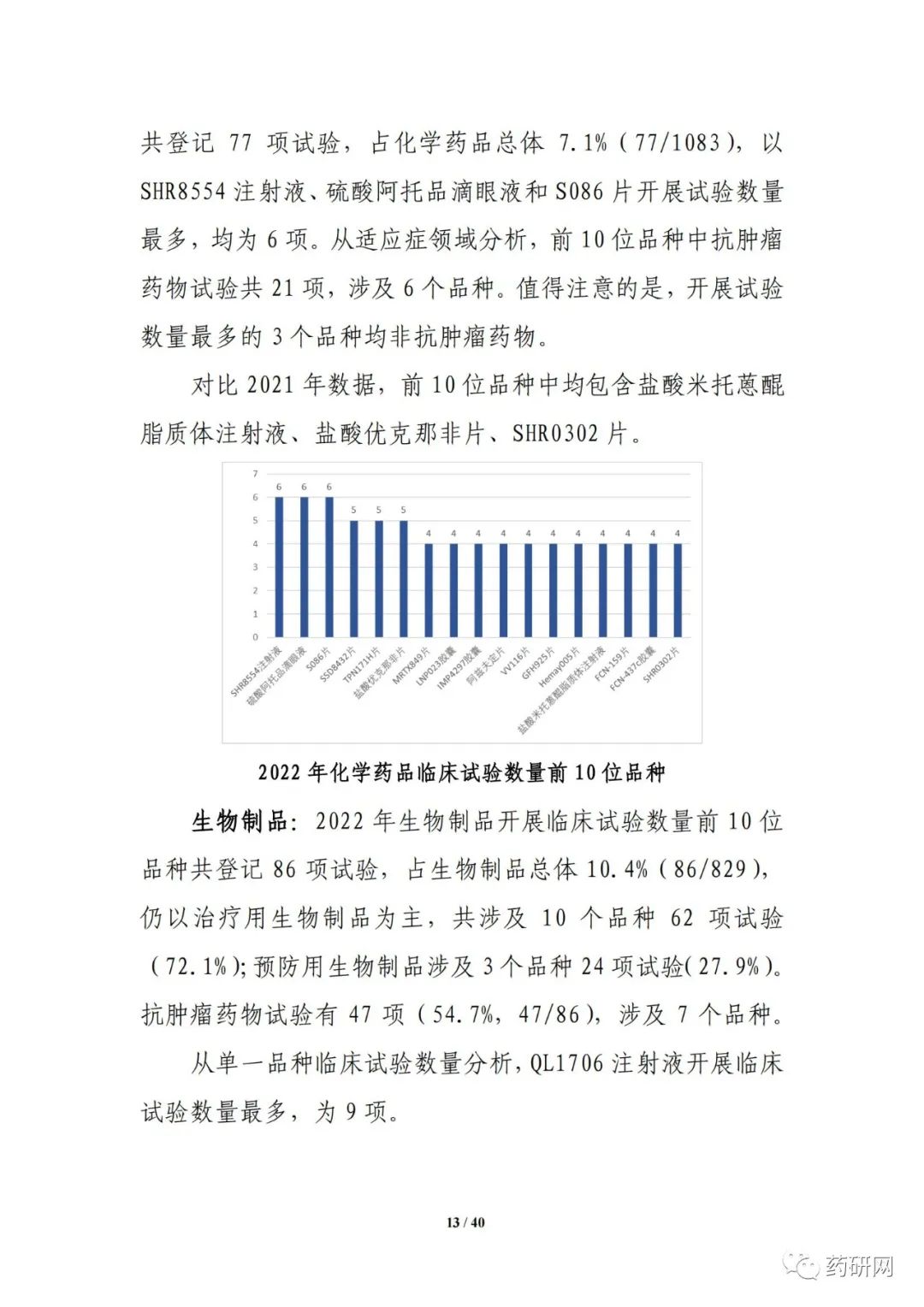
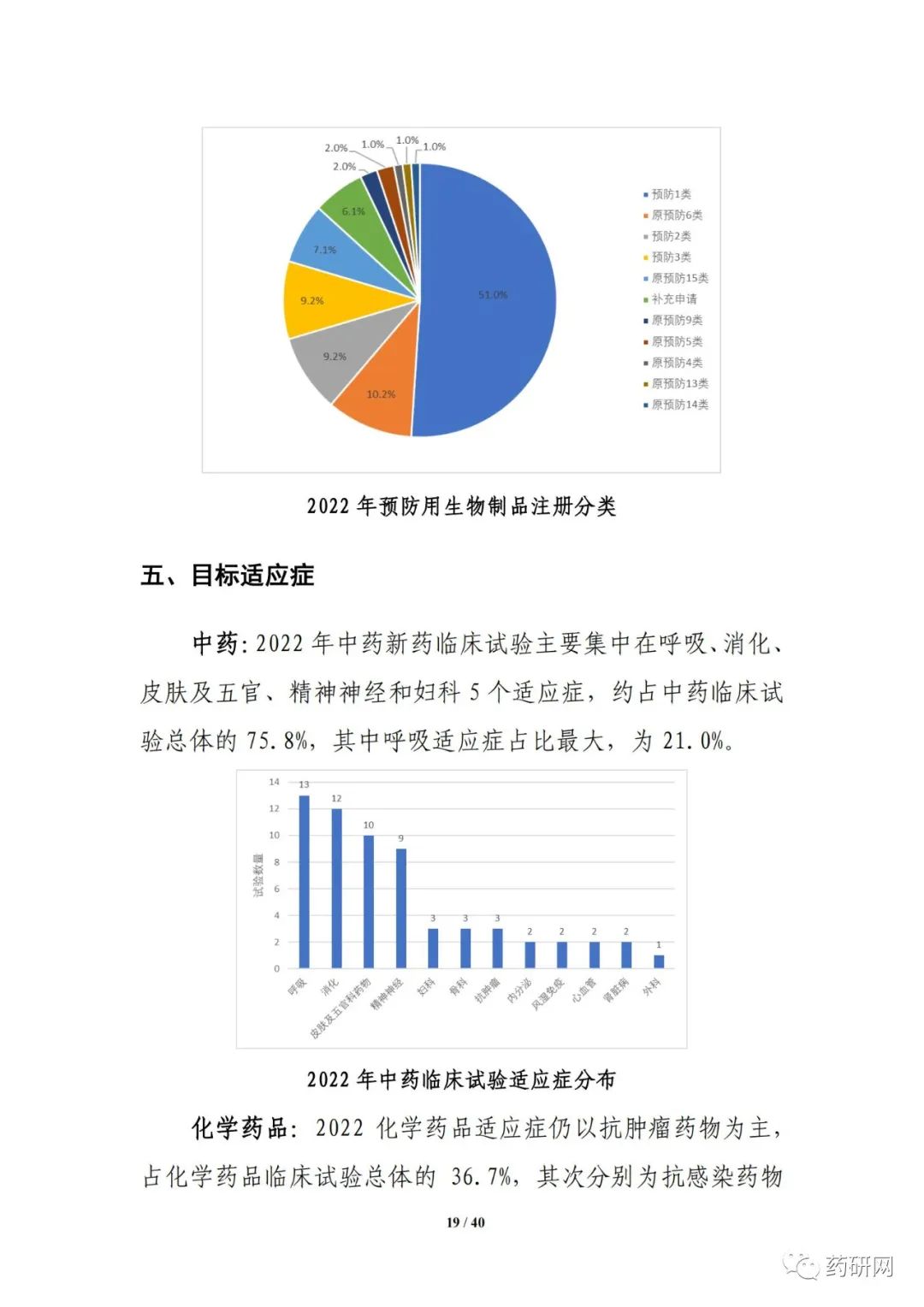
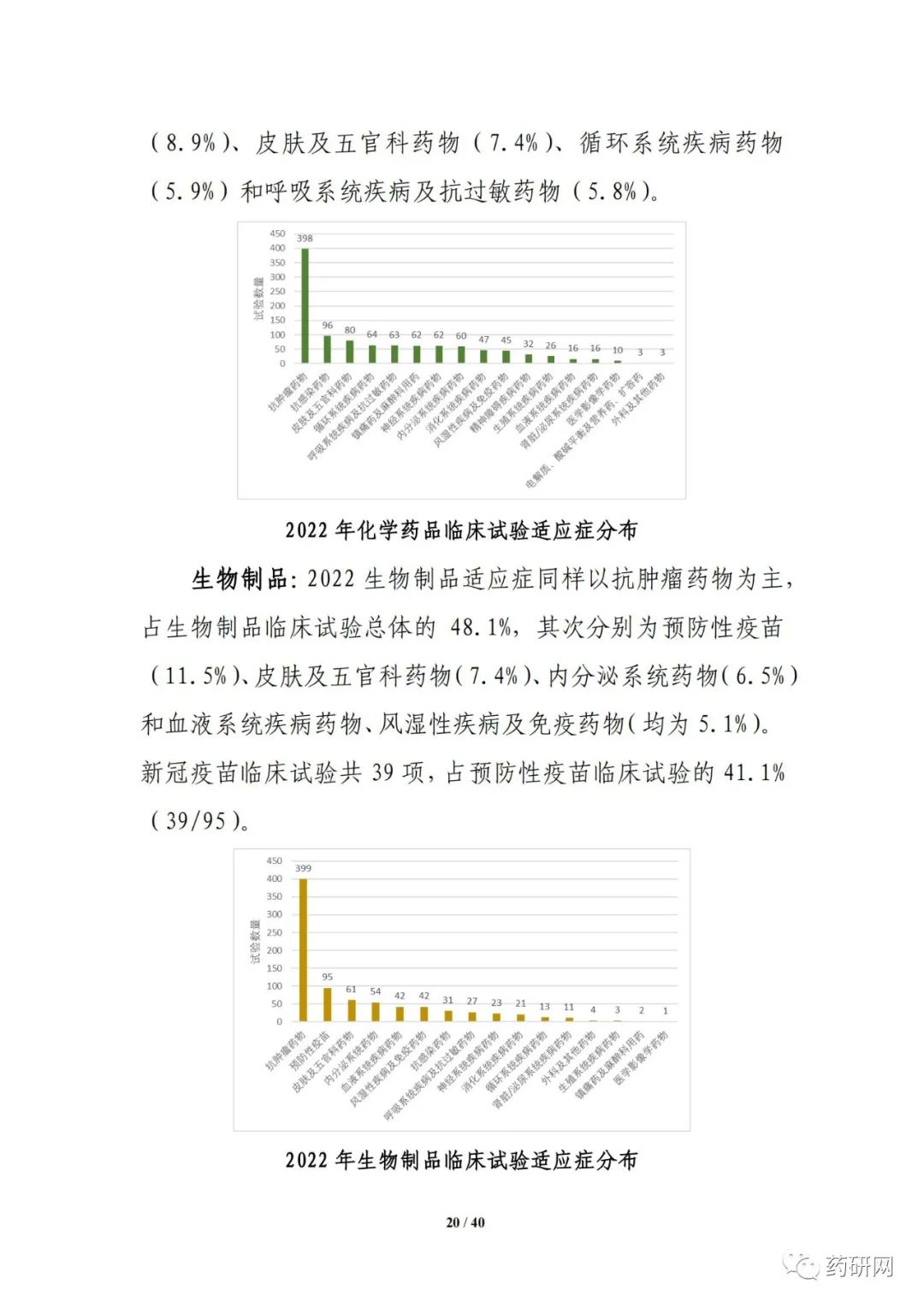
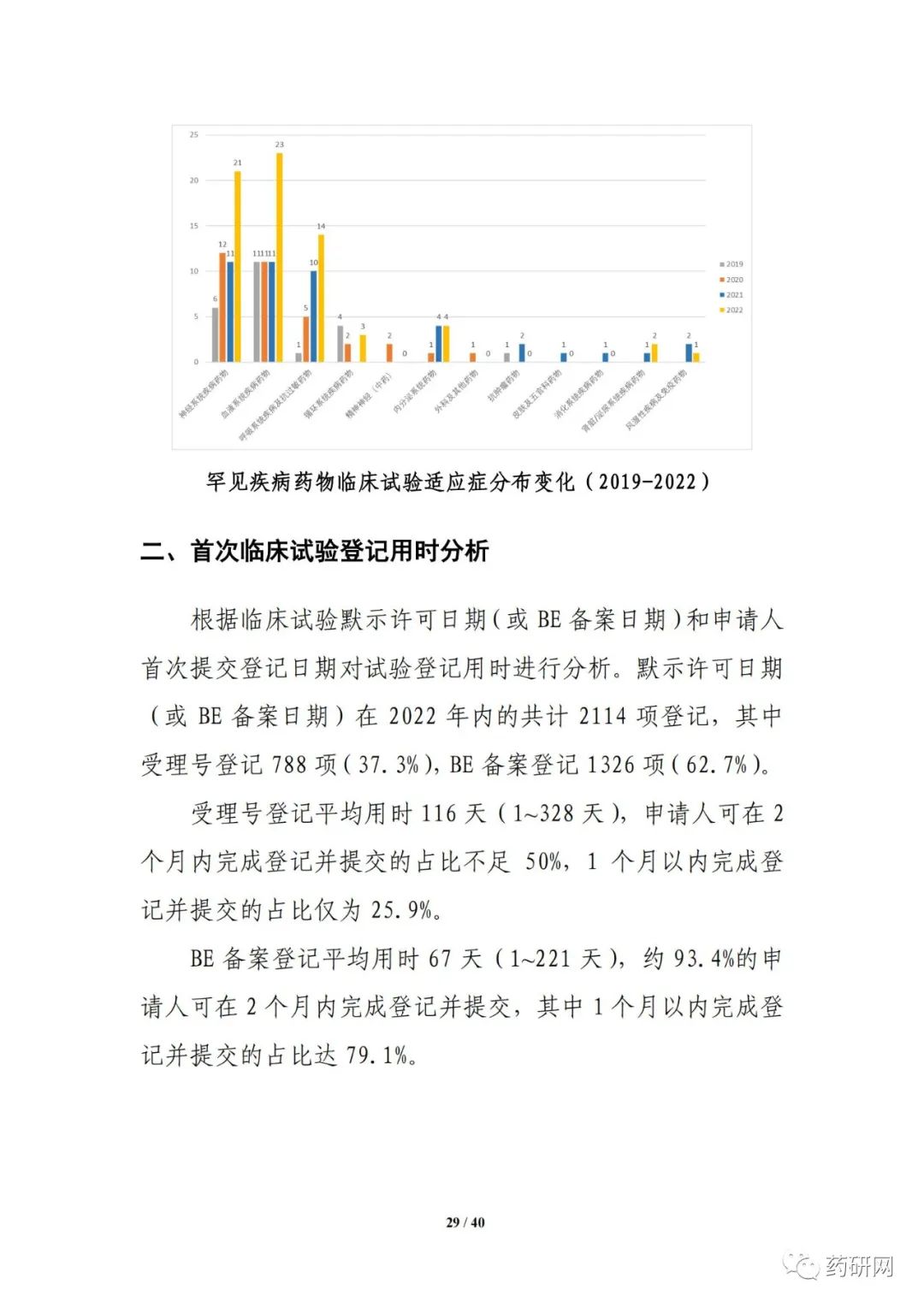
报告提到,近几年来,化学药品和生物制品的新药临床试验占比均较高,化学药品最高超过50%,生物制品约40%,中药占比仍呈现逐年下降趋势。2022年化学药品和生物制品临床试验的目标适应症仍主要集中在抗肿瘤领域,中药主要集中在呼吸、消化、皮肤及五官、精神神经等适应症,近几年无明显变化。









作者:药研网
版权声明:
本网站所有注明“来源:梅斯医学”或“来源:MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明“来源:梅斯医学”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言