NEJM: 国产新冠特效药来了!赵任/皋源/宁光合作发现国产VV116疗效不差于Paxlovid且更安全
2022-12-29 iNature iNature
许多国家已批准辉瑞公司的Paxlovid(奈玛特韦-利托那韦)和国产原研药阿兹夫定用于应急附条件治疗2019年冠状病毒病(Covid-19)的紧急使用。然而,供应无法满足全球需求,这就产生了对更多选择
许多国家已批准辉瑞公司的Paxlovid(奈玛特韦-利托那韦)和国产原研药阿兹夫定用于应急附条件治疗2019年冠状病毒病(Covid-19)的紧急使用。然而,供应无法满足全球需求,这就产生了对更多选择的需求。
2022年12月28日,上海瑞金医院赵任教授、上海仁济医院皋源教授和上海瑞金医院宁光院士合作在 New England Journal of Medicine 杂志在线发表题为“VV116 versus Nirmatrelvir–Ritonavir for Oral Treatment of Covid-19”的研究论文,这项试验在上海7家医院开展,是omicron变异株流行期间首个针对Covid-19患者开展的国产口服抗病毒药物“头对头”3期临床试验。
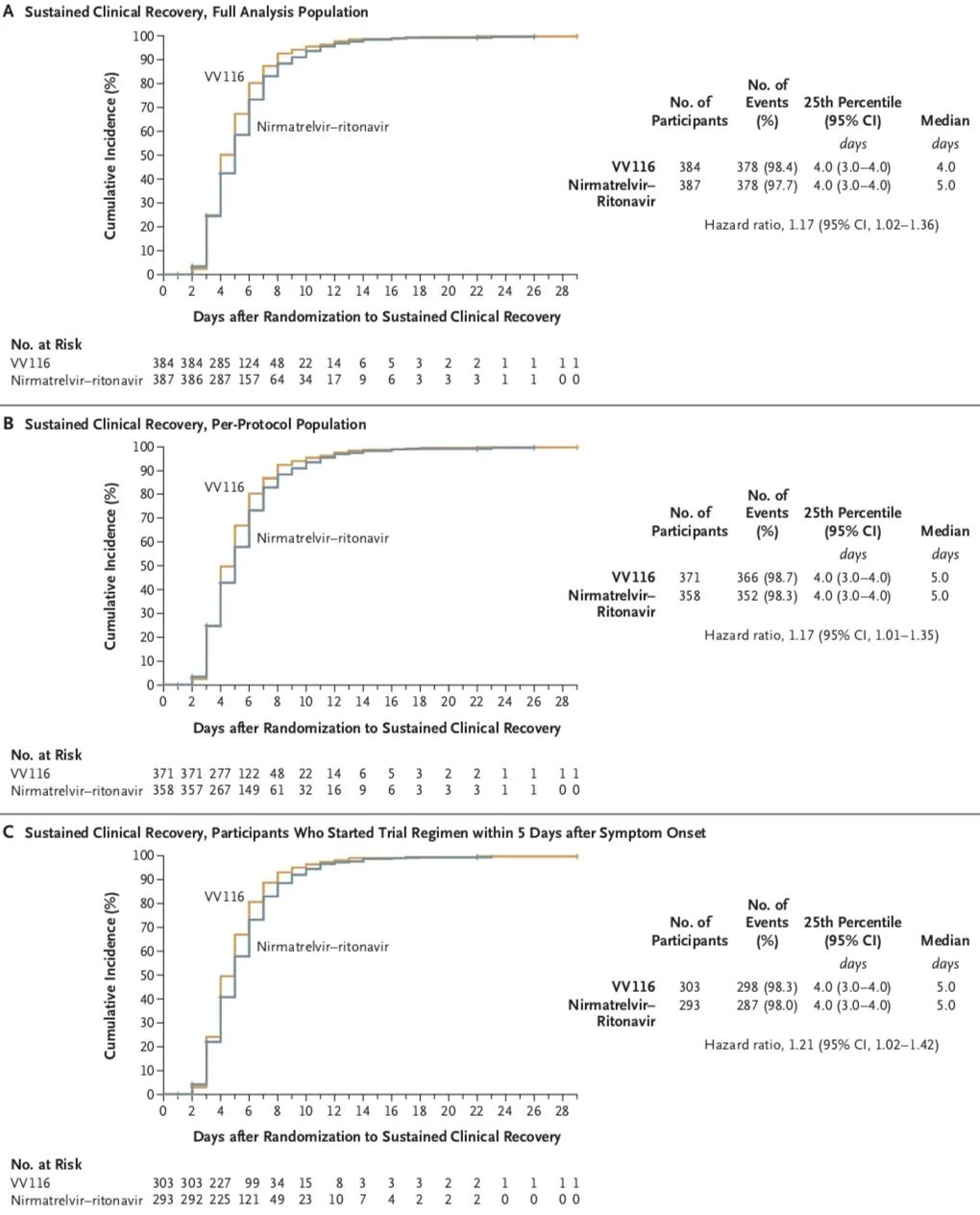
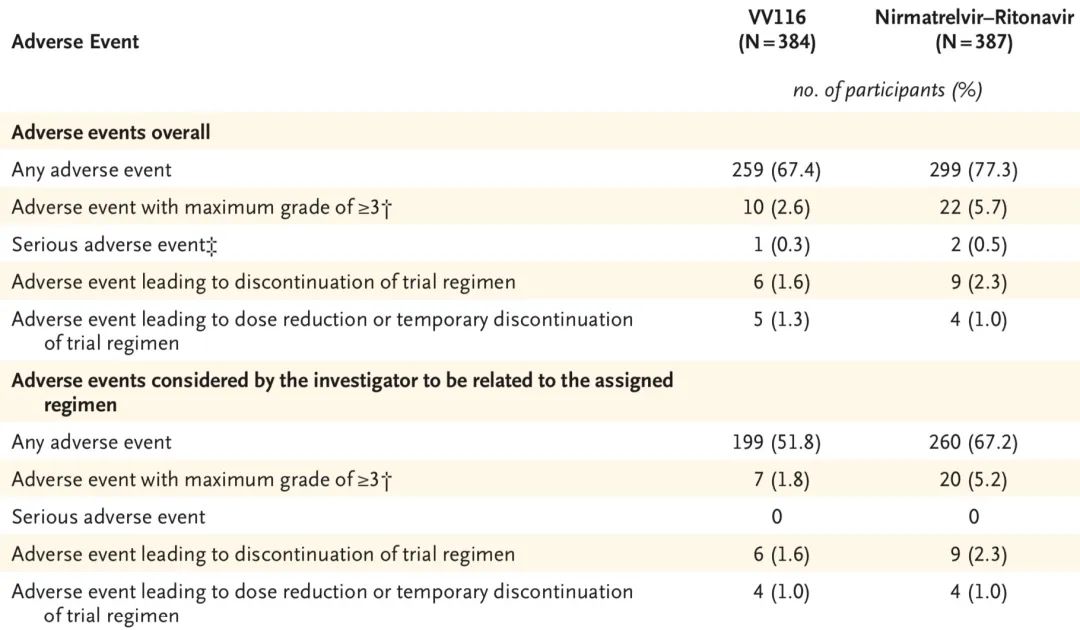
研究结果表明,对于有高危因素的轻中度Covid-19成人患者,在至持续临床康复时间方面,国产VV116非劣于Paxlovid(4天 vs. 5天;风险比,1.17;95%置信区间,1.02~1.36),且不良事件更少。

版权声明:
本网站所有注明“来源:梅斯医学”或“来源:MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明“来源:梅斯医学”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言









这项研究表明在患有轻中度#Covid-19#且有进展风险的成年人中,#VV116#在持续临床恢复的时间方面不逊于#Paxlovid#,且安全性问题较少。这项研究最终发表是2023年,因此,可以入选为2023年度#十大#
50
厉害了,国产药品不断打破外企的技术垄断,值得庆贺!
32