小药说药新春第四谈:CAR-NK
2023-02-01 小药说药 小药说药
人类自然杀伤细胞(NK) 占所有循环淋巴细胞的15%。NK细胞发现于20世纪70年代,主要与杀死感染的微生物和恶性转化的同种异体和自体细胞有关。
前言
人类自然杀伤细胞(NK) 占所有循环淋巴细胞的15%。NK细胞发现于20世纪70年代,主要与杀死感染的微生物和恶性转化的同种异体和自体细胞有关。NK细胞表现出抗肿瘤细胞毒性,无需事先致敏和产生细胞因子以及调节各种免疫反应的趋化因子。人外周血NK细胞可分为CD56bright和CD56dim两大类。CD56brightNK细胞通常被认为是低细胞毒性的细胞因子产生细胞,而CD56dimNK细胞则具有潜在的细胞毒性。由于NK细胞能够识别和分解肿瘤细胞,以NK细胞为基础的肿瘤免疫治疗领域已经到了一个激动人心的关头。

嵌合抗原受体(CAR)是一种受体蛋白,它赋予免疫细胞新的能力,以靶向特定的抗原蛋白。它的细胞外抗原结合域通常为单链抗体(scFv),可以识别肿瘤细胞表面的特异性抗原。细胞内激活的信号结构域,如CD28、4-1BB(CD137)和OX40,通常起到触发免疫细胞激活和杀伤的作用。表达CAR的T细胞能迅速识别肿瘤表面抗原,进而裂解肿瘤细胞。CAR-T细胞免疫治疗在治疗急性淋巴细胞白血病(ALL)、慢性淋巴细胞白血病(CLL)和淋巴瘤等血液肿瘤方面取得了巨大的成就。然而尽管CAR-T细胞免疫治疗技术发展迅速,但在临床应用中仍存在一些不足,例如在实体瘤的治疗中显示出很低的疗效;此外,大多数的CAR-T细胞免疫疗法需要自体过继细胞移植,因为除非处理HLA屏障,否则异基因T细胞可能导致移植物抗宿主病(GVHD);另外,CAR-T细胞免疫治疗可能会产生一些副作用,对患者的生命造成危害,如细胞因子释放综合征。最新的研究表明,表达CAR的NK细胞可能会克服CAR-T细胞的上述缺陷,并显示出显著的抗肿瘤作用。CAR-NK细胞在肿瘤的免疫治疗中展现出广阔的前景。
CAR-NK的研究概况
CAR-NK临床前研究的数量逐年增加,这体现在每年都在增加的关于CAR-NK的研究论文。
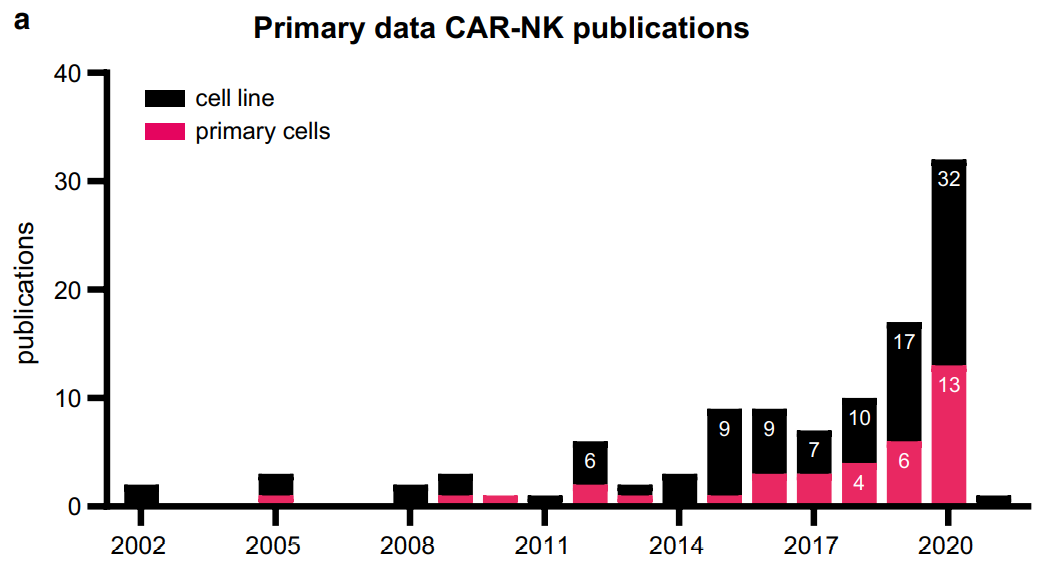
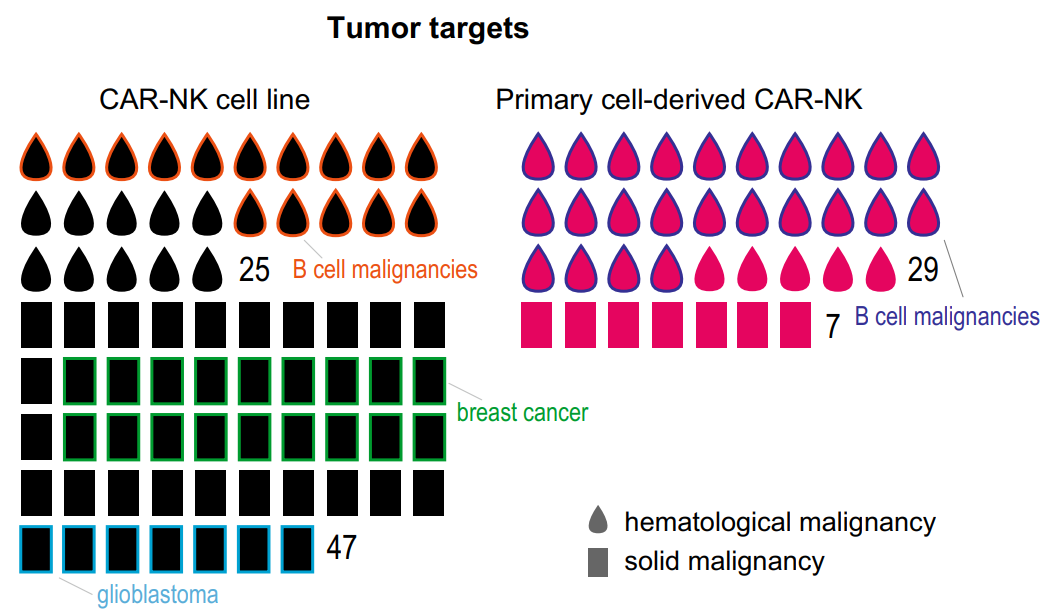
此外,在研究的靶标方面,Her2是实体瘤最常用的靶点,而CD19抗原在血液肿瘤中最常见。使用原代NK细胞的研究中,65%的人在研究B细胞恶性肿瘤,CD19是最受欢迎的靶点。有趣的是,在使用NK细胞系的研究中,研究实体瘤是血液恶性肿瘤的2倍以上。
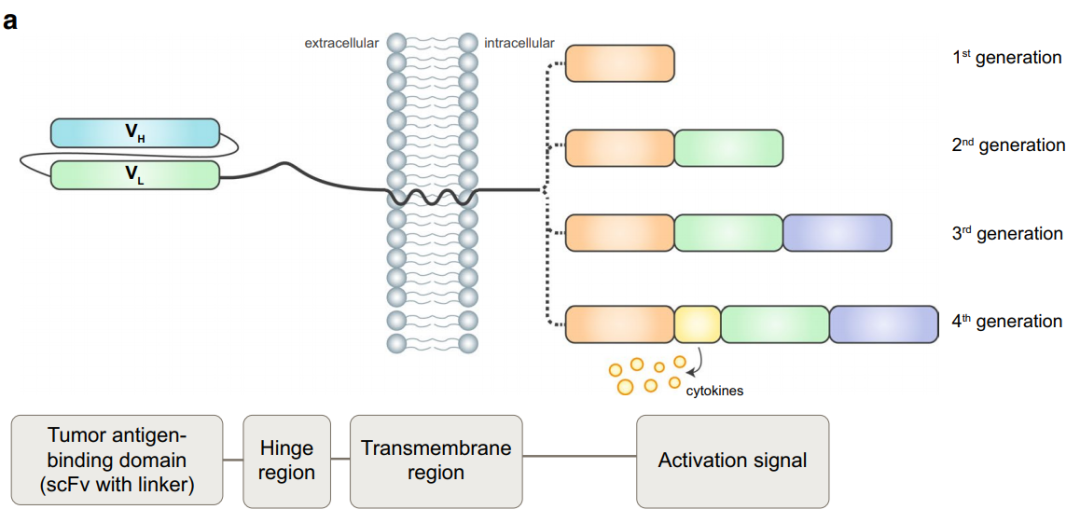
 CAR结构的设计
CAR结构的设计
NK细胞上表达的功能性CAR分子由三部分组成:胞外结构域、跨膜区以及胞内的信号结构域。胞外结构域由一个信号肽和识别抗原的单链抗体片段(scFv)组成,一段铰链区将这个结构连接到跨膜区,它也在细胞内连接到包含激活信号的胞内结构域。成功的CAR设计是通过仔细的设计和功能测试相结合来实现的。
 载体骨架和启动子
载体骨架和启动子
载体骨架包含表达CAR所需的所有元件,如启动子、polyA信号和转录调控片段。
启动子的选择直接影响到转基因的表达水平。目前,对不同启动子在NK细胞系中的CAR表达和功能的比较只有一次报道,而对原代NK细胞没有比较数据。就这一次单个报告来看,还不能确定CAR-NK细胞的最佳启动子。
目前关于CAR-NK细胞的报道显示,多种启动子被用于驱动CAR的表达,无论是细胞系来源的还是原代NK细胞。在原代CAR-NK和CAR-NK细胞系中,病毒启动子(CMV、MPSV、MMLV、SFFV等)比组成性活性启动子(如EF1α、CMV和PGK)更常用。
信号肽
在信号肽中存在着巨大的异质性,这直接转化为不同水平的蛋白质分泌效率。对于CAR-NK和CAR-T细胞,还没有确定最佳信号肽的比较研究。目前,CD8a-SP是原代NK细胞最常用的信号肽序列(16%,71%的研究中未公布)和NK细胞系的免疫球蛋白重链或轻链信号肽(29%)。
单链抗体
单链抗体片段是CAR的肿瘤抗原结合域,该结构域将决定CAR-NK细胞的特异性和功能。
由于单链抗体不是抗体的天然形式,因此重链和轻链的顺序是人工确定的。到目前为止,对于CAR-NK设计,大多数更喜欢VH-VL方向,而不是VL-VH方向。Fujiwara等人证明重链和轻链的顺序不影响T细胞上抗KDR CAR的表达水平。
此外,细胞可以配备多个单链抗体,从而扩大CAR效应细胞的抗原识别能力。在这里,有多种选择:CARs可以用双元件的载体转导,诱导两个CAR结构的表达;或者将两个单链抗体融合在一个结构中,产生串联单链抗体的“单柄”CAR。虽然这些技术已用于生产CAR-T细胞,但CAR-NK细胞仍未知。
目前大多数临床CAR-T细胞试验都使用了来自小鼠抗体的单链抗体,这增加了抗小鼠IgG细胞宿主抗移植物病的风险,这个问题可以通过人源化或筛选全人抗体避免。然而不幸的是,由于这些CAR受体的嵌合特性,即使是人源化的单链抗体也可能诱导宿主抗独特型免疫反应。幸运的是,在迄今为止数量有限的CAR-NK临床试验中,没有发现与抗CAR免疫反应相关的重大副作用。
连接区
重链和轻链之间的连接区有助于稳定单链抗体的构象,过短会导致多聚体的形成,过长可能导致水解或降低VH和VL结构域之间的关联。对于CAR-NK细胞,五肽GGGGS的多聚体应用最为广泛,通常为3个重复。另一个旨在增强蛋白水解稳定性的连接体是Whitlow“218”连接体:GSTGSGSKPGSGEGSTKG。
目前,虽然大多数CAR-NK研究没有提供连接细节,但已有的研究报道中,有22项使用了G4S连接,有2项应用了218连接。
铰链区
铰链区是连接单链抗体单位和跨膜结构域的CAR细胞外结构区,它通常维持效应细胞中稳健的CAR表达和活性所需的稳定性。大多数CAR-NK构建使用CD8α或CD28胞外结构域的衍生物或基于IgG的铰链区。

铰链区的类型和长度对CAR的功能活动有重要影响。但是目前大多数信息全来自CAR-T领域,能否直接转化为CAR-NK还有待证明。
在CD28和CD8α铰链区之间的直接比较中,发现CD28更有可能促进CAR分子的二聚化,因此,CD28铰链区的CAR产生的激活刺激更强。虽然这可能是有益的,但也可能导致更严重的副作用。
IgG为基础的铰链区也广泛应用于CAR结构。基于IgG铰链区的一个主要优点是结构的灵活性,该结构通常由IgG1或IgG4的FC部分或Fc部分的CH2/CH3结构域组成。铰链区的长度可以调节以适应抗原识别,但研究发现,间隔区越短,细胞因子的产生越高,CAR-T细胞增殖越快,体内持久性和抗肿瘤效果越好。
对于CAR-NK细胞,大多数研究在原代NK细胞(16/35)和CAR-NK细胞系(41/72)中均采用CD8α铰链区。其它使用的铰链区包括CD28、IgG Fc结构域和DAP12。
跨膜结构域
跨膜(TM)结构域连接CAR的胞外结构域和细胞内激活信号结构域,CAR-NK最常用的TM部分来自CD3ζ、CD8和CD28,但其他如NKG2D、2B4、DNAM1也有被使用。
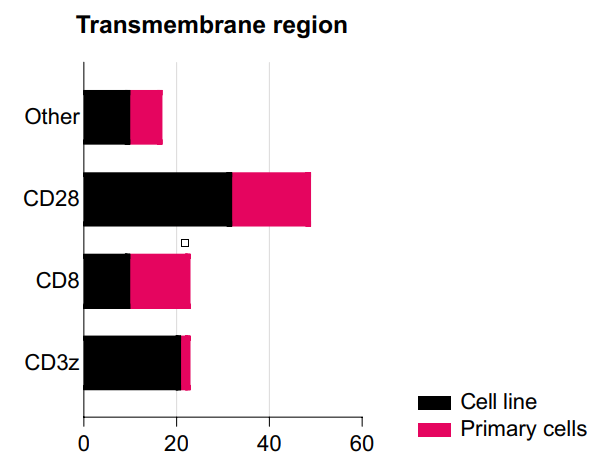
TM结构域的选择影响了CAR结构在细胞功能上的活化程度。通常在NK细胞上表达的分子如DNAM-1、2B4和NKG2D的TM会导致更多的CD107a脱颗粒和更高的细胞毒性,因此,TM的具体来源将决定CAR-NK的活性。
TM结构域的一个重要方面是,最佳TM区域应遵循T细胞或NK细胞上跨膜蛋白的蛋白质自然取向(N端到C端顺序)。NKG2D虽然是一种强大的NK细胞激活剂,然而,天然NKG2D具有C端到N端的跨膜区。
目前,CD8α和CD28修饰的TM在原代CAR-NK细胞中最常见,而CD28是CAR-NK细胞系的首选TM区域。
CAR-NK激活信号
CAR的细胞内激活信号的数量决定了其属于哪一“代”CAR。
第一代CAR-NK细胞与CAR-T细胞一样,只含有CD3ζ信号。第二代和第三代CAR-NK分别携带一个和两个额外的共刺激信号,共刺激分子通常来源于CD28家族(CD28和ICOS)、TNFR家族(4-1BB、OX40和CD27)或SLAM相关受体家族(2B4)。到目前为止,唯一公布的CAR-NK临床试验采用了第二代CAR-NK构建,该构建通过加入IL-15表达和诱导Caspase9增强活性。
目前大多数CAR结构依赖于CD3ζ链信号域,强烈的激活信号对于诱导有效的抗肿瘤反应很重要,但也可能导致效应细胞的快速衰竭。因此,共刺激域的组合可用于校准所需的免疫细胞反应。与基于4-1BB的 CARs相比,基于CD28的CARs表现出更快的效应器特征,诱导更高水平的IFN-γ、颗粒酶B、TNF-α。然而,这种强烈的共刺激信号也会导致活化诱导的细胞死亡(AICD)。
相比较,4-1BB-CD3ζ信号优先诱导记忆相关基因和持续的抗肿瘤活性。原因可能是4-1BB结构域改善了CD28结构域引起的T细胞耗竭。
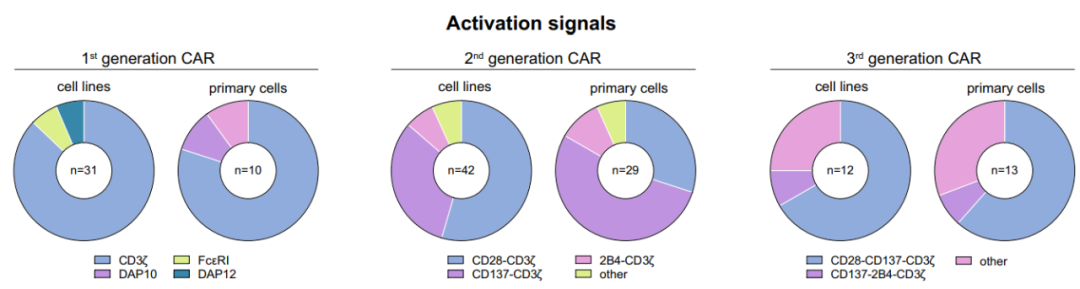
如上图所示,在CAR-NK细胞系和原代CAR-NK细胞的研究中,CD3ζ几乎被普遍用作主要的激活域,其中大约一半携带一个额外的激活域,通常添加4-1BB或CD28。至于第三代结构,CD28/4-1BB/CD3ζ的组合是最常用的。
CAR的转染或转导载体
随着基因修饰技术的进步,许多方法被用于产生CAR-NK。两种主要方法是病毒转导(使用慢病毒或逆转录病毒),或转染裸质粒DNA、转座酶DNA介导的整合以及mRNA电转。
 慢病毒
慢病毒
慢病毒能够高效地转导周期性和非周期性细胞,在基因治疗领域得到了广泛的应用。迄今为止,已有14篇关于原代CAR-NK细胞和44篇关于CAR-NK细胞系的研究成功使用慢病毒作为载体。
在临床前研究中,21项研究使用了第二代病毒,6项研究使用了第三代慢病毒来产生表达CAR的NK细胞系(17个未知)。在原代CAR-NK细胞研究中,5项研究使用了第三代慢病毒,7项研究使用了第二代慢病毒载体(2个未知)。
逆转录病毒
几十年来,逆转录病毒一直被用作基因治疗载体。迄今为止,有20项使用CAR-NK细胞系的研究和15使用原代NK细胞的研究应用了逆转录病毒。最近的一项I期临床试验中,由逆转录病毒转导的CD19 CAR-NK细胞治疗CD19+非霍奇金淋巴瘤和慢性淋巴细胞白血病。在这项研究中,73%的患者有响应,8名患者中有7名获得完全缓解。此外,在所有剂量水平下,CAR-NK输注后30天内反应迅速。经过一年的随访,仍然可以检测到扩增的CAR-NK细胞。输注后,外周血中的CAR-NK DNA拷贝数保持稳定达一年之久,这些结果首次表明逆转录病毒转导的CAR-NK细胞可以在体内长期存活。
不同种类的逆转录病毒被用来产生CAR-NK细胞。与γ逆转录病毒和慢病毒相比,RD114α逆转录病毒在原代NK细胞的转导效率上更高。尽管使用不同的逆转录病毒可以在NK细胞中获得长时间稳定的CAR表达,但逆转录病毒系统的安全性仍然是一个值得关注的问题,尤其是与更安全的慢病毒相比。
mRNA电穿孔
电穿孔CAR编码mRNA是一种快速、有效但是作用短暂的一种方法。迄今为止,有9个关于CAR-NK细胞系和11个原代CAR-NK细胞研究使用了mRNA电穿孔。
一般来说,扩增或活化的NK细胞的mRNA转染效率远高于新鲜分离的NK细胞。由于mRNA的合成符合GMP的规定,并且电穿孔可以在洁净室中进行,因此通过mRNA电穿孔产生符合GMP的CAR-NK是可行的。然而,这种方法的主要缺点是CAR表达的窗口短暂:电穿孔后,CAR-NK细胞应在7天内输回患者体内。
睡美人转座子
基于转座子的系统可以在预定的位置高效地导入CAR转基因,这是传统方法所不具备的一个重要优势。转座子主要通过电穿孔导入NK细胞,然后通过转座子酶整合到宿主基因组中。有两项研究应用转座子系统来产生CAR-NK细胞:一项使用NK-92-MI细胞,另一项研究将转座子转染到iPSC细胞,然后分化成NK细胞。富集后,抗间皮素CARs在iPSC衍生的NK细胞上稳定表达,并在卵巢癌小鼠模型中发挥出作用。
CRISPR/Cas9
CRISPR/Cas9是一种强大的基因改造技术,这项技术依赖于将Cas9蛋白与引导RNA一起导入NK细胞。最初,这种技术被用于原代NK细胞,以破坏CD38基因,旨在防止NK细胞与daratumumab (抗CD38)联合使用时的自相残杀,因为CD38在NK细胞、多发性骨髓瘤和AML细胞上均有表达。
最近,CRISPR/Cas9被用于引入新基因。在一些采用HDR模板的研究中,使用K562-mIL-21扩增的NK细胞获得了超过75%的敲入效率。然而,在新鲜NK细胞中,敲入效率仅为3–16%。总的来说,CRISPR/Cas9策略是一种很有前景的技术,它可以用来精确地删除、修复或导入特定基因,有望产生强大的抗肿瘤NK细胞。
CAR-NK细胞免疫治疗的优势
首先,在临床应用中,CAR-NK细胞免疫疗法比CAR-T细胞免疫疗法更安全,而且NK细胞的安全性已在一些临床领域得到验证。例如,一些I/II期试验显示,同种异体NK细胞输注耐受性良好,不会引起GVHD和明显的毒性。因此,NK细胞是一种适应性更强的CAR载体,而不仅仅局限于自体细胞。

CAR-T细胞免疫治疗的主要副作用之一是由于CAR-T细胞的持续存在而产生的靶向效应。相反,CAR-NK细胞的寿命很短,几乎不会产生靶向效应。另外,NK细胞产生的细胞因子种类与T淋巴细胞产生的细胞因子种类有很大不同。活跃的NK细胞通常产生IFN-γ和粒-巨噬细胞集落刺激因子(GM-CSF),而CAR-T细胞通常通过分泌促炎性细胞因子如TNF-α、IL-1和IL-6诱导细胞因子风暴。
第二,除了通过单链抗体识别肿瘤表面抗原来抑制癌细胞外,NK细胞还可以通过多种受体识别各种配体来抑制癌细胞,例如自然细胞毒性受体(NKp46、NKp44和NKp30)、NKG2D和DNAM-1(CD226)。这些NK细胞受体通常识别在免疫细胞或长期治疗压力下肿瘤细胞上表达的应激诱导配体。此外,NK细胞通过FcγRIII(CD16)诱导抗体依赖性细胞毒性。因此,CAR-NK细胞可通过CAR依赖和NK细胞受体依赖性途径抑制癌细胞,从而消除肿瘤抗原阳性癌细胞或表达NK细胞受体配体的癌细胞。临床试验表明,CAR-T细胞不能消除高度异质性的癌细胞,但是CAR-NK细胞能够有效地杀死长期治疗后可能改变其表型的残留肿瘤细胞。
最后,NK细胞在临床样本中非常丰富,可以从外周血(PB)、脐带血(UCB)、人类胚胎干细胞(HESC)、诱导多能干细胞(IPSC)甚至NK-92细胞系中产生。NK-92细胞提供了一个均匀的细胞群,并且可以在适当的培养条件下很容易地扩大,以进行广泛的临床应用。但是,由于其肿瘤细胞系来源,必须在输注前进行辐照。相反,活跃的PB-NK细胞表达广泛的受体,无需辐射即可利用,这使得它们能够在体内生成。来源于iPSCs或hESCs的NK细胞结合了PB-NK和NK-92细胞的优点,表现出与PB-NK细胞相似的表型,是一个同质的群体。更重要的是,通过采用非病毒转基因方法,CAR可以很容易地在人胚胎干细胞和/或iPSC来源的NK细胞中表达。
CAR-NK细胞免疫治疗的临床研究
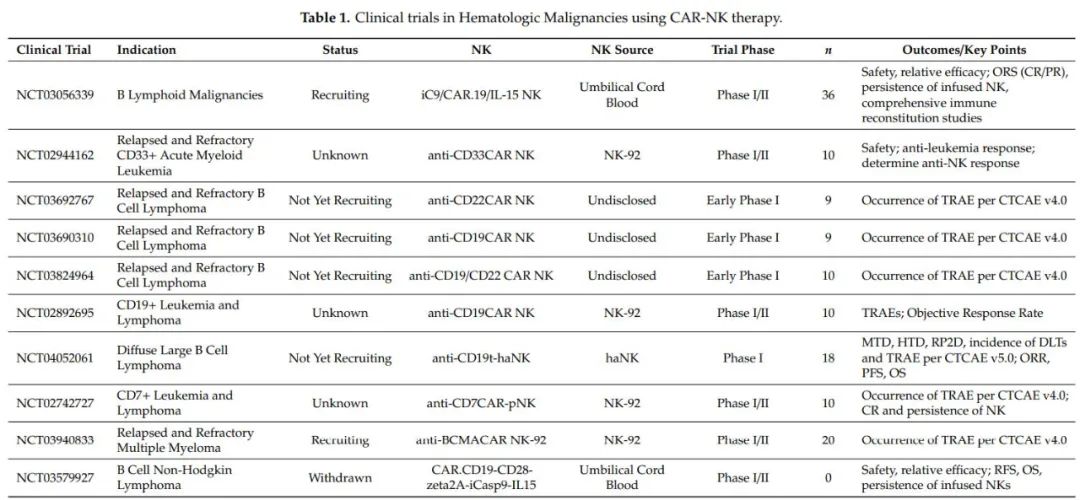
血液瘤
临床前研究表明,CD19-CAR-NK细胞对血液系统肿瘤有很高的应答率,并且易于制造,与目前的CAR-T细胞免疫疗法相比,这是一个巨大的进步。CD19-CAR修饰的NK细胞具有比CAR-T更明显的优势,有望显示出更好的抗肿瘤作用。除了CD19外,淋巴瘤和白血病的CAR-NK细胞临床研究也针对CD7(NCT02742727)和CD33(NCT02944162)。目前,有几种针对血液恶性肿瘤的CAR-NK细胞临床试验正在进行中。
 实体瘤
实体瘤
CAR治疗的一个主要障碍是缺乏对实体瘤的疗效。这是由于肿瘤灌注不良、TAA异质性和实体瘤伴发的免疫抑制肿瘤微环境(TME)所致。

CAR-NK疗法试图解决这些问题,一些临床试验已经应用于实体恶性肿瘤的治疗。在实体瘤中进展最为广泛的CAR-NK疗法包括检查点分子程序性细胞死亡蛋白-1配体(PD-L1)以及常见的肿瘤相关抗原HER2和MUC1为靶点。
PD-L1在TME和免疫抑制细胞的几种癌症类型中上调。一种新的NK-92细胞系被设计成靶向PD-L1、ER保留的IL-2和高亲和力CD16的CAR,称为PD-L1靶向haNK(t-haNK)。令人兴奋的临床前数据表明,这些细胞在体外对15种肿瘤细胞株具有特异的抗肿瘤作用,在体内对三阴性乳腺癌、膀胱肿瘤和肺癌具有很强的抗肿瘤作用。QUITL3.064 I期临床试验(NCT04050709)目前正在进行,PD-L1 t-haNK联合其他药物评估局部晚期或转移性胰腺癌患者的安全性和有效性也在进行中(NCT0439099)。
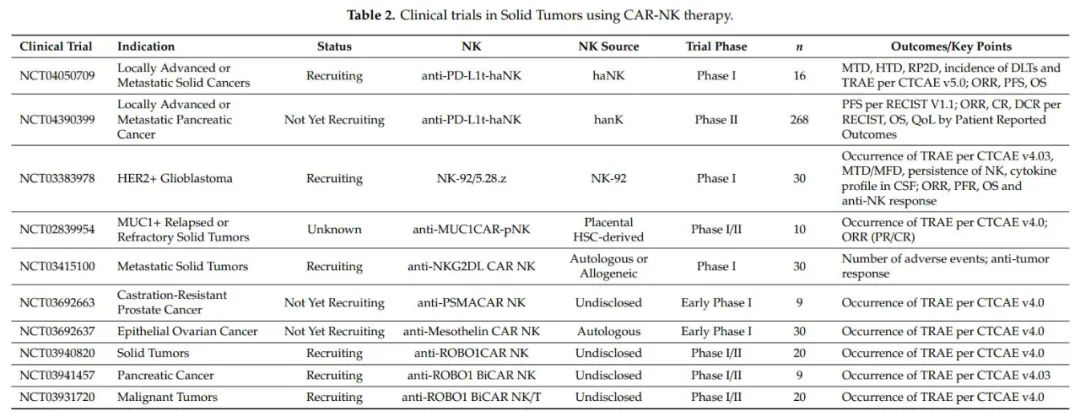
HER2在几种癌症中过度表达,如乳腺癌、胃癌、食管癌、卵巢癌和子宫内膜癌。HER2也在80%的胶质母细胞瘤中表达,并且与低生存率相关。因此,HER2是CAR治疗的一个非常有吸引力的靶点。HER2-CAR-T治疗胶质母细胞瘤已经显示出这些细胞被转移到肿瘤中,但是在TME中高效应功能的T细胞导致抗原丢失变体的快速选择。ErbB2-NK-92/5.28z CAR-NK将在潜在抗原丢失的情况下保持效应器功能,从而使过继转移细胞的细胞毒功能恢复到基线NK细胞的细胞毒功能。这项HER2-CAR-NK治疗正在一项3+3剂量递增I期临床试验(CAR2BRAIN;NCT0338978)中。
MUC1是一种在导管上皮细胞上表达的高度糖基化跨膜糖蛋白,其在人类B细胞和T细胞上的表达存在争议。MUC1在多种癌症类型中过度表达,使其成为CAR-T治疗的合适靶点。然而,CAR-T疗法已被证明是不成功的,因为免疫抑制的TME。为了规避TME介导的免疫抑制,CAR-NK细胞被设计表达带有CD28和CD137信号结构域的MUC1-CAR和截短的PD-1肽(MUC1-CAR-NK-92)。这些细胞在体外和体内均能杀伤MUC1靶细胞。最近完成了一项I期临床试验(NCT02839954),评估了Muc1-CAR-NK-92在Muc1阳性复发或难治性实体瘤患者中的安全性和有效性。13例PD-L1和MUC1阳性肿瘤患者中,3名退出,9名病情稳定,1名患者病情进展。主要的观察指标是确定Muc1-CAR-NK-92细胞的毒性,值得注意的是,试验中没有任何患者出现细胞因子风暴或骨髓抑制的迹象。
CAR-NK细胞面临的临床应用障碍
体外扩增NK细胞是CAR-NK细胞免疫治疗的第一道障碍。单个供体的NK细胞数量不足以进行治疗,这使得NK细胞的扩张和激活变得非常关键。这一生产过程通常需要两到三周的时间来培养NK细胞和某些细胞因子(IL-2或与IL-15或抗CD3单克隆抗体联合使用)。尽管辐照过的K562-mb15-4-1BBL细胞作为饲料可以改善NK细胞增殖过程中细胞的生长,但供体细胞数量的可用性仍然是一个障碍。此外,必须完全清除T细胞,以防止GVHD。因此,如何获得足够的NK细胞仍是一个挑战。
选择合适的方法将CAR转化为NK细胞是CAR-NK细胞免疫治疗的关键。到目前为止,病毒载体和非病毒载体都被用来转化CAR。虽然逆转录病毒载体的转染效率很高,但它可能会引起插入突变、致癌和其他不良反应。而慢病毒载体尽管显示出较低的插入突变发生率,但其对外周血NK细胞的转染效率低至20%。
mRNA转染CAR-NK细胞也被认为是一种安全、实用的转染方法。研究表明,在异种移植肿瘤模型中,用mRNA方法电穿孔24小时后受体表达水平超过80%,转染mRNA的NK细胞表现出明显的细胞毒性。最近有研究表明,转染mRNA可以有效地避免CAR修饰免疫疗法临床应用的一个重要限制因素“靶向非肿瘤”毒性。然而,通过电穿孔方法转染mRNA的CAR-NK细胞的抗肿瘤作用将是暂时的,因为CARs的表达水平不会超过3天。
新一代的CAR-NK
一些研究小组正在探索不同的机制来有效地对抗抗原丢失和免疫抑制TME,从而将提高CAR-NK治疗策略的治疗寿命和疗效,并可能成为下一代CAR-NK治疗的支柱。
为了避免抗原逃逸,Mitwasi和他的同事开发了一种通用型CAR(UniCAR),带有开关,以提高安全性和可控性。这项技术首先在针对E5B9的CAR-T细胞上得到验证,E5B9是核抗原La-SS/B的肽表位。由于在细胞表面没有发现这种蛋白,CAR-T必须通过一种称为靶模块(TM)的双特异性分子定向到肿瘤。TMs通常以E5B9肽表位融合到抗TAA的单链抗体上。不同的TM可以联合应用,以同时针对多个TAA,诱导CARs反应肽的异质性,而不存在靶向效应的风险。

Mitwasi等人开发了一个表达UniCAR的NK-92细胞系和一个TM,其中E5B9表位连接到IgG4主干上的抗GD2单抗。GD2在多种人类肿瘤中高表达,是神经母细胞瘤的免疫治疗靶点之一。以表达GD2的神经母细胞瘤和黑色素瘤细胞为靶点的UniCAR NK-92在体外表现出抗肿瘤细胞毒性,已准备进一步的临床开发。
CAR治疗面临的另一个挑战是TME。为避免免疫抑制性TME,Wang等构建了NK-92细胞,表达由细胞外TGFβRII融合到激活受体NKG2D的细胞内信号转导域组成的修饰CAR(TGFβRII-NKG2D,称为NK-92-TN)。本质上,这种融合将免疫抑制剂TME产生的TGF-β传递的信号转换为激活信号。体外培养的NK-92-TN细胞对TGF-β抑制有抵抗力,无NKG2D下调,TGF-β共培养后杀伤能力和IFN-γ产生增加。虽然体外实验数据看起来很有希望,但在体内,NK-92-TN的抗肿瘤活性并不显著,终点肿瘤重量的减少很小。在这方面还需要更深入的研究。
展望
自然杀伤细胞是一组独特的抗肿瘤效应细胞,具有不受MHC限制的细胞毒性、产生细胞因子和免疫记忆等功能,使其成为先天性和适应性免疫反应系统中的关键角色。CAR-NK细胞疗法是一个很有前途的临床研究领域,对某些癌症患者具有良好的安全性和初步疗效。与CAR-T细胞相比,CAR-NK细胞具有自己独特的优点,但仍面临着一些挑战。这些挑战包括细胞增殖的改善,使细胞毒性的激活更有效,以及最终找到NK细胞的最佳重建方法。相信解决好这些问题,基于NK细胞优秀的抗肿瘤血统,极有可能在CAR修饰的武装下为肿瘤治疗带来新的突破。
作者:小药说药
版权声明:
本网站所有注明“来源:梅斯医学”或“来源:MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明“来源:梅斯医学”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言