【协和医学杂志】卵巢癌患者肿瘤细胞减灭术前低蛋白血症与围术期异体红细胞输注风险的相关性:单中心回顾性队列研究
2024-08-06 协和医学杂志 协和医学杂志
本研究旨在通过回顾性研究,分析因行肿瘤细胞减灭术的卵巢癌患者术前低蛋白血症与异体红细胞输注风险的相关性,以期为临床工作提供指导。
卵巢癌起病隐匿,多数患者就诊时已出现腹腔内转移,而对于Ⅲ~Ⅳ期卵巢癌患者,肿瘤细胞减灭术是减轻肿瘤负荷、改善临床症状、延长生存期的重要治疗手段。由于手术操作复杂、创伤大、失血多,约42%~77%的患者在围术期面临较高的输血风险[1]。
异体输血不仅具有血液传播性疾病感染风险,还可能引起患者免疫功能抑制,后者与术后感染及肿瘤复发具有相关性,且增加围术期并发症发生率和死亡率[2-3]。
此外,异体输血亦可导致其他危及生命的不良反应,如溶血、输血相关性急性肺损伤及循环超负荷等[4-5],故分析围术期输血的影响因素,继而针对性提前干预,对于降低异体输血率具有重要意义。
血浆白蛋白是维持胶体渗透压的重要成分,是评估全身疾病恢复和整体营养状况的公认临床指标,其水平<35 g/L被认为是低蛋白血症[6]。既往研究显示,术前低蛋白血症是胃肠道、心血管、妇科肿瘤、后路腰椎椎间融合术后并发症发生的独立危险因素[6-7]。文献报道,行肾脏及脊柱肿瘤手术的患者若术前合并低蛋白血症,其围术期具有较高的异体输血风险[8-9]。受肿瘤生长消耗及营养摄入不足等因素的影响,约40%的卵巢癌患者确诊时血浆白蛋白水平低于40 g/L[10]。
鉴于卵巢癌患者具有较高的低蛋白血症风险及肿瘤细胞减灭术围术期异体输血比例,了解二者之间的关系,有助于指导优化此类患者的术前机体状态,为异体输血的预防提供新依据。本研究旨在通过回顾性研究,分析因行肿瘤细胞减灭术的卵巢癌患者术前低蛋白血症与异体红细胞输注风险的相关性,以期为临床工作提供指导。
资料与方法
1.1 研究对象
本研究为单中心回顾性队列研究。研究对象为2014年1月—2018年12月北京协和医院接受肿瘤细胞减灭术的卵巢癌患者。
纳入标准:(1)首次接受肿瘤细胞减灭术,且术后病理诊断为原发性卵巢癌;(2)国际妇产科联盟(FIGO)分期为Ⅲ~Ⅳ期。
排除标准:(1)年龄<18岁;(2)联合切除肝、脾、膀胱等器官的患者。
本研究已通过北京协和医院伦理审查委员会审批(审批号:S-K1455),并豁免患者知情同意。
1.2 研究方法
通过电子病历系统提取所有卵巢癌患者的临床资料。暴露变量为术前1周内最近一次生化检测中血浆白蛋白水平<35 g/L,结局变量为肿瘤细胞减灭术中及术后3 d内是否输注异体红细胞。
混杂变量包括年龄、体质量指数(BMI)、美国麻醉医师协会(ASA)分级(≥Ⅲ级/<Ⅲ级)、术中出血量占循环血容量比例、手术时间、新辅助化疗(是/否)、高血压(有/无)、糖尿病(有/无)、冠心病(有/无)、术前凝血功能异常(有/无)、肝肾功能异常(有/无)、贫血(有/无)。
其中凝血酶原时间或部分活化凝血酶原时间>正常值上限的1.2倍为凝血功能异常,谷丙转氨酶或直接胆红素>正常值上限的1.2倍为肝功能异常,血肌酐>正常值上限的1.2倍为肾功能异常,血红蛋白<110 g/L为贫血。
由于肿瘤细胞减灭术切除范围为全子宫、双附件、大网膜、阑尾、盆腔淋巴结和盆腹腔转移病灶,该切除范围与肿瘤原发灶大小、分化程度、组织学类型等因素均无关,故未将上述因素纳入分析。
1.3 检验效能估算
本研究拟纳入卵巢癌患者1001例,其中低蛋白血症组、无低蛋白血症组分别为64例和937例,其围术期输血率分别为84.4%和45.6%,在检验水准α为0.05的检验标准下(双侧检验),经计算检验效能为99.8%,可满足研究需求。
1.4 统计学处理
采用R 4.2.1软件进行统计学分析。年龄、BMI、手术时间等为计量资料且符合正态分布,以均数±标准差表示;红细胞输注量不符合正态分布,以中位数(四分位数)表示。ASA分级、是/否新辅助化疗、有/无糖尿病等计数资料以频数(百分数)表示。以标准均值差(SMD)评估各混杂变量在有/无低蛋白血症患者中的分布差异,SMD>0.1为差异显著。采用多因素Logistic回归法分析术前低蛋白血症与围术期异体红细胞输注风险的相关性。自变量为有/无低蛋白血症以及在有/无低蛋白血症患者中分布不均衡的混杂变量(SMD>0.1),因变量为有/无围术期异体红细胞输注。以P<0.05为差异具有统计学意义。
2 结果
2.1 一般临床资料
共入选1001例符合纳入与排除标准的卵巢癌患者,平均年龄(53.1±11.5)岁,术前低蛋白血症64例(6.4%),围术期接受异体红细胞输注481例(48.1%)。接受红细胞输注的患者中,输注量为4(4,8)U。
2.2 混杂变量的筛选
如表1所示,除BMI外,其余变量在有/无低蛋白血症患者中分布均不均衡,可能为影响低蛋白血症与围术期异体红细胞输注风险相关性的混杂变量。
表1 有/无低蛋白血症患者临床资料分布情况
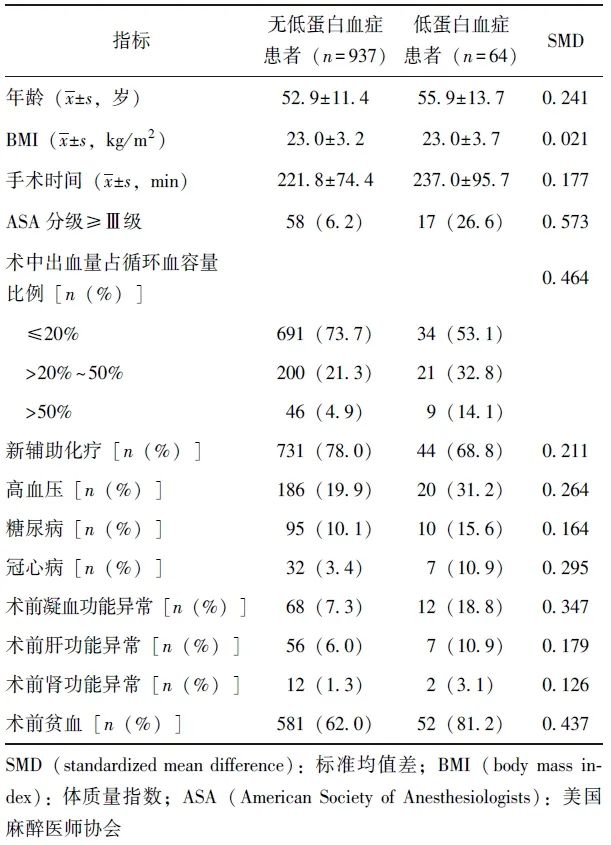
2.3 围术期异体红细胞输注与低白蛋白血症的相关性
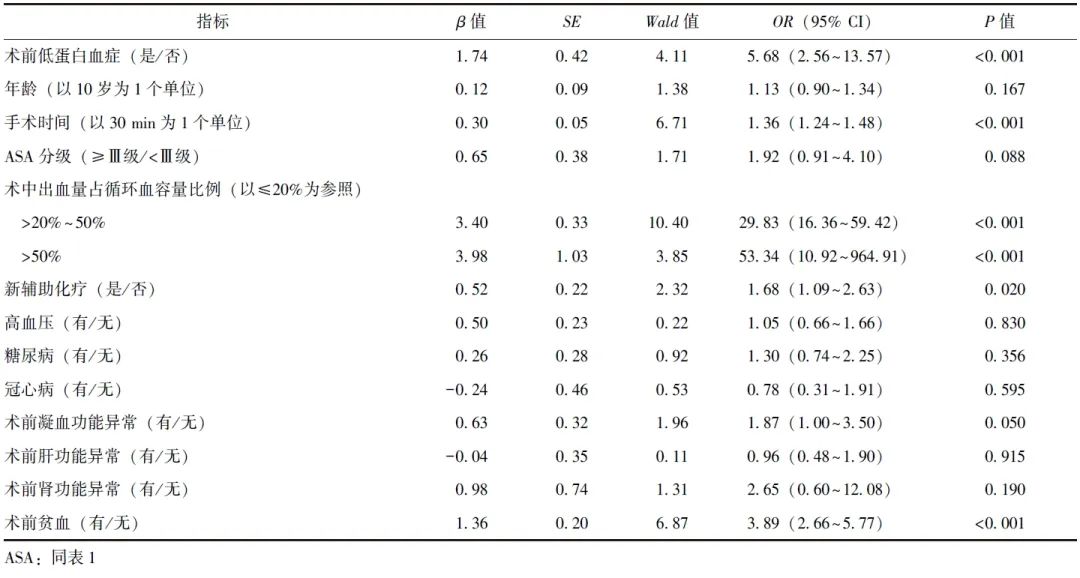
在低蛋白血症患者和无低蛋白血症患者中,异体红细胞输注率存在显著差异[84.4%(54/64)比45.6%(427/937),P<0.001],粗比值比(OR)为6.45(95% CI:3.39~13.59)。多因素Logistic回归模型校正混杂因素的影响后,术前低蛋白血症与围术期异体红细胞输注风险显著相关(OR=5.68,95% CI:2.56~13.57,P<0.001),见表2。
表2 围术期异体红细胞输注的多因素Logistic回归分析结果
3 讨论
本研究基于1001例卵巢癌患者的临床资料,首次探索了术前低蛋白血症与围术期异体红细胞输注风险的相关性,结果显示,在充分校正混杂因素的前提下,卵巢癌患者肿瘤细胞减灭术前低蛋白血症与围术期异体红细胞输注风险呈显著正相关(OR=5.68,95% CI:2.56~13.57,P<0.001),提示相较于血浆白蛋白水平正常者,术前合并低蛋白血症的卵巢癌患者术中及术后早期(3 d内)更有可能接受异体红细胞输注,故术前识别与纠正机体营养状况异常和蛋白代谢问题对于降低行肿瘤细胞减灭术卵巢癌患者围术期异体输血风险具有重要意义。
术前低蛋白血症不仅不利于创口愈合[11],且可能增加多种疾病发生风险[11-24]。对于卵巢癌患者而言,术前低蛋白血症可能是多种因素综合作用的结果,包括术前新辅助化疗、腹水、肠梗阻等原因可致患者进食减少、营养状态不佳;癌症相关慢性炎症和恶病质可引起机体蛋白质代谢紊乱、营养消耗增多[25-26]。
低蛋白水平可引起血浆胶体渗透压降低及自主神经功能紊乱,此类患者常合并有效循环血容量不足、营养不良导致的贫血,故围术期输血风险增加[8-9]。除暴露因素低蛋白血症外,本研究亦关注了其他可能与围术期输血风险相关的混杂因素[27]。
1 手术时间
随手术时间延长,围术期输血风险增加,可能原因:手术时间延长主要与盆腔粘连或肿瘤播散广泛、切除范围广泛所致的手术难度增加相关,故手术时间延长与出血量增加具有一定相关性。
2 贫血
由于营养缺乏、化疗等原因,术前贫血在卵巢癌患者中并不少见,而贫血患者对失血的耐受性较差,故术前贫血者具有较高的围术期输血风险。
3 凝血功能异常
术前凝血异常与术中红细胞输注风险相关,推测可能原因:凝血异常增加了患者术中出血的风险。
本研究校正手术时间、术前贫血与凝血功能异常等多种混杂因素的影响后,多因素Logistic回归分析显示,卵巢癌患者肿瘤细胞减灭术前低蛋白血症可增加围术期异体红细胞输注风险(OR=5.68,95% CI:2.56~13.57,P<0.001),此为在卵巢癌人群中评估低蛋白血症与围术期异体输血风险相关性的首次报道。
研究表明,在卵巢癌患者中加强围术期营养支持,有利于减少并发症风险[28]。提示在临床工作中应关注卵巢癌患者蛋白质摄入情况及营养状态的调整,以有助于降低围术期异体输血率,从而改善患者预后。
本研究优势:(1)样本量充足,统计学把握度与检验效能较高;(2)详细的病案记录和完善的临床资料使得统计学分析中可相对全面地校正混杂因素的干扰,从而更可靠地评估低蛋白血症与围术期输血风险之间的关联性[8-9]。
本研究局限性:(1)为回顾性队列研究,无法进行确切的因果关系推断,故仍不能确定低蛋白血症为导致卵巢癌患者围术期输血风险增加的原因[12,29];(2)为单中心研究,研究结果推广至其他中心时需谨慎;(3)未纳入原发灶大小、肿瘤分期等混杂因素,虽然上述因素与肿瘤细胞减灭术切除范围无关,但可能与低蛋白血症相关,以致研究结果可能存在一定偏倚。
综上,因卵巢癌行肿瘤细胞减灭术患者术前低蛋白血症可增加围术期异体红细胞输注风险,临床应增加对此类患者术前低蛋白血症的关注度和识别能力,以期有助于减少围术期输血。鉴于本研究存在一定的局限性,未来仍有必要开展前瞻性多中心大样本研究,以期为术前低蛋白血症与卵巢癌围术期输血风险相关性的确定提供更高级别循证医学证据。
参考文献
[1]Prescott L S, Aloia T A, Brown A J, et al. Perioperative blood transfusion in gynecologic oncology surgery: analysis of the National Surgical Quality Improvement Program Database[J]. Gynecol Oncol, 2015, 136(1): 65-70.
[2]Weber R S, Jabbour N, Martin R C G 2nd. Anemia and transfusions in patients undergoing surgery for cancer[J]. Ann Surg Oncol, 2008, 15(1): 34-45.
[3]Carson J L, Stanworth S J, Roubinian N, et al. Transfusion thresholds and other strategies for guiding allogeneic red blood cell transfusion[J]. Cochrane Database Syst Rev, 2016, 10(10): CD002042.
[4]Bolton-Maggs P H B. SHOT conference report 2016: serious hazards of transfusion-human factors continue to cause most transfusion-related incidents[J]. Transfus Med, 2016, 26(6): 401-405.
[5]Goldman M, Webert K E, Arnold D M, et al. Proceedings of a consensus conference: towards an understanding of TRALI[J]. Transfus Med Rev, 2005, 19(1): 2-31.
[6]李鑫, 张国炜, 万江涛, 等. 术前低白蛋白血症与后路腰椎融合术后不良结局发生率的相关性[J]. 中国临床解剖学杂志, 2022, 40(4): 485-490.
[7]Phan K, Ranson W, White S J W, et al. Thirty-day perioperative complications, prolonged length of stay, and readmission following elective posterior lumbar fusion associated with poor nutritional status[J]. Global Spine J, 2019, 9(4): 417-423.
[8]Kim K, Seo H, Chin J H, et al. Preoperative hypoalbuminemia and anemia as predictors of transfusion in radical nephrectomy for renal cell carcinoma: a retrospective study[J]. BMC Anesthesiol, 2015, 15: 103.
[9]De la Garza Ramos R, Gelfand Y, Benton J A, et al. Rates, risk factors, and complications of red blood cell transfusion in metastatic spinal tumor surgery: an analysis of a prospective multicenter surgical database[J]. World Neurosurg, 2020, 139: e308-e315.
[10]Conrad L B, Awdeh H, Acosta-Torres S, et al. Pre-operative core muscle index in combination with hypoalbuminemia is associated with poor prognosis in advanced ovarian cancer[J]. J Surg Oncol, 2018, 117(5): 1020-1028.
[11]Bohl D D, Shen M R, Kayupov E, et al. Hypoalbuminemia independently predicts surgical site infection, pneumonia, length of stay, and readmission after total joint arthroplasty[J]. J Arthroplasty, 2016, 31(1): 15-21.
[12]胡俊, 袁瑞, 王琴. 术后低蛋白血症与补充人血白蛋白对卵巢癌手术切口愈合不良的影响[J]. 重庆医学, 2023, 52(15): 2320-2325.
[13]陈月芬, 马玉燕. 低蛋白血症与子痫前期的发生和发展[J]. 中国计划生育和妇产科, 2021, 13(2): 10-12.
[14]Newman J M, Sodhi N, Khlopas A, et al. Malnutrition increases the 30-day complication and re-operation rates in hip fracture patients treated with total hip arthroplasty[J]. Hip Int, 2020, 30(5): 635-640.
[15]Kamath A F, Ong K L, Lau E, et al. Quantifying the burden of revision total joint arthroplasty for periprosthetic infection[J]. J Arthroplasty, 2015, 30(9): 1492-1497.
[16]戴仲, 李莉, 严静. 白蛋白用于液体复苏的研究进展[J]. 实用医学杂志, 2015, 31(20): 3442-3443.
[17]Vincent J L, Dubois M J, Navickis R J, et al. Hypoalbuminemia in acute illness: is there a rationale for interven-tion? A meta-analysis of cohort studies and controlled trials[J]. Ann Surg, 2003, 237(3): 319-334.
[18]赵滨如, 刘惠兰. 血浆蛋白测定对评价尿毒症病人营养不良的意义[J]. 北京医学, 2000, 22(3): 168.
[19]张阳, 张立志, 李放, 等. 低蛋白血症与高龄患者腰椎融合术后并发症的相关性研究[J]. 中国骨与关节杂志, 2021, 10(4): 244-247.
[20]王婷婷, 张锦. 腹部大手术围手术期低蛋白血症的原因及治疗进展[J]. 中国医师进修杂志, 2020, 43(6): 569-572.
[21]王燕. 低蛋白血症与复发性脑梗死的相关性研究[J]. 中西医结合心脑血管病杂志, 2019, 17(2): 282-284.
[22]Shah N R, Dumler F. Hypoalbuminaemia--a marker of cardiovascular disease in patients with chronic kidney disease stages Ⅱ-Ⅳ[J]. Int J Med Sci, 2008, 5(6): 366-370.
[23]Staples A O, Greenbaum L A, Smith J M, et al. Association between clinical risk factors and progression of chronic kidney disease in children[J]. Clin J Am Soc Nephrol, 2010, 5(12): 2172-2179.
[24]Inker L A, Coresh J, Levey A S, et al. Estimated GFR, albuminuria, and complications of chronic kidney disease[J]. J Am Soc Nephrol, 2011, 22(12): 2322-2331.
[25]王元芬, 窦莎, 朱崇元, 等. 可吸收防粘连纤维膜对卵巢癌患者术后盆腔淋巴囊肿形成的影响[J]. 现代妇产科进展, 2022, 31(12): 906-910.
[26]Dickerson R N, White K G, Curcillo P G 2nd, et al. Resting energy expenditure of patients with gynecologic malignancies[J]. J Am Coll Nutr, 1995, 14(5): 448-454.
[27]Cham S, Chen L, St Clair C M, et al. Development and validation of a risk-calculator for adverse perioperative outcomes for women with ovarian cancer[J]. Am J Obstet Gynecol, 2019, 220(6): 571.e1-571.e8.
[28]Wu Y, Mu J, Cao J, et al. Research status and progress of nutritional support therapy for ovarian cancer[J]. Nutr Cancer, 2022, 74(5): 1519-1526.
[29]杜权, 张华云, 汤红英. 严重低蛋白血症卵巢癌根治术后诱发急性肺水肿1例[J].陆军军医大学学报, 2000, 22(1): 52.
作者:协和医学杂志
版权声明:
本网站所有注明“来源:梅斯医学”或“来源:MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明“来源:梅斯医学”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言











#卵巢癌# #肿瘤细胞减灭术# #低蛋白血症# #围术期异体红细胞输注#
70