仅携带TP53突变的肺腺癌,有什么样的临床病理及分子特征?
2024-02-20 苏州绘真医学 苏州绘真医学
研究者对844例经细针穿刺诊断的肺腺癌进行了二代测序(NGS)。其中,14例(1.7%)患者仅携带TP53变异,研究者对其进行了综合分析。
TP53突变见于约50.8%的肺腺癌,常合并其他基因变异。但也有少数患者仅携带TP53突变。研究者对844例经细针穿刺诊断的肺腺癌进行了二代测序(NGS)。其中,14例(1.7%)患者仅携带TP53变异,研究者对其进行了综合分析。
14例(1.7%)仅携带TP53变异的患者诊断时的平均年龄为65.7岁(范围48-79岁),男性9例,女性5例。所有吸烟者的吸烟量平均为40.7包/年(范围10-70)。10例出现转移,主要发生在大脑(n=4)和胸膜(n=4)。在长达102个月的随访期后,9例死亡,3例无病生存,1例带病生存,1例失访。中位生存期为12.2个月。大多数肿瘤表现出低分化,由具有中度至重度异型性、核分裂象增加和坏死背景的实性片组成。其中一半的患者TTF‐1阳性并显示p53过表达。5例PD‐L1阳性。大多数变异为外显子5-8的错义突变,这种突变类型与p53过表达相关。错义突变合并截短蛋白的肿瘤具有较高的PD‐L1表达,并有肿瘤突变负荷(TMB)增加的趋势。意义不明的CEBPA缺失是最常见的拷贝数变异。
仅TP53突变与吸烟、高级别细胞形态学特征、不良预后和常见的CEBPA缺失相关。这些肿瘤倾向于PD‐L1高表达和高TMB,提示免疫检查点抑制剂可能有益。因此,识别这一分子亚组具有预后和治疗意义。
研究背景
非小细胞肺癌(NSCLC)具有异质性的组织学和分子特征。随着靶向小分子单克隆抗体治疗的出现,分子分析已成为肺腺癌检查的重要组成部分。靶向治疗的常见驱动突变基因为EGFR、KRAS和ALK。一些NSCLC存在TP53突变,要么与其他驱动突变同时存在,要么单独存在。TP53突变见于23%-65%的NSCLC和高达50.8%的肺腺癌。大多数TP53突变发生在热点区域,即外显子5-8中的DNA结合区。这些突变通常是导致失活的错义或无义突变。同时存在TP53突变的NSCLC生存期恶化,对化疗和放疗的应答较差。一部分仅携带TP53突变的肺腺癌表现出高级别胎肺样形态,也有少数具有普通腺癌形态的NSCLC病例仅携带TP53突变作为分子变异。
TP53变异在小细胞肺癌(>90%),鳞状细胞癌(81%)和肺腺癌(40%-46%)中被描述,主要与其他驱动突变和当前或既往吸烟者相关。在文献中,所有关于TP53突变肺腺癌的研究都是在其他共突变的情况下进行的。从未研究过在无其他驱动突变的情况下,仅TP53突变的临床和诊断意义。本研究旨在描述具有单独TP53突变的肺腺癌的临床、细胞形态学和分子特征,提供迄今为止关于具有单独TP53突变肺腺癌的最大系列研究。研究还旨在探索每种TP53突变类型的临床和分子谱,以及其对p53蛋白功能的后续影响。
研究结果
患者的临床特征:
2016年1月至2021年1月经细胞学诊断的844例肺腺癌患者中,14例(1.7%)仅携带TP53突变。表1总结了这些患者的临床特征。确诊时的平均年龄为65.7岁(范围48-79岁),男性9例(64.3%),女性5例(35.7%)。所有吸烟者的吸烟量平均为40.7包/年(范围10-70)。多数患者有咳嗽(n=6)、呼吸困难/气促加重(n=6)、咯血(n=3)等呼吸道症状。2例患者有无关症状,因四肢肿胀(n=1)和血尿伴右侧疼痛(n=1)而进行影像学检查,偶然发现肺肿块。临床分期以IV期最多(n=5),其次为IIIA期(n=3)和IIIB期(n=2)。IV期患者出现脑转移2例,胸膜/胸腔积液转移2例,对侧肺转移1例,远处脏器转移2例,远处淋巴结转移2例。肿瘤平均直径为3.7cm(1.3-8.1cm),其中8例(57.1%)位于右肺,6例(42.9%)位于左肺。
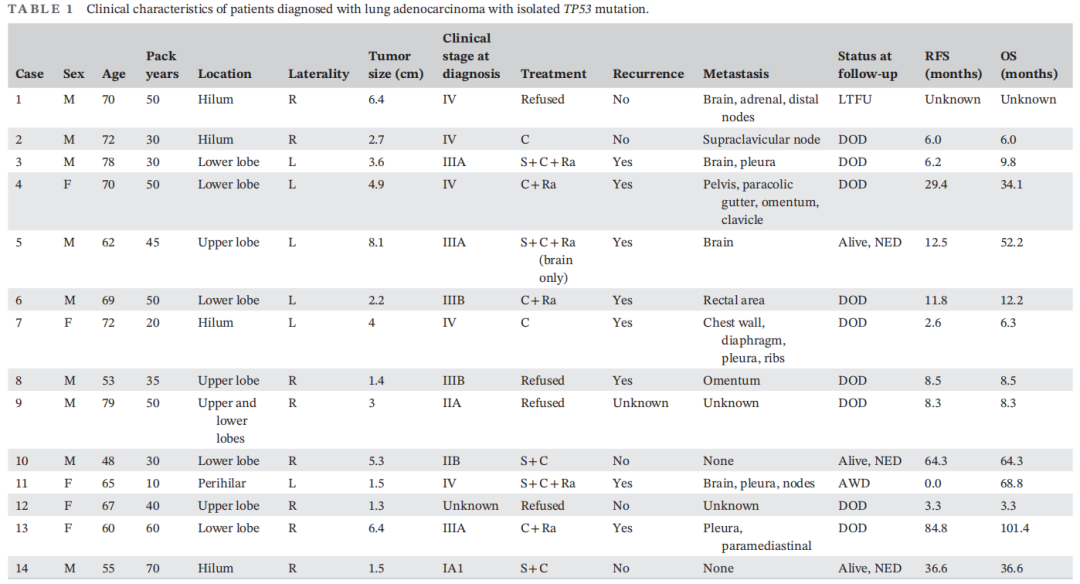
表1
确诊后10例接受治疗,4例拒绝任何形式的治疗。接受治疗的10例患者均接受化疗(71%),最常见的治疗方案是铂类(顺铂、卡铂)和培美曲塞的联合治疗(n=7)。4例患者接受了免疫检查点抑制剂联合铂类化疗,免疫检查点抑制剂包括帕博利珠单抗(n=3)和伊匹木单抗/纳武利尤单抗(n=1)。6例接受了放疗,其中1例仅接受了脑部放疗。5例接受了肺部肿瘤的手术切除,其中2例分别在术后6.2个月和84.8个月出现局部复发。出现复发的其他4例患者:2例在胸腔积液,1例在脑,1例在腹膜/大网膜。中位无进展生存期为8.4个月(范围0-84.8个月)。经过3个月至8年不等的随访期,9例患者死于疾病,3例无病生存,1例疾病稳定生存,1例失访。中位总生存期为12.2个月(3.3~101.4个月)。
细胞形态学:
这些病例的细胞形态学特征见图1。低分化10例,中分化4例。多数病例(n=7)可见片状或成簇的异型细胞。4例具有腺泡和腺体形成灶,罕见细胞显示胞浆内粘蛋白。所有病例均可见单个明显异型的肿瘤细胞。11个病灶表现为轻中度慢性炎症背景,3个病灶表现为坏死背景。所有病例均未显示胎儿肺样细胞形态或结构。所有肿瘤均表现出高核质比(N∶C),细胞核深染增大,以及中度到显著的核多形性。肿瘤细胞染色质不均匀、粗颗粒的染色质、核膜不规则,核内包涵体少见。常可见核分裂象。细胞形态学特征与活检和/或切除标本的主要组织学特征相关。
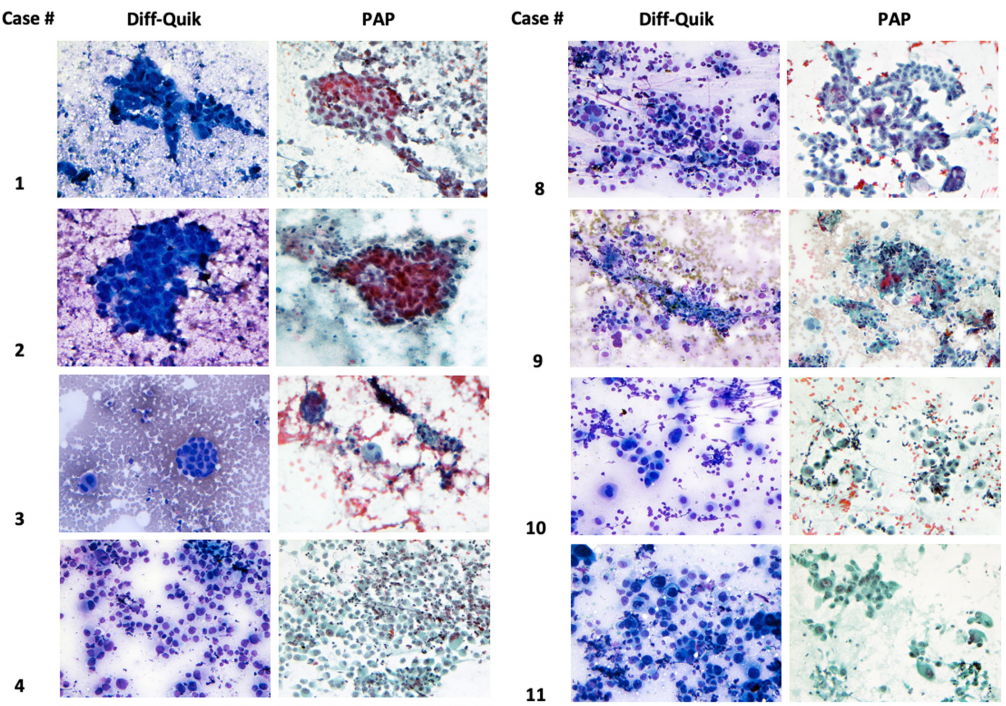
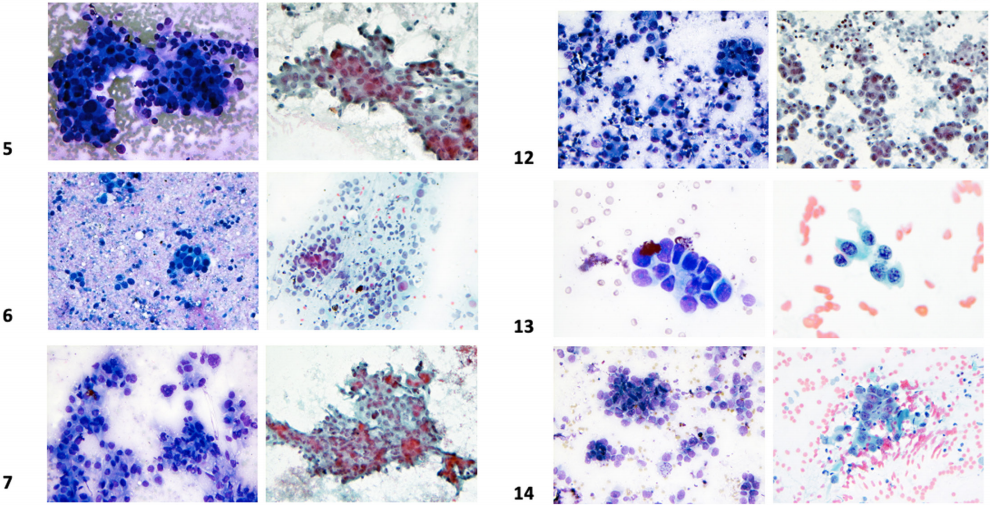

图1
免疫组化:
正如预期的那样,所有病例CK7呈阳性(n=14),大多数病例CK20呈阴性(n=11)。1例CK20强阳性表达,2例呈斑片状染色。TTF‐1仅在50%的病例中呈阳性,而CDX2在2例肿瘤中表达。1例突触素和嗜铬粒蛋白局灶性表达。所有病例SALL4均为阴性。在7个(50%)肿瘤(50%)中观察到细胞核p53表达增加(>70%的细胞核),而其余肿瘤显示弱斑片状的细胞核染色(野生型)。5例(35.7%)呈PD‐L1阳性,在50%~100%的肿瘤细胞中呈中至强表达。
分子分析:
对淋巴结转移灶(n=8)和肺部原发灶(n=6)进行NGS检测。TP53基因突变类型多样,主要位于外显子5-8(n=8)。IARC TP53数据库显示,大多数突变为错义突变(n=8),部分为无义突变(n=2)、移码突变(n=2)和缺失或插入-缺失突变(n=2)。大多数突变(n=7)为置换突变(嘌呤变为嘧啶,或嘧啶变为嘌呤)。这些突变通常会影响p53功能,导致功能丧失或活性降低(n=11)和显性失活(n=1)。值得注意的是,有1个突变导致功能增加效应,和1个外显子6的缺失具有未知活性(n=1)。突变主要位于TP53基因第5号外显子(n=5),其次为第4号外显子(n=3)和第8号外显子(n=2)。1例肿瘤显示第2、3号外显子和第4外显子的一半发生突变。
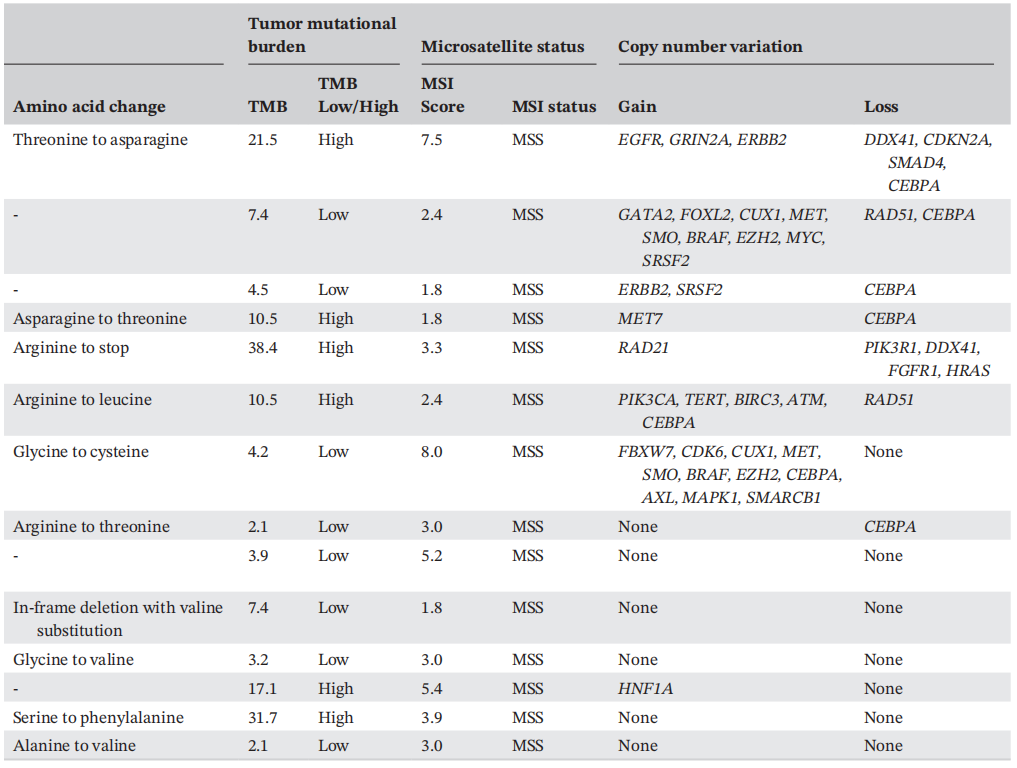
表3
平均肿瘤突变负荷(TMB)为11.7 mut/Mb(范围2.1-38)。使用高TMB的机构阈值10 mut/Mb, 8个肿瘤(57.1%)为低TMB, 6个肿瘤(42.9%)为高TMB。所有肿瘤微卫星稳定,平均微卫星不稳定性(MSI)评分为3.7(范围为1.8-8.0)。
在9个肿瘤中观察到意义未明的拷贝数变异(VUS),其中6个同时存在扩增和缺失(表2)。8个肿瘤有1-11个基因扩增(平均4.1个)。虽然没有观察到频繁地基因扩增,但以下基因在两个肿瘤样本中扩增:MET、SMO、ERBB2、BRAF、EZH2、SRSF2、CUX1和CEBPA。7个肿瘤存在基因缺失,缺失基因数为1-4个(平均2个),其中5个肿瘤存在CEBPA缺失(19号染色体)。其他常见的拷贝数丢失基因包括RAD51(n=2)和DDX41(n=2)。

表2
相关性:
p53过表达与错义突变类型相关(p=0.003),因为在IHC显示p53过表达的7个肿瘤中,有6个存在TP53错义突变。此外,错义突变合并蛋白截短的肿瘤与较高比例的PD‐L1表达相关(p=0.035)。
TP53变异类型和TMB之间没有显著的相关性(分类数据和连续数据分别为p=0.533和p=0.573)。有错义突变的肿瘤平均TMB为7.3 mut/Mb(范围2.1-31.7),而无错义突变的肿瘤平均TMB为13.1 mut/Mb(范围3.9-38.4)。然而,根据突变的后续效应进行分类时,错义突变导致p53蛋白截短的肿瘤的平均TMB(17.4 mut/Mb)高于非错义突变的肿瘤(12.2 mut/Mb)。在DNA结合结构域发生变异的肿瘤中也观察到同样的模式——那些有错义突变的肿瘤的平均TMB(8.5 mut/Mb)高于那些有非错义突变的肿瘤(5.9 mut/Mb)。
讨 论
本研究描述了具有单独TP53突变肺腺癌的临床、细胞形态学、免疫组织化学和分子特征。所有患者均为吸烟者,大多数患者就诊时已发生转移,后来死于该病。肿瘤细胞形态多为低分化,少数可见明显腺样分化灶。所有病例均表现为高级别肿瘤形态,具有细胞核明显增大和多形性、高N∶C比值以及核分裂象增多。仅在一半的病例中观察到p53过度表达和TTF-1阳性,而在超过三分之一的肿瘤中PD-L1呈强阳性。大多数肿瘤存在TP53错义突变,错义突变类型与p53过表达相关。导致p53蛋白截短效应的错义突变与PD‐L1阳性和较高的TMB相关。在肿瘤队列中观察到CEBPA的频繁丢失。
TP53变异在肺癌中已有报道,在小细胞癌(>90%)和鳞状细胞癌(81%)中发生率最高,这两种亚型都与长期吸烟密切相关。TP53突变见于约40%-46%的肺腺癌,主要与其他驱动突变和当前吸烟者或既往吸烟者相关。在吸烟者和从不吸烟者之间,肺腺癌中TP53变异的频率和类型不同。事实上,吸烟者发生TP53突变的风险是非吸烟者的3-4倍。本研究队列的临床特征进一步支持了吸烟和TP53突变之间的关联,所有研究队列均为既往或当前吸烟者。此外,这些肿瘤中最常见的变异涉及置换突变,这是吸烟者中已知的碱基变化,并且与暴露于烟草中发现的致癌物密切相关。
虽然大多数研究提示有TP53突变的肺腺癌预后较差,并且对化疗和放疗更耐药,但其他研究报告TP53突变状态的预后价值不明确。Zhao等人的一项研究基于转录组学特征开发了p53缺失评分,并考虑了p53缺失肺腺癌中发现的差异基因特征。结果表明,p53缺失评分是无复发生存期的预测因素,评分高与生存期差相关。p53缺失与转录组变异和随后的不良临床结局之间的关联强调了p53在多种基因途径调节中的重要作用。最近的研究还表明,p53突变可导致microRNA的异常和表观遗传学的改变。本研究的肺腺癌队列进一步证实,仅因TP53突变就可发生具有不良临床结局的癌变。本研究中的大多数患者被诊断为临床晚期并死于该病,与文献中发表的数据(分别为12个月和39个月)相比,中位无复发生存期(8.5个月)和总生存期(12.2个月)较短。
在这一队列中,一个意义未明、反复出现的分子变异是在5个肿瘤中的CEBPA缺失。CCAAT/增强子结合蛋白α(CEBPA)变异在血液系统恶性肿瘤中较常见,CEBPA突变与儿童和成人急性髓系白血病预后改善相关。在实体瘤中,CEBPA变异最常见于肺腺癌,主要包括突变,然后是扩增、错义、移码、插入和缺失。在细胞培养中,当CEBPA转录因子功能完全并过表达时,CEBPA转录因子通过抑制上皮-间充质转化和Wnt/β-连环蛋白通路来抑制肺腺癌的迁移和侵袭。在TP53突变的肺腺癌中CEBPA的频繁缺失可能为这些肿瘤的侵袭性临床行为和相关的不良预后提供了一个重要的机制。
本研究中大多数肺腺癌存在TP53错义突变,对标本的主要影响多为功能缺失或活性降低。TP53功能缺失已被证实是肺腺癌肿瘤进展的一个重要组成部分。最常见的突变位点是外显子5,其次是外显子4和外显子8。外显子5突变已被证明与较短的生存期相关,但主要发生在肺鳞状细胞癌中。外显子8也与不良预后和淋巴结转移相关。值得注意的是,TP53外显子4突变已被证明是一个有前景的预测和预后指标,但主要是对于有相关EGFR突变的肺癌。此外,一个病例显示了功能获得性p53活性的突变。这种现象已经在几种癌症类型中报道过,p53的构象变化使其能够与新的转录因子相互作用,如p63、p73、NF-Y、Sp1、NF-κB、ATM和SMADS,从而改变转录、细胞周期、癌细胞的凋亡和代谢。这些机制支持p53突变可促进肿瘤发生、进展、转移甚至治疗耐药的推测。
在本研究中,大多数肿瘤的细胞形态学为低分化,所有病例均显示高级别细胞形态学特征。据报道,p53突变在低分化癌中有较高的发生率,并促进形成干细胞样的转录特征。据报道,野生型p53可抑制一些肿瘤干细胞标志物的表达,包括CD44、c‐Kit、NANOG和OCT4。p53功能的丧失将导致这种抑制作用的丧失,从而导致分化不良的形态和增强的放化疗耐药。
在本研究中,只有一半的肺腺癌肿瘤呈TTF‐1阳性。虽然TTF‐1的表达是肺腺癌的特征,但值得注意的是,TTF‐1仅在高达80%的肺腺癌中呈阳性表达。肺腺癌中TTF‐1阴性表达与较差的预后相关。如之前报道的那样,本研究中的TTF‐1表达缺失可能继发于潜在的TP53突变导致的组织学分化不良。
尽管NGS检测到TP53变异,但只有一半的肿瘤有异常的p53核表达,其中大多数为错义突变。p53的免疫组织化学染色被认为可以可靠地预测不同类型肿瘤的TP53突变,总体准确率为91%-97%。然而,解释参数可能有很大差异。p53不一致的免疫表型和基因型背后的可能机制包括样本偏倚、肿瘤异质性和p53降解延迟。在本研究中,由于所有的p53免疫组化都是在酒精固定的细胞学标本上进行的,因此一些标本的不理想固定也可能是染色不一致的一个来源。在p53表达增高的3例中,50%-70%的肿瘤细胞有中度至强的PD‐L1表达。值得注意的是,这三个病例都有错义突变。
先前的研究已证实TP53突变与PD-L1表达之间的关联。然而,最近的一份报告发现,只有TP53错义突变与对免疫检查点抑制剂的较好应答相关。同一项研究还表明,TP53错义突变与免疫治疗应答的其他预测因素(如 PD-L1 水平、TMB 和新抗原水平升高)之间存在关联。本研究同样观察到TP53错义突变和PD‐L1表达之间的显著相关性。虽然差异无统计学意义,但在错义突变合并p53蛋白截短的肿瘤中均观察到TMB增加。虽然这些观察结果受到该队列中病例数量少的限制,但在预后和临床免疫治疗决策中,需要进一步对TP53相关性进行临床验证。Assoun等人研究了接受免疫检查点抑制剂治疗的晚期NSCLC患者。他们观察到,携带TP53突变的肿瘤患者的无进展生存期和总生存期显著较长。
如前所述,本研究的一个局限性是病例数少。由于单独TP53突变在肺腺癌中仍然是罕见的事件,因此可能需要开展多机构研究来扩大对这种肺肿瘤中单独TP53突变的临床、治疗和预后影响的研究。
综上所述,在肺腺癌中,单独TP53突变是一种罕见的事件。研究观察到这一唯一的致病性分子事件与吸烟、不良细胞形态学特征、不良预后和频繁出现地CEBPA缺失相关。本研究结果表明,在肺腺癌中,单独的TP53突变可能具有致癌驱动的能力,其单独存在可能足以触发肺肿瘤的不良预后特征。虽然这些肿瘤倾向于强PD‐L1表达和高TMB,尤其是那些有TP53错义突变的肿瘤,但需要更大样本量的前瞻性研究来进一步探索免疫检查点抑制剂和其他靶向治疗的良好反应的可能性。因此,认识肺腺癌中这一独特分子亚组具有预后和治疗意义。
参考文献:
Mendoza, Rachelle P et al. “Lung adenocarcinomas with isolated TP53 mutation: A comprehensive clinical, cytopathologic and molecular characterization.” Cancer medicine, 10.1002/cam4.6873. 2 Jan. 2024, doi:10.1002/cam4.6873

作者:苏州绘真医学
版权声明:
本网站所有注明“来源:梅斯医学”或“来源:MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明“来源:梅斯医学”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言









#肺腺癌# #TP53#
85
不错,学习了。
65