Blood:基因编辑可治疗G6b-B突变导致的先天性巨血小板减少症&局灶性骨髓纤维化
2018-06-15 MedSci MedSci原创
中心点:常染色体隐性遗传的G6b-B基因功能丧失性突变(MPIG6B)可导致先天性巨血小板减少症合并局灶性骨髓纤维化(cMTFM)。G6b-B可调控人类和小鼠的巨核细胞和血小板生成及其功能。摘要:与成人原发性骨髓纤维化(PMF)不同,儿童骨髓纤维化罕见。既往已发现先天性(遗传型)骨髓纤维化(cMF)的存在,但其潜在遗传机制尚不明确。近日,Blood杂志上发表了一篇相关文章。研究人员发现四个常染色体
中心点:
常染色体隐性遗传的G6b-B基因功能丧失性突变(MPIG6B)可导致先天性巨血小板减少症合并局灶性骨髓纤维化(cMTFM)。
G6b-B可调控人类和小鼠的巨核细胞和血小板生成及其功能。
摘要:
与成人原发性骨髓纤维化(PMF)不同,儿童骨髓纤维化罕见。既往已发现先天性(遗传型)骨髓纤维化(cMF)的存在,但其潜在遗传机制尚不明确。近日,Blood杂志上发表了一篇相关文章。
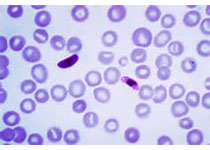
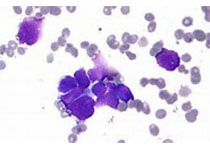
研究人员发现四个常染色体隐性遗传的巨血小板减少症合并局灶性骨髓纤维化的家系,其发病原因系生殖细胞的包含巨核细胞特异性免疫受体酪氨酸抑制模体(ITIM)的受体G6b-B发生功能丧失性突变(G6b,C6orf25或MPIG6B)。患者表现为轻到中度的出血倾向、巨血小板减少症、贫血、白细胞增多和骨髓纤维化。
除了鉴定致病基因外,G6b-B作为突变蛋白的描述潜在的暗示了骨髓纤维化的发病机制中存在异常的G6b-B巨核细胞信号转导和激活。
将人类G6b基因靶向插入小鼠基因组可挽救敲除表型和所观察到的人G6b-B表达的拷贝数效应。纯合插入小鼠表达25%的人G6b-B、血小板计数稍有下降、血小板功能轻度异常;而对于杂合小鼠,仅表达12%的人G6b-B,上述表型更为严重。
本研究表明G6b-B是人类和小鼠血小板稳态的关键调控因子。表达人G6b的小鼠模型为我们进一步研究人类G6b-B的生理功能、检测靶向该受体的药物效价提供重要机会。
原始出处:
Inga Hofmann, et al. Congenital macrothrombocytopenia with focal myelofibrosis due to mutations in human G6b-B is rescued in humanized mice. Blood 2018 :blood-2017-08-802769; doi: https://doi.org/10.1182/blood-2017-08-802769
本文系梅斯医学(MedSci)原创编译,转载需授权!
作者:MedSci
版权声明:
本网站所有注明“来源:梅斯医学”或“来源:MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明“来源:梅斯医学”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言
小提示:本篇资讯需要登录阅读,点击跳转登录




#局灶性#
49
#巨血小板减少症#
25
#血小板减少#
34
#先天性#
27
学习学习再学习
64