NEJM:抗BDCA2抗体Litifilimab对系统性红斑狼疮的治疗作用(LILAC研究)
2022-09-08 MedSci原创 MedSci原创
Litifilimab(一种抗BDCA2的人源化单克隆抗体) 是一种皮下给药的人源化 IgG1 单克隆抗体,可与 BDCA2 结合,从而下调 I 型干扰素、细胞因子和趋化因子的产生。
Litifilimab(一种抗BDCA2的人源化单克隆抗体) 是一种皮下给药的人源化 IgG1 单克隆抗体,可与 BDCA2 结合,从而下调 I 型干扰素、细胞因子和趋化因子的产生。
今日进一步NEJM上进一步报道了litifilimab对系统性红斑狼疮(SLE)的疗效与安全性。
这项研究评估 BIIB059 对系统性红斑狼疮和活动性皮肤表现受试者以及皮肤红斑狼疮 (LILAC) 受试者疗效的研究,这是一项2 期、多中心、双盲、随机、对照试验,评估了litifilimab 的疗效和安全性。在这里,我们报告了 A 部分的发现,其中涉及患有活动性关节炎和皮疹的 SLE 参与者。 B 部分侧重于有或无全身性表现的皮肤红斑狼疮,在今年7月份,在NEJM上已报道,显示,从基线到第16周,CLASI-A评分的最小二乘平均值(±SE)百分比变化:50mg litifilimab组为-38.8±7.5;150mg litifilimab组为-47.9±7.4;450mg litifilimab组中-42.5±5.5;安慰剂组为-14.5±6.4,负值表明比基线时的皮肤受累程度有所改善(详细见:NEJM:抗BDCA2抗体Litifilimab 治疗皮肤红斑狼疮有效和安全)。
研究方法
筛选18 至 75 岁的成年人,符合 1997 年美国风湿病学会SLE分类标准。参与者的抗核抗体滴度为 1:80 或更高,抗双链 DNA(抗 dsDNA)抗体水平为每毫升 30 IU 或更高,或两者兼有。 如果随机分组前剂量稳定至少 4 周,则允许使用每天 20 mg 或更少剂量的泼尼松(或等效剂量的另一种糖皮质激素)。符合条件的参与者在系统性红斑狼疮疾病活动指数-2000 (SLEDAI-2K;根据是否存在 24 种症状的评分范围为 0 到 105 ([筛查时排除发热症状],0 到 <6 分表示疾病活动度低,6 到 12 分表示活动度中等,>12 表示活动度高)。
试验的 A 部分在亚洲、欧洲、拉丁美洲和美国的 55 个中心进行。 A 部分与B 部分是独立的(B部分评估了 litifilimab 治疗皮肤红斑狼疮患者的疗效)。
根据方案第 1 版入组的参与者在接受筛查和随机分组时患有活动性皮肤病。 活动性皮肤病被定义为皮肤红斑狼疮疾病区域和严重性指数-活动性(CLASI-A)21 得分为 8 分或更高,21 衡量 13 个皮肤区域的红斑和脱屑或肥大(总分范围从 0 到 70,分数越高表明狼疮皮肤病变活动越大)。
根据方案第 2 版及后续版本,经过 28 天的筛选期后,我们使用交互式响应系统以 1:1 的比例分配参与者,并根据口服糖皮质激素剂量进行分层(每天≤10 mg vs. >10 mg每天)和地理区域(亚洲 vs. 欧洲和拉丁美洲 [合并] vs. 美国),在第 0、2、4、8、12、16 周接受 450 mg 剂量的 litifilimab 或安慰剂皮下给药。参与者继续接受稳定剂量水平的背景免疫抑制治疗,并根据方案中推荐的糖皮质激素减量方案。 24 周的 litifilimab 或安慰剂方案之后是 12 周的安全性观察期。 在随机分组后 4 周开始强制逐渐减量口服糖皮质激素,一直持续到第 12 周达到每天 10 mg 或更少的目标水平,允许额外减少剂量直到第 16 周; 此后,糖皮质激素剂量保持在稳定水平。 如果 SLE 的背景治疗在随机分组前至少 12 周开始,并且从随机分组前至少 4 周到 24 周试验结束时剂量水平稳定,则允许进行背景治疗。
主要终点(最初是第 12 周 CLASI-A 评分相对于基线的百分比变化)在修订后的方案中更改为:在第 24 周时,活动关节总数相对于基线的变化(定义为肿胀关节和根据 DAS 28 关节评分)。在事后分析中,活动关节的总数被定义为肿胀和压痛的关节的总和。
评估皮肤相关疾病活动的次要疗效终点是第 24 周时 CLASI-A 评分(CLASI-50 反应)较基线下降至少 50%;第 12 周(原始主要终点)、第 16 周和第 24 周 CLASI-A 评分相对于基线的百分比变化;在第 24 周时,CLASI-A 评分从基线下降至少 4 分和至少 7 分。
在第 24 周,通过对 SLE 反应者指数 (SRI-4) 有反应的参与者的百分比来衡量总体 SLE 疾病活动的变化作为次要终点。 SRI-4 的反应被定义为减少在 SLEDAI-2K 评分中从基线至少 4 分,根据不列颠群岛狼疮评估组 (BILAG) 2004 指数 (BILAG-2004 ;将 97 个项目纳入 9 个器官评分的指数,每个器官系统的评分范围从 A [严重] 到 E [从未涉及])24,在医师综合评估 (PGA) 中没有增加 0.3 分或更多;评分在从 0 [无疾病活动] 到 3 [最大疾病] 的视觉模拟量表上),25,26 并且与协议允许的药物或药物剂量没有变化。
研究结果
该试验于 2016 年 10 月 20 日至 2019 年 11 月 18 日期间进行。共有 334 名参与者接受了筛查,其中 132 人入组; 22 人根据第 1 版方案入组(6 人分配接受剂量为 50 mg 的 litifilimab,6 人接受 150 mg litifilimab,5 人接受 450 mg litifilimab,5 人接受安慰剂)(表 S2) , 110 名参与者参加了第 2 版和后续版本的方案(59 名分配到 450-mg litifilimab 组,51 名分配到安慰剂组)。总体而言,118 名参与者完成了指定的 litifilimab 或安慰剂方案。接受 450 mg litifilimab 或安慰剂的 102 名参与者在基线时至少有 4 个触痛和至少 4 个肿胀关节,以及基线关节计数评估和至少 1 次基线后关节计数评估被纳入主要分析. 77 名接受 450 mg litifilimab 或安慰剂且基线 CLASI-A 评分至少为 8 分的参与者被纳入皮肤相关疾病活动的二次分析。所有 132 名参与者均被纳入安全性分析和其余疗效终点分析。在分配到 450 mg litifilimab 组的 64 名参与者和分配到接受安慰剂组的 56 名参与者中,分别有 91% 和 89% 的人完成了指定的治疗方案。
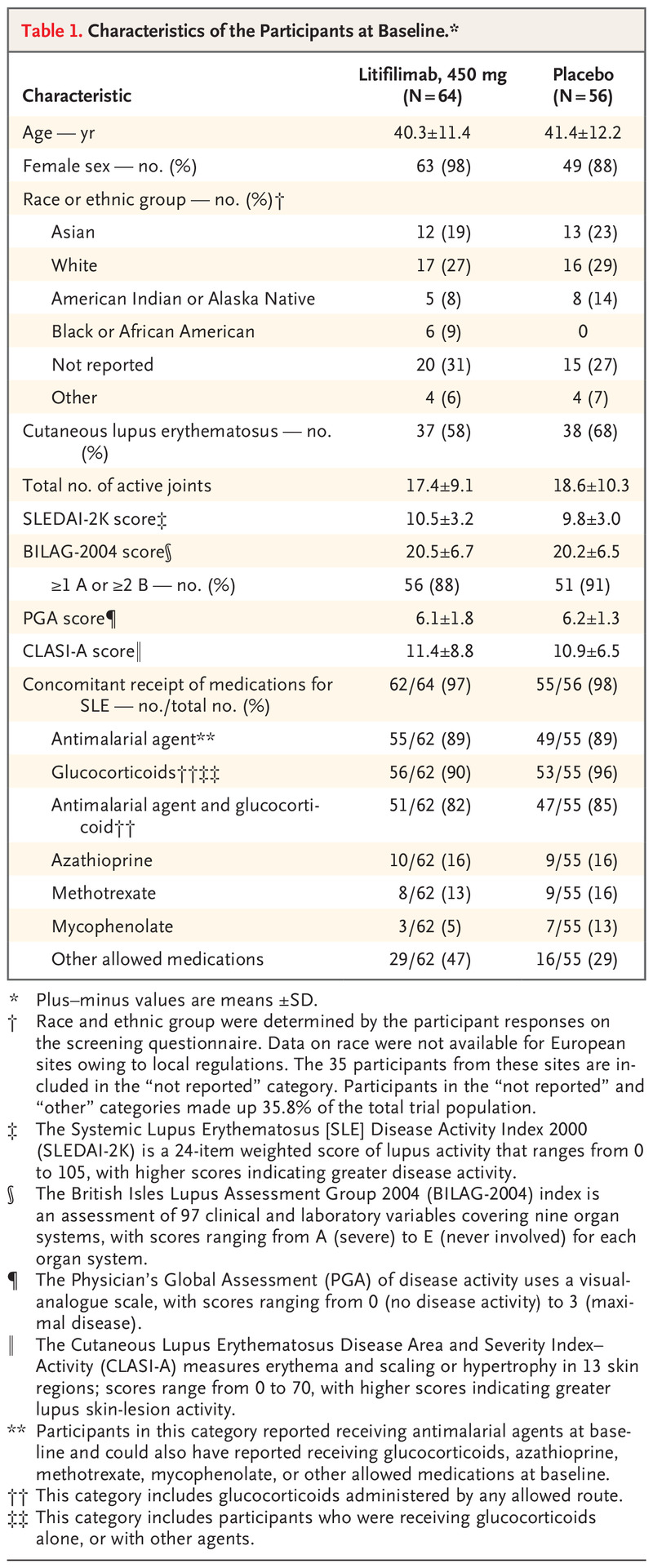
表格1 基线参与者的特征。
两组参与者在基线时的人口统计学和疾病特征基本相似(表 1),除了 litifilimab 组的女性参与者比例更高(litifilimab 组 98% vs 安慰剂组 88%)。大约 10% 的参与者是黑人或非裔美国人,他们都被随机分配到 litifilimab 组或安慰剂组;然而,由于当地法规,在欧洲站点注册的 35 名参与者 (29%) 没有报告种族和族裔群体。
主要终点
450 mg litifilimab 组和安慰剂组中主要终点的平均 (±SD) 活动关节总数为 19.0±8.4 和 21.6±8.5。在第 24 周对修订后的主要终点(表 2 和图 1)的分析显示,在 litifilimab 组中,活动关节总数与基线相比的最小二乘均值 (±SE) 绝对变化分别为 –15.0±1.2 和 –11.6安慰剂组±1.3; litifilimab 和安慰剂之间的最小二乘平均差异为 -3.4 个关节(95% 置信区间 [CI],–6.7 至 –0.2;P=0.04)。一项事后附加分析,其中活动关节的总数被重新定义为肿胀和压痛的关节总和,显示在第 24 周,最小二乘均值 (±SE) 绝对变化从基线为 –6.5±0.5。 litifilimab 组和安慰剂组 –4.9±0.6;最小二乘平均差为–1.6 个关节(95% CI,–2.9 至–0.2)(图 S3)。在一项针对主要结局的事后支持性分析中,根据试验组之间参与者性别分布的不平衡进行了调整,主要终点的最小二乘均值 (±SE) 为 -12.6±1.6 个关节,对于 litifilimab 和安慰剂为-9.7±1.5 个关节;最小二乘平均差为 -2.9 个关节(95% CI,-6.1 至 0.3)。不能从这两个事后分析的数据中得出正式的推论或结论。
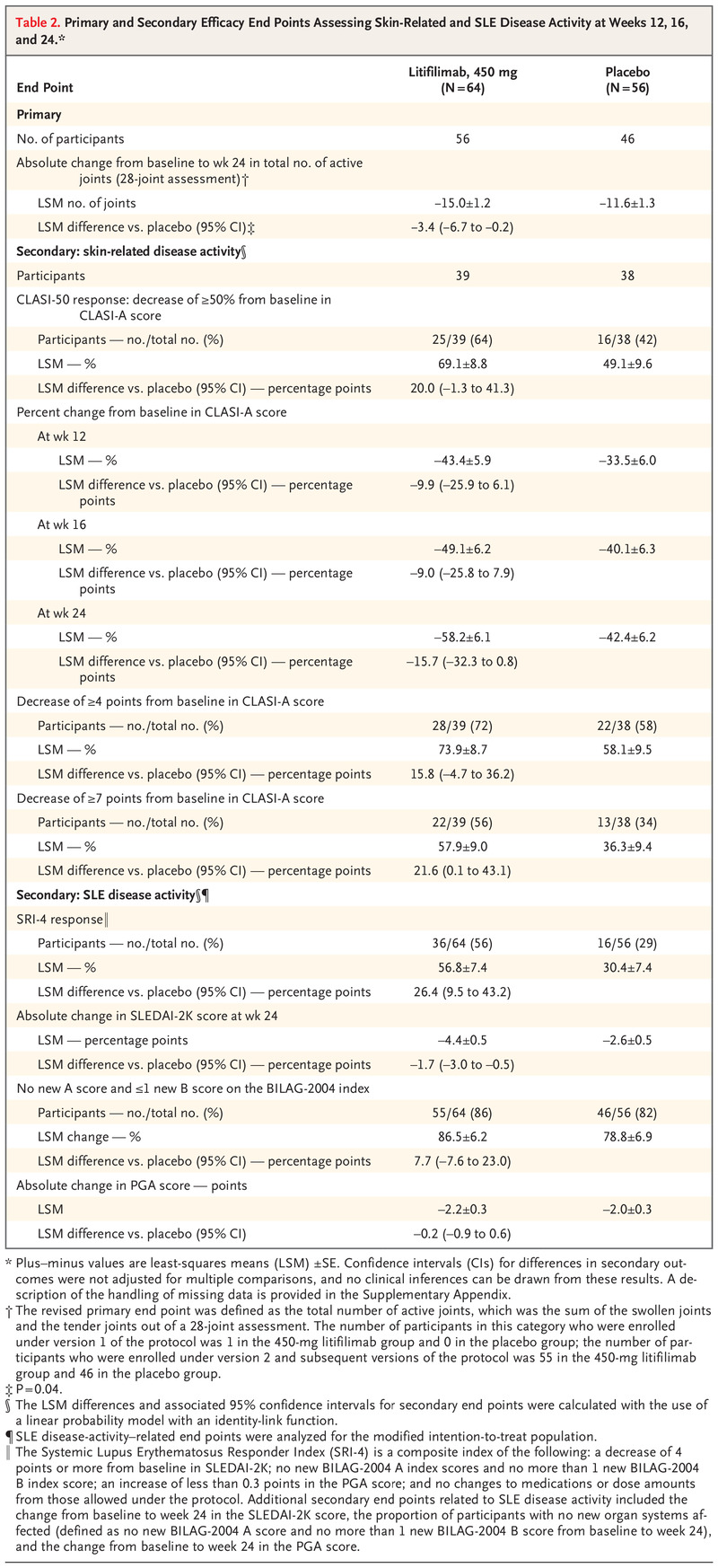
次要终点
对于除一个与皮肤相关疾病活动相关的次要终点(包括 CLASI-A 评分从基线变化的原始主要终点)之外的所有次要终点,组间差异的 95% 置信区间包括零(表 2 和S7)。在评估皮肤相关疾病活动的次要终点中,56% 的 litifilimab 组参与者和 34%安慰剂组的参与者(最小二乘均数差,21.6 个百分点;95% CI,0.1 至 43.1),但无法从这一多重性未经调整的结果中做出推论(表 2)。

对于与 SLE 疾病活动相关的次要终点,在第 24 周时,在 litifilimab 组中观察到 36 名参与者 (56%) 对 SRI-4 的反应,而在安慰剂组中观察到 16 名参与者 (29%)(最小二乘均值 差异,26.4 个百分点;95% CI,9.5 至 43.2)(表 2 和图 S4)。 图 S5 描述了第一次持续 SRI-4 响应之前的时间的事后分析。 表 2 显示了第 24 周 SLEDAI-2K 评分相对于基线的绝对变化、第 24 周没有新器官系统受影响的参与者与基线相比的比例以及第 24 周 PGA 评分相对于基线的变化。
安全性
合并 litifilimab 组的 45 名参与者(59%)和安慰剂组的 38 名参与者(68%)发生了不良事件(表 3)。 大多数不良事件为轻度或中度,由试验研究者根据试验方案中包含的严重程度定义进行评级。 最常报告的不良事件(合并 litifilimab 组中≥5% 的参与者报告)是腹泻、鼻咽炎、尿路感染、跌倒和头痛。 利替菲利单抗组报告了流感病毒感染(3例)、带状疱疹病毒感染(2例)、疱疹性角膜炎(1例)和病毒性胃肠炎(1例); 在安慰剂组中观察到带状疱疹和流感(各 2 例)(表 3 和 S18)。
研究结论
与安慰剂相比,在 24 周期间,给予 450 mg 剂量的 Litifilimab 与基线相比,肿胀和触痛关节的数量减少更多。 需要更大规模和更长的试验来确定 litifilimab 在 SLE 患者中的效果和安全性。
参考文献:
Trial of Anti-BDCA2 Antibody Litifilimab for Systemic Lupus Erythematosus.N Engl J Med 2022; 387:894-904 DOI: 10.1056/NEJMoa2118025
版权声明:
本网站所有注明“来源:梅斯医学”或“来源:MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明“来源:梅斯医学”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言








#mAb#
64
#系统性#
55
#狼疮#
67
#红斑#
60
#CA2#
55