Cancer Cell:北京基因组研究所发表癌症新文章
2014-03-25 佚名 生物通
当局部血供无法满足快速增殖肾癌细胞的需求时会引起缺氧,进而导致通常抑制肿瘤生长的核蛋白SPOP离开细胞核进入到细胞质中,在那里SPOP发挥相反的效应,促进快速增殖,由此加速了肿瘤生长。 在发表于3月20日《癌细胞》(Cancer Cell)杂志上的一篇新研究论文中,来自中科院北京基因组研究所和芝加哥大学的研究人员描述了缺氧引起SPOP过表达的新机制。他们还证实,缺氧也刺激了SPOP离开细
当局部血供无法满足快速增殖肾癌细胞的需求时会引起缺氧,进而导致通常抑制肿瘤生长的核蛋白SPOP离开细胞核进入到细胞质中,在那里SPOP发挥相反的效应,促进快速增殖,由此加速了肿瘤生长。
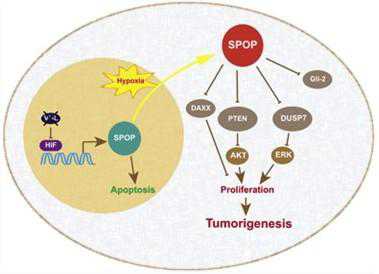
在发表于3月20日《癌细胞》(Cancer Cell)杂志上的一篇新研究论文中,来自中科院北京基因组研究所和芝加哥大学的研究人员描述了缺氧引起SPOP过表达的新机制。他们还证实,缺氧也刺激了SPOP离开细胞核进入到细胞质中,关闭了抑制肿瘤生长的保护信号通路。
中科院北京基因组研究所的刘江(Jiang Liu)研究员以及芝加哥大学基因组学与系统生物学研究所主任Kevin White是这篇论文的共同通讯作者。刘江研究员的主要研究方向包括表观遗传、干细胞和肿瘤。
“SPOP在细胞质中累积是赋予非致癌性细胞一些致癌特性的充足条件,”作者们写到。
Kevin White教授说:“这是一个恶性循环。在罹患肾透明细胞癌(ccRCC,最常见的肾癌类型)的患者体内,低氧诱导因子进入到细胞核中靶向SPOP基因。SPOP获得高表达,并错误定向到细胞质中,在那里它干扰了抑制肿瘤生长的多个系统。这促进了肿瘤生长,导致了更严重的缺氧。”
2009年,White和同事们率先确定了SPOP是肾癌的一个生物标记物。他们发现99%的肾透明细胞癌SPOP水平均升高。因此,他们开始研究SPOP生成增多与肾透明细胞癌之间的联系。
肾癌是一个重大的健康问题。它是美国第八位的常见恶性肿瘤,在2014年导致了近6.4万新增病例,近1.4万人死亡。在全球,它每年导致20多万新增病例,10万人死亡。 高死亡率与疾病发现较晚有关系。由于缺乏好的筛查检测,因此大多数的肾癌直到进入晚期出现血尿后才被确诊。在美国首次确诊时大约30%的肾透明细胞癌患者罹患转移性癌症,剩下70%的人中有近一半将会形成转移灶。这一疾病高度抵抗化疗。
研究人员希望了解错位而非突变的SPOP促成癌症生长的机制,有可能为治疗干预指明新方向。White实验室过去针对果蝇SPOP进行研究的结果表明,它是一个关键的调控中心,影响了数条癌症相关信号通路。
当研究人员将他们的焦点从果蝇转移到人类癌症时,他们发现细胞质中具有高水平的SPOP会导致深远的影响。它降解了通常发挥肿瘤生长抑制作用的多个调控蛋白。
最重要的是PTEN,这一基因在几种癌症类型中或受损或缺失。研究人员发现来自肿瘤样本的细胞持续高水平表达SPOP,低水平表达PTEN。来自同一患者的正常组织则表达低水平的SPOP,高水平的PTEN.SPOP还降解了其他几种肿瘤抑制蛋白,为快速肿瘤生长清除了另外一些障碍。
作者们写到:“这些结果清楚地证实了,SPOP是在涉及多个癌症相关信号通路的一个网络中起重要枢纽作用。在这种情况下,SPOP似乎是致癌表型的必要及充足条件。”
White说:“我们发现这一正常蛋白在错误的地方以错误方式发挥作用,是驱动肿瘤形成的充足条件。只是将SPOP置于细胞质中,我们就得到了非常大的肿瘤。但我们也看到细胞对它上瘾。当我们抑制它时,癌细胞死亡。我们希望胞质SPOP有可能成为一个极好的药物靶点。”
原始出处:
Guoqiang Li, Weimin Ci, Subhradip Karmakar, Ke Chen, Ruby Dhar, Zhixiang Fan, Zhongqiang Guo, Jing Zhang, Yuwen Ke, Lu Wang, Min Zhuang, Shengdi Hu, Xuesong Li, Liqun Zhou, Xianghong Li, Matthew F. Calabrese, Edmond R. Watson, Sandip M. Prasad, Carrie Rinker-Schaeffer, Scott E. Eggener, Thomas Stricker, Yong Tian, Brenda A. Schulman, Jiang Liusend email, Kevin P. White.SPOP Promotes Tumorigenesis by Acting as a Key Regulatory Hub in Kidney Cancer.Cancer Cell Mar
作者:佚名
版权声明:
本网站所有注明“来源:梅斯医学”或“来源:MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明“来源:梅斯医学”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言





#CEL#
40
#Cell#
36
#研究所#
49
#cancer cell#
36