靶向Trop-2用于三阴性乳腺癌重磅ADC药物在中国启动II期临床
2020-05-23 MedSci MedSci原创
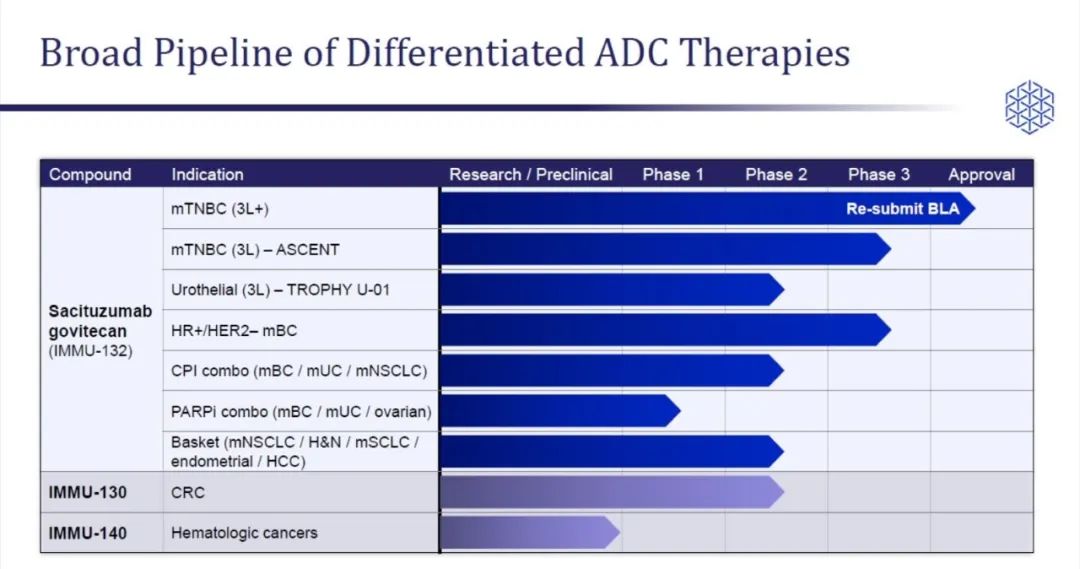
5月21日,Everest公司登记启动sacituzumab govitecan治疗接受过至少2线既往治疗的转移性三阴性乳腺癌IIb期试验。这款药物已经于2020/4/22获得FDA批准上市用于复发性
5月21日,Everest公司登记启动sacituzumab govitecan治疗接受过至少2线既往治疗的转移性三阴性乳腺癌IIb期试验。这款药物已经于2020/4/22获得FDA批准上市用于复发性或难治性三阴性乳腺癌,商品名为Trodelvy 。

来源:药物临床试验登记与信息公示平台
这是一项非随机的单臂临床试验,计划在国内15个研究机构开展,共入组80例三阴性乳腺癌患者,主要研究者为中国医学科学院肿瘤医院的徐兵河教授。研究主要目的是客观缓解率(ORR),次要目的为抗肿瘤活性,包括缓解持续时间(DOR)、临床获益率(CBR)、无进展生存期(PFS)、总生存期(OS)以及安全性和耐受性等。
sacituzumab govitecan是由Immunomedics公司开发的一款靶向Trop-2的ADC药物,2019年4月,Everest公司与其达成协议,以8.35亿美元的金额获得该药在大中华区、韩国及一些东南亚国家和地区的开发、注册和商业化权益。
Trop-2在乳腺癌、宫颈癌、结直肠癌、肾癌、肝癌、肺癌、胰腺癌、前列腺癌等多种肿瘤细胞表面大量表达,三阴乳腺癌患者的Trop-2表达率高达90%,但是Trop-2在正常组织中表达有限。因此Trodelvy可以通过特异性靶向Trop-2单抗Sacituzumab将临床常用化疗药物伊立替康的活性代谢产物govitecan(SN-38)靶向运送到实体瘤病灶,发挥化学毒性杀伤作用。
一项涉及108例既往接受过3线(中位数,范围:2~10)治疗的三阴乳腺癌患者的多中心、单臂、II期临床试验结果显示接受该药治疗的患者ORR为33.3%,中位DoR为7.7个月。
作者:MedSci
版权声明:
本网站所有注明“来源:梅斯医学”或“来源:MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明“来源:梅斯医学”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言








#I期临床#
0
#阴性乳腺癌#
32
#三阴性#
33
#II期临床#
32
#重磅#
33