Cell:华人科学家发现靶向k-ras的小分子,有望用于85%癌症
2018-01-29 转化医学平台 转化医学平台
一些基因的突变与肿瘤细胞的生长、增殖密切相关,因此,开发针对这些肿瘤细胞增殖相关的基因突变靶向药物从而能够有效阻断肿瘤细胞的增殖,进而控制肿瘤。 KRAS就是这样一个基因,在多种肿瘤中都具有突变,突变之后的KRAS促进了肿瘤的增殖,科学家们一直梦寐以求、夜以继日地开发针对这个基因突变的靶向药物,却总是无功而返。 ▲研究者们在《Cell》上面发表的文章,发现一个小分子化合物可以特异性
一些基因的突变与肿瘤细胞的生长、增殖密切相关,因此,开发针对这些肿瘤细胞增殖相关的基因突变靶向药物从而能够有效阻断肿瘤细胞的增殖,进而控制肿瘤。
KRAS就是这样一个基因,在多种肿瘤中都具有突变,突变之后的KRAS促进了肿瘤的增殖,科学家们一直梦寐以求、夜以继日地开发针对这个基因突变的靶向药物,却总是无功而返。

研究者们在《Cell》上面发表的文章,发现一个小分子化合物可以特异性地抑制KRAS(G12C)突变
最新一期国际著名期刊《Cell》杂志发表了来自华人科学家刘异博士团队的最新研究工作,他们发现一个小分子化合物能够特异性地靶向在肿瘤中KRAS(G12C)突变【1】,在体内能够抑制肿瘤生长,为广泛表达的KRAS(G12C)突变的肿瘤治疗带来了希望。
肿瘤为什么可怕
一谈到肿瘤,人人都谈癌色变!现代社会得某些癌症的风险正在增加,而总的患癌人数也呈现增加趋势。肿瘤的可怕不言而喻,患者往往痛不欲生。
但是,究竟是什么让肿瘤变得可怕大多数人恐怕一直没有深入思考过!小编在这里采用浅显的语言通俗简单讲一下。
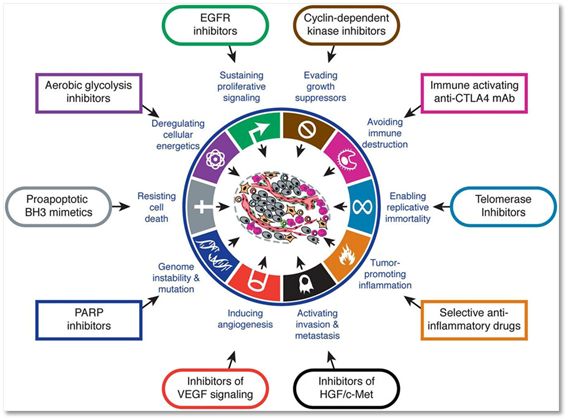
这张图大家恐怕太熟悉了,hallmarks of cancer,表示肿瘤的各种特征以及相应的干预手段(图片来自Cell)
突变让肿瘤增殖和转移
前面的内容讲增殖和转移的循环往复造就了恶性肿瘤的致命特性,然而,又是什么原因导致肿瘤的增殖和转移特性的呢?
原因相当复杂,但是若从分子层面的观察的话,恐怕追踪最初的原因得追到基因层面。
众所周知,基因突变导致肿瘤理论是目前最广泛认可的一个,肿瘤因正常细胞基因突变而来,是基因突变累积的结果。
然而,实际上,并不是所有的基因突变都会导致肿瘤,因为若是基因突变发生在内含子中,则影响不大;而即便一些基因的外显子发生突变,此时细胞也可能自动凋亡或者被免疫系统清除;或者细胞的基因突变之后,进入静息状态,乖乖地在原来的位置待着,也不增殖,也不到处跑,按兵不动,此时也没有发展成肿瘤,对人体暂时也显现不出多少危害。
然而,一些基因的突变就非常要命了。
1979和1980年间,科学家做了大量的研究,通过实验把癌细胞的基因组DNA,转入正常细胞内,就能够使正常细胞发生转化,获得癌细胞的特性。很显然,找到能够使正常细胞转化的基因成为研究的关键。1982年,癌基因H-ras被发现,而它与细胞内的正常基因-原癌基因的唯一差别,仅仅是一个DNA碱基的点突变,就赋予它诱发癌症的能力。

肿瘤2017年Nature杂志总结的研究最多的基因TOP10,P53基因排名第一
这类基因相当多,其中,最著名的恐怕就是TP53了,它是一种肿瘤抑制基因(tumorsuppressor gene)。在所有恶性肿瘤中,50%以上会出现该基因的突变。由这种基因编码的蛋白质是一种转录因子(transcriptional factor),其控制着细胞周期的启动。其他的比如排名第三的EGFR基因也在各种各样的肿瘤中存在突变。还有一些没在这个榜单上的但是异常著名的比如MYC、RAS、PTEN、BRAF等等在很多肿瘤中都广泛突变。
那么,为何这些基因突变就让肿瘤增殖了呢?
这些基因的突变,造成了编码的蛋白质氨基酸的变化,从而进一步致使蛋白质的结构发生了变化,而蛋白质结构一变化就导致了功能的变化,为何?因为分子的世界是一个结构决定功能的世界!
因此,基因(DNA)的突变最终反映到了编码的蛋白质结构变化上面,从而导致了蛋白质功能变化,比如,TP53基因突变之后,其编码的P53蛋白质可能就激活了肿瘤细胞增殖的一些酶,导致了细胞增殖(当然,P53功能太多,这里仅为举例说明一下,也可能不太严谨)。又比如BRAF激酶的V600E突变,突变之后的酶活性是没有突变的几百倍。
无药可治的KRAS
如上面所言,结构决定功能,突变基因产生突变的蛋白质,因此,这些突变的蛋白质仍然可以通过从千千万万个化合物中筛选出相应的小分子抑制它们的功能。
确实,科学家们在这方面可以说取得了前所未有的成功,比如EGFR突变,目前上市的泰瑞莎AZD9291小分子就是筛选到的专门对付EGFR(T790M)突变的;又比如BRAF(V600E)激酶抑制剂威罗菲尼(vemurafenib, PLX4032)等等。
然而,对于在癌症研究领域最为知名的致癌基因之一KRAS基因而言,科学家们就没有那么幸运了。科学家们早就发现,在多种人类癌症里,这个基因都发生了突变。然而几十年来,经过数代研发人员的不懈努力,却依然没有一款能够针对这个基因突变的有效分子。因此,KRAS突变也一度被业内认为是“无药可治”(undruggable)。
KRAS是RAS家族中的一员,目前已知的RAS家族共有三个基因:KRAS,NRAS和HRAS。在人类肿瘤中,KRAS突变是最为常见的,约占85%,NRAS和HRAS分别占12%和3%。比如在美国,死亡率最高的三种癌症(胰腺癌、结直肠癌和肺癌)也恰好是RAS突变最多见的三种癌症,分别占这三种癌症患者数的95%、52%和31%。而在乳腺癌、卵巢癌和脑癌中,RAS的突变非常少见。在胰腺癌、结直肠癌和肺癌中,KRAS突变占绝对多数。NRAS突变多见于黑色素瘤和急性骨髓性白血病,HRAS突变多见于膀胱癌和头颈癌。
既然KRAS如此难找到靶向小分子化合物,那么,若是找到能够直接靶向KRAS突变蛋白的小分子化合物对于治疗相关的肿瘤的重要性就不言而喻了。
这正是这篇重磅《Cell》文章做的事情。
2016年,多个研究团队在针对KRAS突变的小分子抑制剂开发上取得了突破。他们发现,在细胞模型中,ARS-853及其类似物能够与结合了GDP的KRAS G12C突变蛋白产生共价作用,让它转变为“失活”的构象。
然而,是否还有其他的比ARS-853活性更高的分子呢?
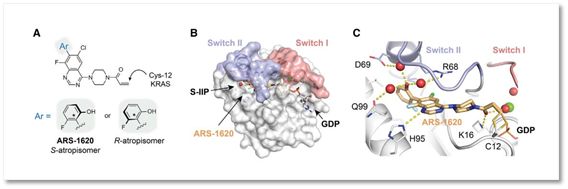
ARS-1620分子的作用机制(图片来自Cell)
研究者们于是以ARS-853系列分子为基础,重新设计并合成了众多候选分子。其中,研究者们从中发现叫做ARS-1620的小分子,它的活性是ARS-853的10倍。进一步分析显示ARS-1620主要抑制KRAS(G12C)蛋白。
采用小鼠的肿瘤模型中进一步测试了ARS-1620体内治疗小鼠肿瘤的效果,结果显示,在两个不同的浓度下,ARS-1620都能显著缩小KRAS(G12C)突变肿瘤的体积,而且缩小的幅度与用药量相关。
仍需继续研究
著名期刊《科学》杂志曾经在2017年专门发表过一篇综述文章阐述针对RAS基因的治疗方法,题目叫做:Drugging RAS: Know the enemy.文中总结了各种可能能够靶向RAS蛋白的几种思路,但指出开发RAS相关的治疗药物仍然任重而道远。
尽管这篇《Cell》文章取得了一定的进展,然而,KRAS中的G12C突变也仅仅只是KRAS基因突变中的一小部分,只占了总的KRAS突变的12%(尽管在肺癌中占大多数),而KRAS基因大多数突变还是G12D和G12V,而这两种突变仍然“无药可治”。
这篇《Cell》中开发的ARS-1620都能显著缩小KRAS(G12C)突变的肿瘤,却不能对KRAS(G12V)起作用。因此,想要完全攻克KRAS恐怕任重而道远。
以往一些针对k-ras的创新的措施:
Nat Commun:让抗体穿透细胞,解决癌症靶点“不可成药”难题
Cell Rep:科学家找到靶向KRAS途径治疗肺癌的新靶点
Nat Genet:一种管家型snoRNAs分子是著名癌分子K-RAS的开关
Cell:重大突破!rigosertib被证实是抑制RAS癌基因的小分子
Nature:靶向K-ras突变的小分子化合物研发成功 攻克30年挑战
Nature:K-RAS突变可能是癌症对靶向治疗耐药、复发根源
从上面这些研究来看,似乎突破都很大,但事实上,能转化为临床可用的药物,仍然很遥远!
作者:转化医学平台
版权声明:
本网站所有注明“来源:梅斯医学”或“来源:MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明“来源:梅斯医学”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言







#CEL#
39
#Cell#
39
#小分子#
34
#科学家发现#
38
#K-ras#
33