基因密码神来之笔,重磅流感活疫苗诞生记——专访北大药学院长周德敏教授
2018-01-10 佚名 学术经纬
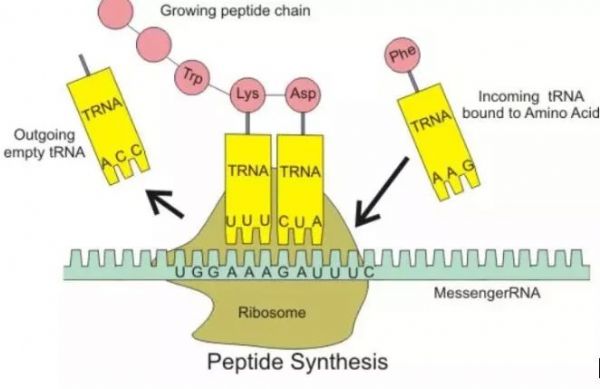
然而,免疫探索之路依然任重道远。流感病毒是最容易影响普通人健康的病原体之一,而小小的流感病毒所导致的恐慌和威胁,也从未停下过侵扰人类的脚步。至今,治疗流感尤其是重症患者的药物疗效依然有限,流感疫苗仍是普通人群最应关注的预防手段。

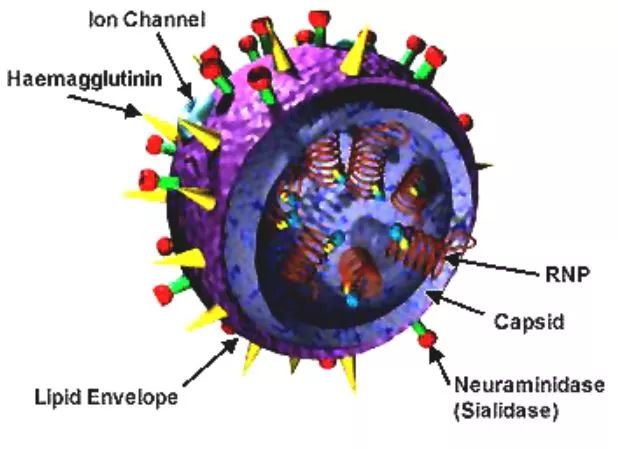
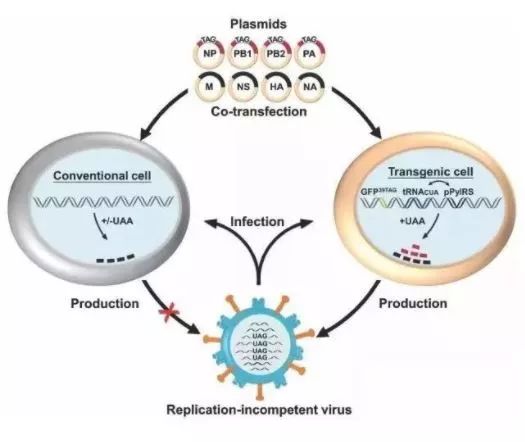
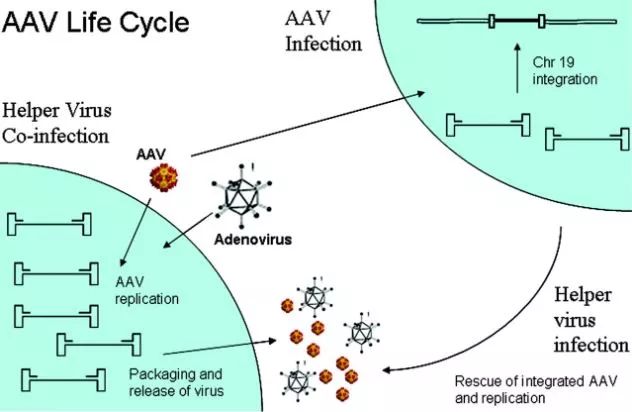
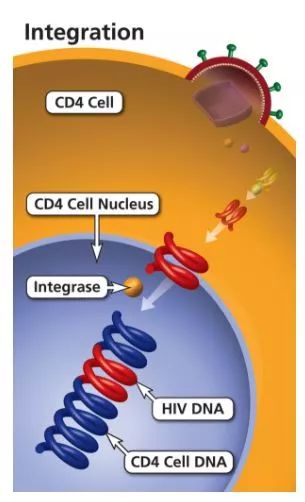

作者:佚名
版权声明:
本网站所有注明“来源:梅斯医学”或“来源:MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明“来源:梅斯医学”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言









#活疫苗#
44
#专访#
45
#药学院#
44
好
45
#重磅#
37