Nature Commun:瞄准肿瘤,用光亮指引T细胞去战斗!
2017-05-19 MedSci 药明康德
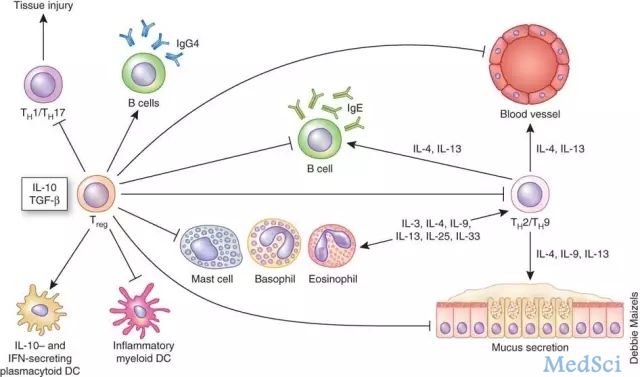
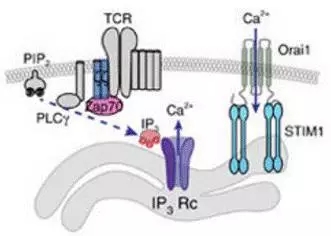
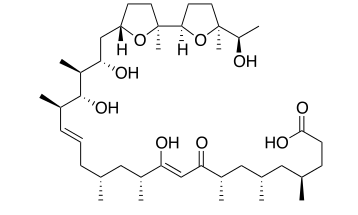
基于T细胞的癌症免疫疗法在近年来可谓大显神通。然而,该疗法至今几乎对实体瘤却难以招架。这其中的一个主要原因就在于实体瘤高度免疫抑制性的微环境,让抗肿瘤的T细胞活性大打折扣。

作者:MedSci
版权声明:
本网站所有注明“来源:梅斯医学”或“来源:MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明“来源:梅斯医学”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言







#COMMUN#
29
#Nat#
38
感觉好高大上哦!不知实际运用如何
56
很受启发,光照对免疫抑制的作用
74
非常好的文章,很受启发,学习了
67