Sci Adv:关于单抗耐药问题,又一关键机制被找到,并有希望逆转耐药性!
2020-01-09 Blake 转化医学网
导 读:单克隆抗体药物靶向性强、毒性低,具有传统的化学疗法无可比拟的优势。过去的20年,单抗药物在癌症、自身免疫等疾病的治疗领域发挥了重要的作用,然而其治疗效果也同样受到耐药性的困扰。
作者:Blake
版权声明:
本网站所有注明“来源:梅斯医学”或“来源:MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明“来源:梅斯医学”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言



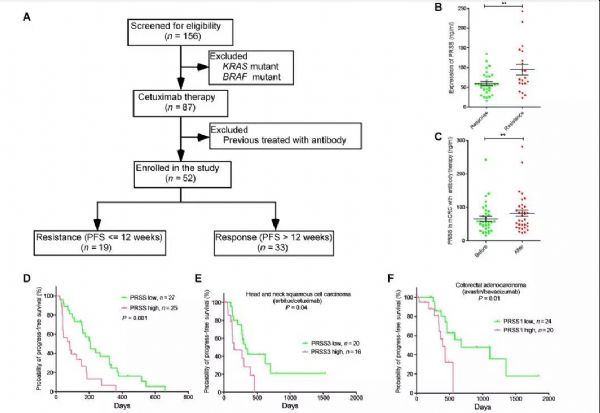






#逆转耐药#
64
#耐药问题#
57
机制研究离临床仍然有距离,不过与临床结合思考,仍然有帮助的,不能仅仅是纯临床思维,转化思维同样重要
60