【Blood】前体B细胞急性淋巴细胞白血病的一线免疫治疗
2024-09-13 聊聊血液 聊聊血液
梅奥诊所Talha Badar教授等近日于《Blood》发表综述,重点介绍了基于化学免疫治疗的治疗在初治BCP-ALL治疗中的发展,以提高疗效和降低毒性。
BCP-ALL
虽然成人前体B细胞急性淋巴细胞白血病(BCP-ALL)的完全缓解率在过去二十年中有所改善,但仍低于儿童患者,并且缓解后复发的风险仍很高。此外,虽然儿童样(pediatric-inspired)化疗方案改善了青少年和年轻成人的长期预后,但这些强化疗方案在老年患者中耐受性不佳,并且与较高的致病率和死亡率相关。
免疫治疗提供了在不增加毒性的情况下改善反应和减少复发的机会。在化疗方案中加入利妥昔单抗已证明可改善预后,随着奥加伊妥珠单抗(抗CD22抗体药物偶联物)、贝林妥欧单抗(CD3/CD19双特异性抗体)和CAR-T获批治疗复发或难治性疾病,以及贝林妥欧单抗用于治疗可测量残留病(MRD)阳性缓解,成人BCP-ALL的治疗已经发生巨大转变。
此外,奥加伊妥珠单抗和贝林妥欧单抗的研究均显示用于一线疗效良好(联合或不联合多药化疗)。一项随机试验也显示,在化疗的基础上加用贝林妥欧单抗对首次缓解的MRD阴性患者有生存获益,因此FDA最近批准其用于巩固治疗。
梅奥诊所Talha Badar教授等近日于《Blood》发表综述,重点介绍了基于化学免疫治疗的治疗在初治BCP-ALL治疗中的发展,以提高疗效和降低毒性。
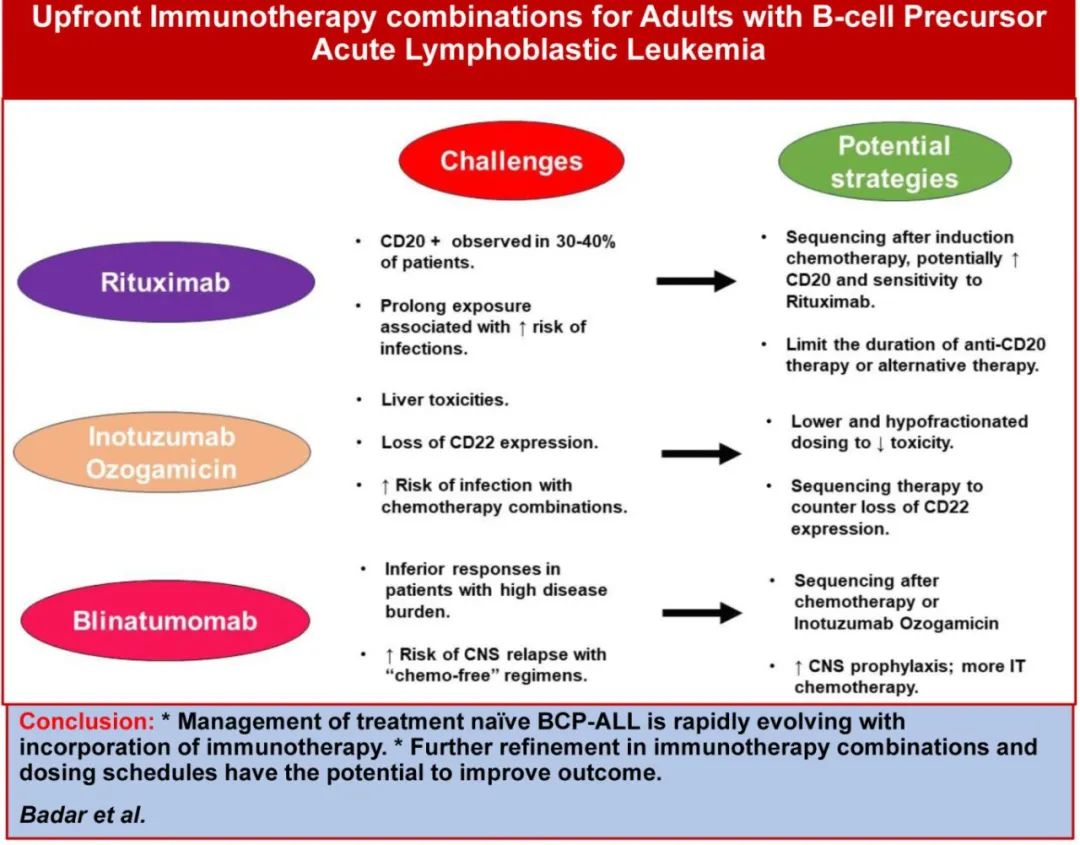
费城染色体阴性BCP-ALL
利妥昔单抗
CD20是一种B系特异性跨膜磷酸化蛋白,参与钙在细胞内的传导调控,在细胞周期的进展和分化中发挥重要作用。CD20在正常和恶性细胞上都有表达。总体而言,CD20在30%-40%的BCP-ALL患者的原始细胞上表达,且在老年人中表达率相对较高(40%-50%)。CD20表达≥20%对BCP-ALL预后有显著影响,显示复发风险较高、生存期较差。
成人BCP-ALL中CD20表达的潜在不良预后意义促使将利妥昔单抗纳入一线化疗方案以改善预后。MD安德森癌症中心的早期研究表明,利妥昔单抗联合hyper-CVAD治疗 BCP-ALL的成人患者是安全的,与不含利妥昔单抗的hyper-CVAD的机构历史队列相比,<60岁患者的预后得到改善。但60岁以上CD20阳性ALL患者未从利妥昔单抗为基础化学免疫治疗中获益,可能在于完全缓解后的死亡。随后一项III期随机GRAALL-2005/R研究评估了利妥昔单抗联合儿童样化疗对比单独化疗治疗成年(18至59岁) 、原始细胞中CD20表达≥20%的Ph-ve BCP-ALL患者的疗效,在化疗的同时给予最多16剂利妥昔单抗;结果为阳性,利妥昔单抗组的无事件生存期超过对照组(HR=0.66,p=0.04)。
研究表明CD20表达可在诱导化疗期间上调,这意味着CD20表达<20%的BCP-ALL也可能获益于利妥昔单抗;UK NCRI研究纳入25-65岁患者,随机选择在诱导期间接受4剂量的利妥昔单抗(不考虑CD20表达水平)。虽然在标准化疗中加入利妥昔单抗是安全的,但与GRAAL研究结果不同,EFS或OS均未见差异(包括CD20表达≥20%的患者)。与GRAAL研究不同的是,UK NCRI研究的患者年龄较大(中位年龄分别为40岁和45岁)。目前尚不清楚两研究之间结局的差异是由于年龄差异还是由于后者中利妥昔单抗的给药更少。很可能两因素都有贡献,而利妥昔单抗剂量的影响最大。
总之,CD20在BCP-ALL中的表达与预后较差相关。随机数据支持在儿童样方案中加入16剂利妥昔单抗具有获益。对于老年患者或CD20表达<20%的患者,较少剂量的获益尚不确定。另一方面,利妥昔单抗用药时间较长可导致毒性增加,尤其是老年患者,因此还需要更有效的化学免疫治疗组合。
贝林妥欧单抗
BCP-ALL几乎都表达CD19抗原。在贝林妥欧单抗前已有多种CD19单抗(主要与免疫毒素结合)在临床试验中进行评估,但疗效有限。贝林妥欧单抗是一种双特异性T细胞衔接分子,可将宿主CD3 T细胞引导到表达CD19抗原的正常和恶性细胞。贝林妥欧单抗最初在21例BCP-ALL患者的先导研究中进行评估,患者在诱导/巩固后存在持续性MRD或复发;初步结果令人鼓舞,MRD阴性缓解率为80%。后来其在II期RR患者中进行了研究,结果也非常好,CR和CR/CRh(CR伴部分血液学恢复)率分别为42%和69%;细胞因子释放综合征(CRS)和神经毒性是主要不良事件。随后的一项纳入405例RR BCP-ALL患者的III期研究评估了贝林妥欧单抗对比化疗的疗效。开始治疗12周后的完全缓解(CR)伴或不伴血细胞计数恢复显示贝林妥欧单抗更优(44% vs 25%,p≤0.001);此外6个月时的 EFS (31% vs 12%,p≤0.001)和中位OS(7.7 vs 4.0个月,p=0.01)也是贝林妥欧单抗更优。在OS的亚组分析中,早线接受贝林妥欧单抗治疗的患者预后更好。在这些RR疾病获得阳性结果后,在MRD阳性BCP-ALL患者中开展了一项多中心II期研究。在113例可评估患者中,78%达到MRD阴性。在 MRD完全缓解者中,中位无复发生存期(RFS)(23.6 vs 5.7个月;p=0.002)和OS(38.9 vs 12.5个月;P=0.002)显著较好。
使用贝林妥欧单抗治疗的挑战包括其对高肿瘤负荷的BCP-ALL患者的疗效下降和毒性增加。在GRAALL真实世界研究中,对于接受贝林妥欧单抗的患者,明显复发时治疗的患者 (16%)的3年OS明显低于CR时治疗的患者(66%;p=0.033)。因此,贝林妥欧单抗可能对最初使用化疗或其他药物减少细胞的患者更有效,或对很少或无形态学疾病的MRD难治性或复发患者更有效。另一个问题在于需要持续输注,从而需要使用输注泵和频繁更换输液袋。一项多中心1B期研究通过皮下注射贝林妥欧单抗,剂量可达到更高水平,并在一组重度经治RR BCP-ALL患者中显示出令人鼓舞的缓解率和可接受的毒性,或许能够克服后勤方面的问题。
贝林妥欧单抗联合化疗
与化疗相比,贝林妥欧单抗在RR BCP-ALL中的优越疗效和可接受的毒性特征鼓励将其与化疗联用,以提高反应的持久性和限制化疗暴露而不影响预后。MD安德森癌症中心白血病工作组在Ph-ve BCP-ALL年轻成人患者中开展了一项单中心II期研究,给予hyper-CVAD序贯贝林妥欧单抗,以限制化疗而不影响预后。化疗主干包括4个周期的hyper-CVAD,然后4个周期的贝林妥欧单抗,每3个周期的泼尼松、长春新碱、甲氨蝶呤和6-巯基嘌呤(POMP)维持治疗个周期后再进行1个周期的贝林妥欧单抗。共纳入40例患者,38例可评价疗效;诱导后CR率为81%,贝林妥欧单抗前76%的 MRD阴性率在1个周期贝林妥欧单抗后增加到100%;3年RFS为73%,18~39岁患者的3年RFS为77%,≥40岁患者为68%(表1)。无治疗相关死亡,感染是最常见的非血液学AE。任何级别的CRS和神经系统AE分别为15%和47%。该研究中hyper-CVAD化疗限制为4个周期。值得注意的是,CR1期移植仅限于具有至少1种高危分子学特征的患者。中位随访37个月时,在17例无高危分子特征的患者中有15例(88%)未接受移植,只有1例复发,证实未接受移植仍可持久缓解。限制化疗并纳入贝林妥欧单抗可在不损害疗效的情况下改善耐受性。但还需要随机对照研究来证实贝林妥欧单抗序贯联合化疗的疗效优于单独化疗。
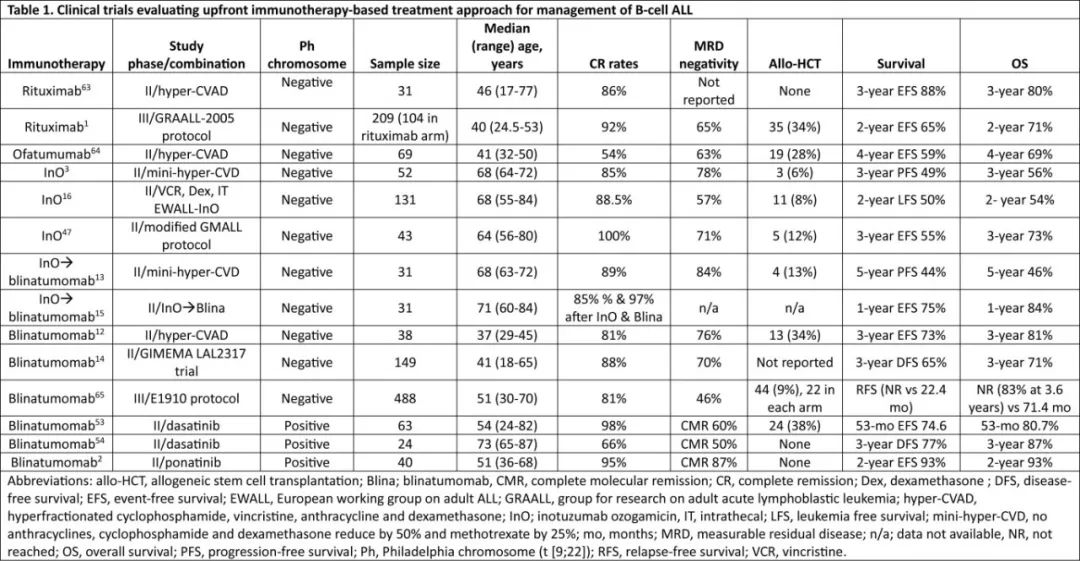
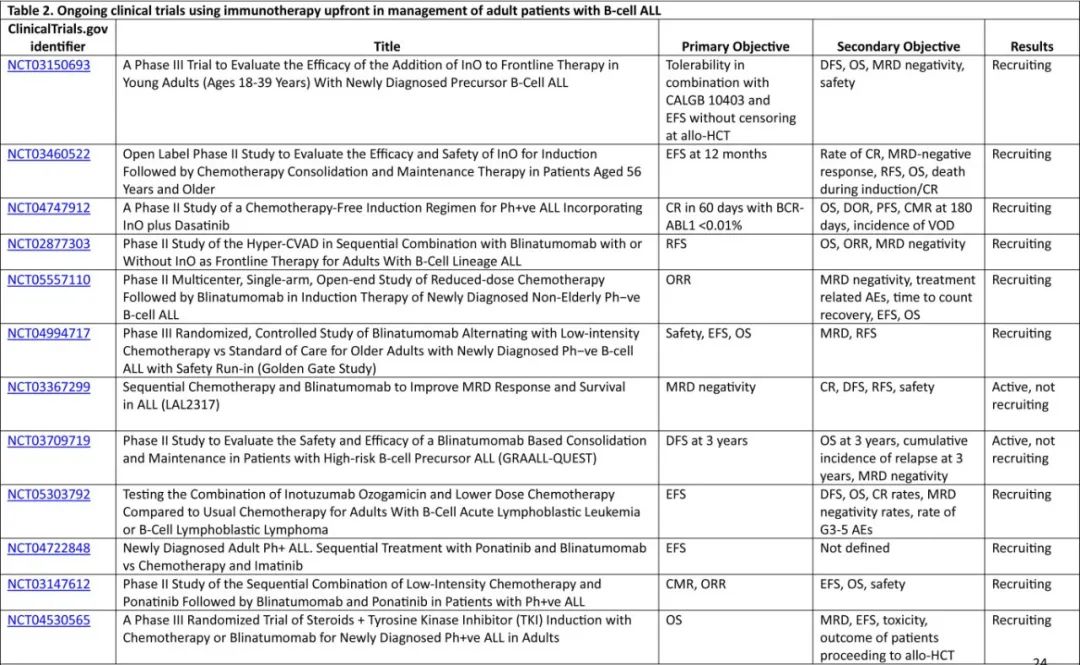
GIMEMA组的另一项II期研究LAL2317使用化疗序贯贝林妥欧单抗以改善成人Ph-ve BCP-ALL的MRD阴性率。两个周期的贝林妥欧单抗加入儿童样化疗支柱中,第一周期在巩固治疗3周期之后,第二周期在巩固治疗6周期之后。共纳入149例患者,中位年龄为41岁,19%的患者年龄大于55岁。诱导结束时88%的患者达到CR, 70%的患者达到MRD阴性,在贝林妥欧单抗第一个周期后,MRD阴性增加到93%;3年DFS和OS分别为 65%和71%。在多因素分析中,早期巩固治疗后的ph样特征和MRD阳性对不良生存仍有重要意义。其他几项前瞻性研究正在进行中,以评估一线贝林妥欧单抗治疗Ph-ve BCP-ALL的疗效(表2)。
ECOG-ACRIN领导了一项国际、多中心、随机III期研究,以评估Ph-ve BCP-ALL患者化疗诱导/强化后贝林妥欧单抗巩固的OS获益。所有患者均接受初始诱导化疗,缓解患者随后接受强化疗。患者随后随机分组,分别接受4个周期的巩固化疗交替4个周期贝林妥欧单抗或单纯巩固化疗。所有缓解期患者最初在试验中随机化,但在FDA批准贝林妥欧单抗治疗MRD阳性疾病后,MRD阳性患者不再随机化,并分配到贝林妥欧单抗组。试验的主要终点为MRD阴性患者的OS。中位年龄为51岁,诱导后CR/CRi率为81%。中位随访43个月,224例MRD阴性CR患者中,贝林妥欧单抗联合化疗的3年OS率为85%,优于单独化疗的68%(HR=0.41,p=0.002),3年RFS(80%)也优于单独化疗(64%)(HR=0.53)。不同于序贯使用贝林妥欧单抗及减少hyper-CVAD持续时间和周期,在E1910方案中,巩固化疗持续时间没有减少,但与单独化疗相比,该方案仍安全且显著有效。
在按年龄(<55岁vs >55岁)进行的OS的事后亚组分析中,在<55岁的患者中,与单独化疗相比,贝林妥欧单抗联合化疗的OS获益显著(HR=0.16), 但≥55岁患者中无法证明具有统计学意义的OS获益(HR=0.66)。然而由于样本量较小,无法分析差异的原因。
该研究中的MRD采用标准化六色流式细胞术进行集中评估,MRD阴性定义为小于1×10-4。那么采用更敏感的技术(如NGS MRD)评估MRD是否会产生不同的结果?还尚未得到测试。该研究是首个显示Ph-ve BCP-ALL患者采用一线贝林妥欧单抗序贯化疗的获益的随机多中心研究,并导致FDA批准其联合巩固化疗治疗 MRD阴性缓解患者。为探索是否可以减少接受贝林妥欧单抗的患者的巩固化疗,一项针对高危儿童BCP-ALL的III期试验用贝林妥欧单抗替代两个疗程的巩固化疗;早期报告提示,贝林妥欧单抗的毒性比单独化疗更优秀,而疗效数据尚待公布。
一线贝林妥欧单抗不伴化疗
不同于早期研究在巩固期给予贝林妥欧单抗,SWOG领导了一项单臂II期研究,在≥65岁BCP-ALL患者中评估贝林妥欧单抗诱导/巩固后POMP维持。贝林妥欧单抗诱导缓解患者进行3个周期的贝林妥欧单抗巩固治疗,以及18个周期的POMP维持治疗。在纳入的29例患者中,19例(66%)达到CR, 3年DFS和OS为37%。贝林妥欧单抗在成人患者中耐受性良好,前30天未见死亡。
随着贝林妥欧单抗逐渐作为一线治疗,如何管理贝林妥欧单抗后MRD阳性患者的问题也随之出现。奥加伊妥珠单抗在实现 MRD阴性方面显示出有希望的结果,包括在贝林妥欧单抗失败的患者中。CAR-T也显示出根除BCP-ALL MRD的疗效,且无明显不良反应。对于贝林妥欧单抗耐药的MRD阳性患者,还需要更大样本的研究探索免疫治疗。
总的来说,一项随机、多中心对照研究显示,在MRD阴性患者的化疗中加入贝林妥欧单抗可改善预后。此外,单臂研究显示,将贝林妥欧单抗用于一线治疗获得很有前景的结局,而且通常可减少化疗。然而对于具有高危基因组特征的患者或疾病负荷高的患者,贝林妥欧单抗可能不那么有效。
奥加伊妥珠单抗
奥加伊妥珠单抗最初在49例RR BCP-ALL患者的单臂研究中进行评估,显示出令人鼓舞的结果;总缓解率为57%,CR率为18%,中位OS为5.1个月。显著的不良反应为肝毒性,包括高胆红素血症和转氨酶升高。随后在326例RR BCP-ALL患者中进行了一项随机III期研究,将单药奥加伊妥珠单抗与标准细胞毒化疗进行对比。与化疗相比,该研究达到奥加伊妥珠单抗 OS改善的主要终点(7.7个月 vs 6.7个月,p= 0.04)。最显著的非血液学AE为任何级别的静脉闭塞病(VOD),奥加伊妥珠单抗组和标准化疗组分别有5例(11%)和1例(1%)。
老年BCP-ALL患者采用强化疗诱导可能具有挑战性,因为诱导相关死亡率高,并转化为5至10个月的不良OS。奥加伊妥珠单抗在RR疾病中的阳性结果推动了一线联合减低强度化疗,可达到更好的缓解和生存。此外与贝林妥欧单抗不同,奥加伊妥珠单抗可有效治疗高肿瘤负荷BCP-ALL。
一线奥加伊妥珠单抗联合化疗
MD安德森癌症中心白血病工作组纳入≥60岁Ph-ve BCP-ALL患者开展了一项单中心II期研究。52例初治患者接受奥加伊妥珠单抗联合mini-hyper-CVD治疗。在前4个周期的第3天给予奥加伊妥珠单抗,并在剂量限制性毒性监测下逐渐增加剂量。41例(85%)患者达到CR; 38例(73%)在1个周期后达到缓解;中位PFS为35个月,中位OS未达到,3年PFS和OS分别为49%和56%。诱导治疗的前4周内未观察到早期死亡,但22例(42%)患者因治疗相关并发症无法完成诱导/巩固治疗。6例(12%)患者死于治疗相关并发症(5例感染, 1例VOD)。所有患者均有肝脏不良反应,其中17例(33%)为≥3级。4例(8%)患者在中位3个周期后出现VOD,其中1例在异基因移植后出现VOD。相当大比例的患者在达到CR后死亡(n=12或23%),从而引起对晚期毒性的关注。
奥加伊妥珠单抗较低剂量和分次给药或可降低发病率和死亡率。大多数发生VOD的患者是在使用奥加伊妥珠单抗后或之前接受异基因移植治疗的患者,且在异基因移植之前接受双烷化剂预处理方案的患者中发病率更高。一项回顾性分析表明,在适合异基因移植的患者中,将奥加伊妥珠单抗的治疗限制在2个疗程,并在奥加伊妥珠单抗暴露后延迟2个月进行异基因移植,可降低移植后VOD风险。此外,BCP-ALL的某些基因组亚群(如KMT2A重排亚群)可能对奥加伊妥珠单抗反应不佳,并且在奥加伊妥珠单抗后可以显示CD22阳性原始细胞表达降低,同时保持CD19表达。随后,奥加伊妥珠单抗+mini-hyper-CVD方案进行修改,序贯加入贝林妥欧单抗,以减少巩固期的化疗暴露和改善临床结局。在修订后的研究中, 奥加伊妥珠单抗限制在2.7 mg/m2的最大累积剂量,给予 4个周期的mini-hyper-CVD联合奥加伊妥珠单抗,随后4个周期的贝林妥欧单抗。POMP维持治疗时间缩短至12个周期,且每3个POMP周期后给予贝林妥欧单抗1个周期。在31例接受此治疗的患者中,修改前后的中位PFS无显著差异(分别为34.7个月和56.4个月,p=0.77)(表1)。值得注意的是,35例(44%)患者死于缓解期,死于第二恶性肿瘤、感染性并发症、VOD和器官衰竭,再次引起对晚期毒性的担忧,至少部分与奥加伊妥珠单抗相关。
基于这些显著的迟发毒性作用,奥加伊妥珠单抗联合化疗方案还需要继续重新评估。如上所述,调整化疗方案伴较低和分次剂量奥加伊妥珠单抗是减轻近期和远期毒性的潜在策略。一项多中心II期随机研究正在进行中,以评估奥加伊妥珠单抗+mini-hyper-CVD治疗老年BCP-ALL患者(表2)。
欧洲成人ALL工作组(EWALL)纳入Ph−ve BCP-ALL老年患者开展了一项奥加伊妥珠单抗联合减低强度化疗的II期研究。诱导化疗分两部分进行。第一部分包括为期4周的每周长春新碱和地塞米松(20 mg)、1次鞘内化疗及3剂奥英妥珠单抗(第1天0.8mg/m2,第8和第10天0.5mg/m2)。诱导的第二部分给予达到CR的患者,包括在第1天和第8天使用地塞米松20mg,从第1天到第3天使用环磷酰胺300mg/m²,第2天使用1次鞘内注射,第1天和第8天2剂奥加伊妥珠单抗(0.5 mg/m²)。在131例入组患者中,CR/ CRi率为88.5%(57% MRD阴性),2年OS为54%。
肿瘤临床试验联盟正在领导一项随机III期研究,旨在评估在儿童样AYA方案中加入奥加伊妥珠单抗的疗效用于初治B细胞ALL的青少年年轻成人(表2),主要终点为评估与单独使用含培门冬酶化疗方案相比,奥加伊妥珠单抗和含培门冬酶的强化疗方案对EFS的改善;然而由于在巩固和维持阶段奥加伊妥珠单抗的感染性死亡人数过多,导致研究暂停,目前尚无疗效数据。儿童肿瘤协作组AALL1732 3期研究的中期分析也获得类似结果,与单独化疗组相比,化疗+奥加伊妥珠单抗组的感染率较高,导致奥加伊妥珠单抗剂量降低20%。虽然在BCP-ALL患者的治疗过程中提前进行免疫治疗可减少复发,但短期和长期发病率和死亡率需要持续警惕并重新评估治疗的剂量和顺序。表2总结了正在进行的临床试验,评估在Ph-ve BCP-ALL患者化疗前使用奥加伊妥珠单抗。
一线奥加伊妥珠单抗不伴化疗
GMALL(德国成人ALL多中心研究小组)组开展了一项II期研究(INITIAL-1),探索在>55岁患者中先用奥加伊妥珠单抗+地塞米松诱导,然后采用根据年龄调整的改良GMALL巩固和维持化疗。43例可评估的患者中位年龄为64(56-80)岁,接受至少2个周期的奥加伊妥珠单抗诱导,100%达到CR/CRi,其中71%在第三周期后达到MRD阴性。中位随访2.7年, 3年EFS和OS分别为55%和73%。尽管这是一项小样本的单臂研究,但结果支持在BCP-ALL诱导期早期使用奥加伊妥珠单抗以改善预后。
美国肿瘤临床试验联盟开展了一项前瞻性II期研究,探讨了序贯奥加伊妥珠单抗+贝林妥欧单抗的无化疗方案对≥60岁患者的疗效。对于奥加伊妥珠单抗难治性患者,贝林妥欧单抗给予最多3个周期,如果奥加伊妥珠单抗达到CR/ CRi则给予2个周期。31例患者中,单独奥加伊妥珠单抗和奥加伊妥珠单抗+贝林妥欧单抗治疗后的累积CR/CRi率分别为85%和97%;一年 EFS和OS分别为75%和84%。
单臂II期研究评估了奥加伊妥珠单抗用于根除MRD阳性疾病,并且在实现MRD阴性方面显示出令人鼓舞的结果,甚至在贝林妥欧单抗耐药的患者中也是如此。
奥加伊妥珠单抗是一种有效的治疗BCP-ALL的方法,与贝林妥欧单抗不同,其有效性似乎与疾病负荷无关。但奥加伊妥珠单抗与化疗联用可能导致显著毒性。因此,采用大分割剂量奥加伊妥珠单抗联合贝林妥欧单抗或化疗可在不影响疗效的情况下提高安全性。
费城染色体阳性B细胞ALL
在常规使用TKI治疗Ph+ve ALL之前,其长期预后极差,5年生存率约为 20%,而在开始以TKI为基础的一线联合治疗后长期预后显著改善。在实现深度分子缓解、缓解持续时间和生存方面,以ponatinib为基础的联合方案已观察到更好结局,且它可以抑制具有T315I突变的克隆的出现。
为了制定有效和更耐受的诱导方案,GIMEMA研究人员在初治Ph+ve ALL中开展了达沙替尼和贝林妥欧单抗的II期LAL2116 D-ALBA研究。达沙替尼诱导3个月结束时CR率为98%(n=61/63),29%的患者达到分子学反应,在2个周期贝林妥欧单抗治疗后增加至 60%。53个月长期随访的EFS和OS分别为74.6%和80.7%。存在IKZF1异常伴额外分子异常以及T315I突变的出现与较差的结局相关。
SWOG也在老年Ph+ve ALL患者中开展了一项2期研究,使用达沙替尼/泼尼松诱导,然后使用达沙替尼和贝林妥欧单抗进行3个周期的缓解后治疗,持续CR的患者接受达沙替尼维持治疗。共纳入24例患者,中位年龄为73岁,中位随访2.7年,3年DFS和OS分别为77%和87%。
ABL1激酶结构域突变(如T315I)可赋予对二代TKI的耐药,为对抗这种耐药性,贝林妥欧单抗与ponatinib联合作为Ph+ve BCP-ALL的一线治疗。40例患者入组,CR率为95%,完全分子反应率高达87%。中位随访 16个月,2年EFS和OS为93%。虽然样本量小、随访时间短,但结果令人鼓舞。值得注意的是,与D-ALBA研究不同,贝林妥欧单抗从第1天开始与ponatinib联用,从而可能导致高完全分子学反应率。
无化疗方案的一个问题在于CNS复发的发生率增加。在D-ALBA研究中,9例复发中有4例发生在CNS,表明需要更强化的CNS预防。增加鞘内化疗疗程或可降低无化疗方案CNS复发的风险,但还有待验证。
为了证实一线贝林妥欧单抗+TKI优于TKI化疗,ECOG-ACRIN合作组正在开展一项随机III期研究,比较贝林妥欧单抗+TKI(达沙替尼或ponatinib)与 TKI+hyper-CVAD化疗治疗初治Ph+ve ALL(EA9181;NCT04530565)。GIMEMA团队也正在开展一项研究,比较ponatinib+贝林妥欧单抗诱导治疗与化疗+伊马替尼(ALL2820;NCT04722848),主要终点为EFS(表2)。
BCP-ALL的一线CAR-T细胞治疗
CAR-T细胞是一种新型的细胞免疫疗法,对T细胞进行遗传修饰,以表达对肿瘤抗原特异性的嵌合抗原受体。CD19 CAR-T细胞疗法的开发是BCP-ALL治疗的又一突破,美国目前有两种CD19 CAR-T细胞疗法获批用于复发/难治性疾病;分别基于ELIANA和ZUMA-3研究,用于儿童和25岁以下年轻人的tisagenlecleucel和用于成人患者的brexucabtagene autotoleucel;中国已有纳基奥仑赛注射液获批治疗成人复发或难治性B细胞急性淋巴细胞白血病。虽然在ELIANA和ZUMA-3中RR BCP-ALL人群的缓解率很高,但后续疾病复发仍很常见。有回顾性分析引起担忧贝林妥欧单抗治疗后tisagenlecucel治疗的疗效,但随后Brexucabtagene autoleucel的ZUMA-3研究表明,反应率在各关键协变量之间一致,包括既往接受过贝林妥欧单抗治疗的难治性患者。CAR-T给药时高肿瘤负荷是增加CRS/神经毒性、降低反应率和增加复发率的危险因素之一,考虑到CAR-T治疗低肿瘤负荷似乎更有效,,其最近探索用于治疗 MRD阳性BCP-ALL。在单臂I/II期研究中,CD19或CD19/CD22双特异性CAR-T细胞显示有效根除MRD而无明显毒性。使用CAR-T细胞疗法来根除MRD还需要进一步评估,并应在成本效益方面进行分析以改善远期预后。
总结
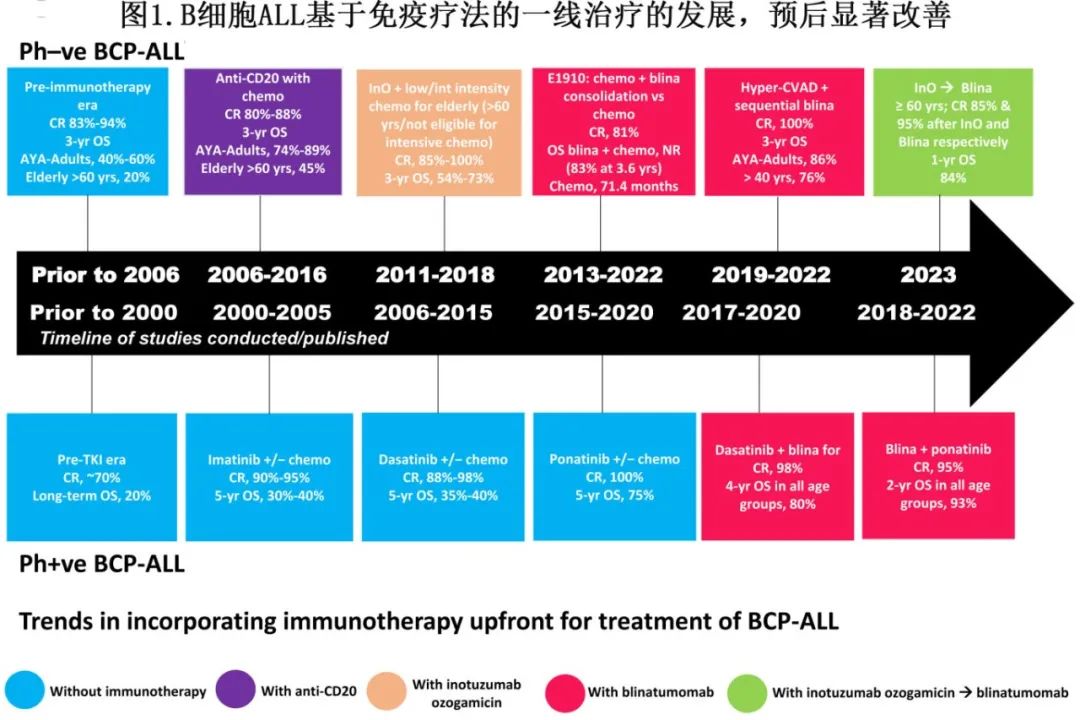
BCP-ALL的治疗前景正在迅速发展,近年来新的免疫治疗药物联合化疗或不联合化疗治疗初治或RR患者已显著改善预后(图1)。利妥昔单抗是第一个在CD20阳性BCP-ALL患者中联合化疗的药物,在一项随机对照试验中证明有效。在一项随机试验中,贝林妥欧单抗联合化疗治疗Ph-ve BCP-ALL已证明其优越疗效,贝林妥欧单抗联合二代和三代TKI治疗Ph+ve BCP-ALL在单臂II期研究中也显示出令人印象深刻的结果,目前正在随机试验中进行评估。奥加伊妥珠单抗已在数项研究中单独使用或联合化疗,缓解率高,但在部分研究中因毒性问题限制了其应用。随着进一步的发展,这些一线免疫治疗药物联合或不联合化疗或可进一步改善老年和年轻BCP-ALL患者的预后,同时最大限度地减少化疗相关毒性并改善长期预后。
参考文献
Badar T, et al. Incorporation of immunotherapy into frontline treatment for adults with B-cell precursor acute lymphoblastic leukemia.Blood . 2024 Sep 5:blood.2023022921. doi: 10.1182/blood.2023022921.
作者:聊聊血液
版权声明:
本网站所有注明“来源:梅斯医学”或“来源:MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明“来源:梅斯医学”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言











#免疫治疗# #前体B细胞急性淋巴细胞白血病#
56