过敏原特异性免疫治疗中的新型佐剂
2024-09-18 小药说药 小药说药
介绍过敏反应及过敏原特异性免疫治疗,阐述已批准和新型佐剂在 AIT 中的作用及优缺点,新型佐剂具改善 AIT 潜力但暂无上市产品。
前言
过敏反应是发达国家日益严重的健康和经济问题。I型过敏是最常见的过敏形式,是由针对我们环境中无害抗原(过敏原)的过度免疫反应引起的。在免疫学上,这些免疫反应的特征是诱导过敏原特异性Th2细胞和IgE抗体,从而引发IgE依赖性肥大细胞脱颗粒,并伴有相关的过敏症状。
目前,过敏原特异性免疫治疗(AIT)是唯一有可能重建对相应过敏原的临床耐受性的疾病改善治疗方法。然而,传统的AIT有一些缺点,包括治疗时间长、诱发过敏副作用的风险,以及过敏原本身具有相当低的免疫原性。为了改善AIT,佐剂可以成为一种强大的工具,不仅可以提高共同应用的过敏原的免疫原性,还可以诱导所需的免疫激活,例如促进过敏原特异性Th1或调节反应。
目前,已批准用于人类AIT的佐剂包括氢氧化铝、磷酸钙、微晶酪氨酸和MPLA,但它们的在AIT的应用依然有许多缺点。近年来研究的一些新型佐剂:如水包油乳液、病毒样颗粒、葡聚糖和CpG ODN等显示出不同的特性,例如延长注射部位的过敏原释放,诱导过敏原特异性IgG的产生,同时降低IgE水平,以及促进不同免疫细胞的分化和激活。未来,更好地了解这些佐剂在临床中作用的免疫机制可能有助于我们改善AIT。
已批准用于AIT的佐剂
氢氧化铝
铝佐剂是目前人类疫苗预防传染病应用最广泛的佐剂,如白喉、破伤风、百日咳、乙型肝炎、炭疽和流感。铝佐剂通过静电相互作用吸附蛋白质,从而减少过敏原扩散(降低过敏反应的机会),延长免疫细胞在注射部位接触这些抗原的时间。因此,铝佐剂已被纳入大多数皮下过敏免疫治疗(SCIT)产品中,以增加免疫反应。
然而,铝佐剂的使用并非没有缺点。铝佐剂经常在注射部位引起急性和慢性炎症,生物降解性低,导致其在反复使用时积聚,并可能具有毒性作用;因此,明矾作为I型过敏治疗佐剂的应用仍在不断地研究中。
磷酸钙
磷酸钙是人体的天然成分,与氢氧化铝相比具有更好的生物降解性和生物相容性,可防止其在反复使用时在体内积聚。磷酸钙的主要优点是它不会在加强疫苗接种和免疫治疗中诱导IgE的产生。虽然磷酸钙的佐剂活性低于铝佐剂,但它仍可能引起局部不良反应,尽管持续时间较短。皮下注射后,磷酸钙会引起活动性炎症,涉及中性粒细胞和巨噬细胞的浸润。
微晶酪氨酸
MCT是非必需氨基酸L-酪氨酸的结晶形式,用作AIT的佐剂。尽管MCT的使用频率低于铝佐剂,但MCT已被证明对人体既安全又有效。它是一种可生物降解的长效佐剂,半衰期短至48小时,用于季节性鼻炎的超短疗程AIT。储库效应导致相应过敏原的缓慢释放,从而延长其在注射部位对免疫系统的暴露时间。
在AIT中,MCT佐剂天然过敏原或改良过敏原(类过敏原)经常与TLR4激动剂MPLA联合使用,例如在过敏原治疗药物Pollinex®Quattro中用于治疗季节性过敏性鼻结膜炎。由于MCT增强T细胞介导的反应,目前正在研究其在不同传染病疫苗中的应用。
单磷酰脂质A
MPLA是一种基于碳水化合物的佐剂,可激活TLR4。它是通过一系列有机提取从明尼苏达沙门氏菌R595的脂多糖(LPS)中去除磷酸和脂肪酸基团,然后进行温和的酸碱处理而开发得到的。MPLA可以诱导Th1偏向的免疫反应,促进IgG1和IgG4主导的体液免疫反应,而不会增加IgE的产生,也没有直接激活小鼠或人类肥大细胞的能力,这使MPLA成为改善AIT的有吸引力的佐剂。
用于AIT的新型佐剂
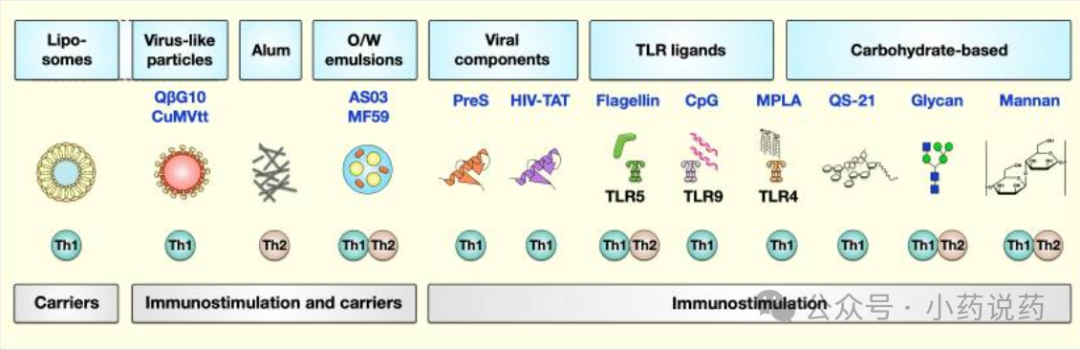
脂质体
脂质体是可生物降解的纳米粒子,被认为是将免疫细胞活化与有效封装相结合的佐剂,可将水溶性抗原传递给靶细胞。尽管脂质体具有潜在的免疫刺激能力,但它也可能引起严重的副作用,如对单核吞噬细胞系统的细胞毒性,减少这些细胞分泌免疫效应分子,诱导补体激活相关的假性过敏,以及静脉注射后对肝脏和脾脏的器官损伤。
使用脂质体的一个缺点是它们缺乏固有的免疫激活能力,这可以通过将脂质体与额外的佐剂结合来克服。最近的一项研究还将TLR9激动剂CpG-ODN与OVA一起封装在脂质体中,以评估其治疗过敏的潜力。结果表明,包封在脂质体中的OVA可以显著减少体内OVA诱导的哮喘小鼠模型中的皮肤过敏反应。此外,在小鼠模型中,包封OVA和CpG-ODN的脂质体,而不是单独包封OVA再加CpG-ODN的混合物,逆转了OVA诱导的过敏性肺部炎症。因此,脂质体有潜力作为包裹过敏原和其他佐剂的载体,以改善过敏治疗。
水包油乳液
从机制上讲,O/W乳液具有在注射部位逐渐释放结合抗原的优点,这降低了过敏反应的机会,同时刺激了产生抗原特异性抗体的浆细胞的激活,并产生了混合的Th1/Th2反应。目前,关于使用O/W作为佐剂来改善AIT的研究有限。
病毒样颗粒和病毒成分
病毒样颗粒(VLP)是多聚体,具有天然病毒的形态,但不含病毒基因组物质,因此无法在体内复制。因此,与减毒活疫苗或灭活疫苗相比,基于VLP的疫苗显示出更好的安全性。VLP也被研究用于过敏治疗,VLP可以单独使用,也可以包装免疫刺激性CpG或过敏原,或在其表面展示细胞因子、免疫调节蛋白或过敏原,以及混合使用以改善AIT。研究表明,VLP有可能改善体内过敏动物模型的过敏反应,包括减少肥大细胞活化、抑制Th2-同时促进Th1反应,以及上调中和抗体的产生。
在变态反应学领域,对源自噬菌体Qβ的VLP(QβG10)进行的临床研究数量最多。这些形成尺寸约为30nm的颗粒,用于包封约60个免疫刺激A型CpG ODN分子。在一项开放标签的I期试验中,20名HDM过敏患者接受了为期10周的QβG10(称为CYT003)和铝佐剂吸附HDM提取物的混合物治疗。研究显示,与治疗前相比,QβG10、铝佐剂和过敏原的组合使自我报告的症状减少了10倍,同时增加了HDM特异性IgG1、IgG2和IgG4抗体的产生。
除了VLP,具有免疫激活能力的病毒成分也可以作为过敏治疗的佐剂。例如,与不同过敏原融合的乙型肝炎病毒(HBV)衍生的PreS T细胞表位在II期临床试验中进行了测试。BM32是一种候选疫苗,将PreS与来自几种主要帝汶草花粉过敏原的低致敏肽融合在一起。临床研究中,BM32显示出良好的安全性,在两年的治疗期间没有报告过敏反应和T细胞介导的副作用,同时降低了IgE反应性和过敏原特异性Th2细胞因子的分泌。
碳水化合物佐剂
碳水化合物是自然界中最常见的生物分子类型,它们在调节先天性和适应性免疫反应方面发挥着重要作用。甘露聚糖是一种β-(1,4)-甘露糖多糖,存在于植物和真菌细胞的细胞壁中。甘露聚糖可以通过与例如由APC表达的甘露聚糖和C型凝集素受体(DC-SIGN)结合来调节对Th1和Th2反应的免疫反应,这导致补体途径、NLRP3炎性小体的激活,以及APC中吞噬作用和细胞因子分泌的增加。
在一项II期研究中,包括196名患有HDM变应性鼻炎伴或不伴哮喘的患者,患者和健康对照组接受了HDM提取物的治疗,该提取物由50%Der p和50%Der f类过敏原与非氧化甘露聚糖的偶联物组成,通过舌下或皮下给药。研究显示,过敏原偶联物使鼻激发试验改善的患者比例增加了50%,并将综合症状药物评分降低了45%至70%。
Toll样受体激动剂
TLRs是一种模式识别受体,在对入侵病原体的先天免疫反应中起着至关重要的作用。CpG-ODN是一种合成的DNA分子,具有含有未甲基化CpG-ODN基序的硫代磷酸根骨架。CpG-ODN对TLR9的激活增强了对抗原的特异性体液和细胞免疫反应。CpG-ODN是一种强效佐剂,可诱导1型辅助性T(Th1)反应,并促进细胞毒性T淋巴细胞(CTL)的产生和IFN-γ的分泌。此外,CpG-ODN可以促进抗原的免疫刺激作用,激活抗原呈递细胞,加速免疫反应。
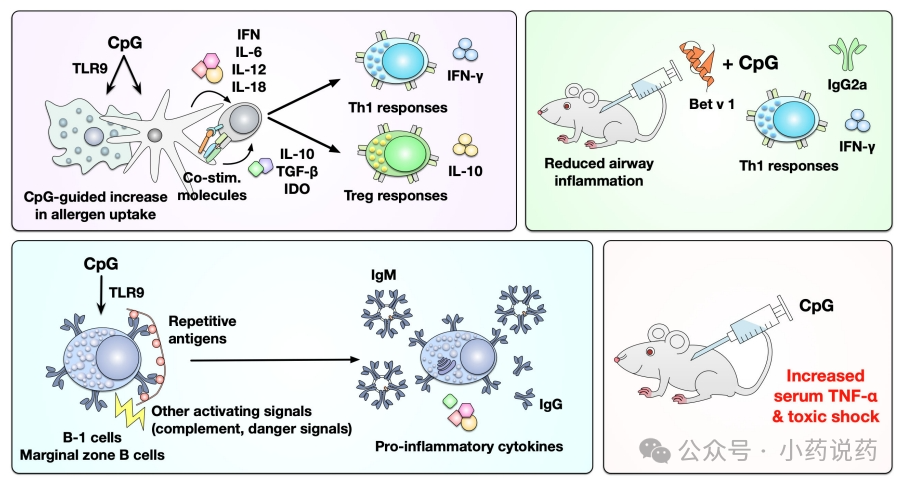
使用CpG-ODN进行过敏原特异性免疫治疗的优势包括:(I)CpG-ODN可以通过TLR9激活DC和巨噬细胞,特别是促进pDCs,以增加过敏原的摄取并产生IL-10、TGF-β和吲哚胺2,3-双加氧酶(IDO)。这反过来又推动Treg反应的分化和激活,同时诱导DC衍生的IFN、IL-6、IL-12和IL-18的分泌,促进产生IFN-γ的Th1细胞的分化和同种型向IgG2a的转变。(II) 由于B细胞表达高水平的TLR9,CpG-ODN也可以直接激活B细胞。一项使用豚草花粉致敏小鼠的体内研究表明,将CpG-ODN与豚草花粉结合可以诱导更高的IL-10产生Breg,这有助于抑制过敏原诱导的炎症反应。
作为治疗豚草过敏的一种方法,CpG1018与主要的豚草过敏原Amb a 1化学偶联,产生平均偶联率为1至4的Amb a 1:CpG偶联物,称为TOLAMBA。2006年,一项II期试验在25名豚草过敏患者中测试了TOLAMBA。研究显示,与安慰剂相比,TOLAMBA在两个豚草季节都将鼻炎评分降低了三分之二,并且在第一个豚草季节,Amb a 1特异性IgE水平也较低。
为了跟进这些结果,对738名豚草过敏患者进行了TOLAMBA的IIb期研究。研究显示,在第一个豚草季节,所有组别的治疗都耐受良好,没有出现与TOLAMBA相关的严重不良事件。然而,尽管与安慰剂相比,TOLAMBA显示出豚草过敏个体症状减轻的趋势,但没有达到统计学意义。目前,TOLAMBA的临床开发已停止。
小结
佐剂有可能通过提高分离的过敏原的免疫原性来改善AIT,同时减少注射次数和需要使用的过敏原剂量。此外,佐剂可以通过吸附过敏原来降低过敏反应的可能性,并调节过敏原特异性免疫反应,使其主要针对耐受性或Th1偏向免疫反应。
目前批准用于人类的佐剂(氢氧化铝、磷酸钙、MCT和MPLA)显示出改善AIT的优势,例如延长免疫细胞在注射部位与过敏原的接触时间,并诱导过敏原特异性IgG的产生。然而,其中一些也显示出一些缺点,例如,使用氢氧化铝会引起不必要的Th2反应和IgE的产生。
因此,近年来,几种不同的新型佐剂显示改善AIT的潜力:通过(I)诱导更高水平的过敏原特异性IgG,同时减少IgE的产生;(II)促进不同调节性免疫细胞的分化和激活,如Tregs、耐受性DC、巨噬细胞和Bregs。然而,到目前为止,还没有新型佐剂AIT产品的上市授权。随着目前正在进行的许多临床研究进一步测试这些新型佐剂,我们可能能够在不久的将来更好地评估其中一些佐剂的潜力。
参考文献:
1.Novel adjuvants in allergen-specific immunotherapy: where do we stand? Front Immunol.2024 Feb 23:15:1348305
作者:小药说药
版权声明:
本网站所有注明“来源:梅斯医学”或“来源:MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明“来源:梅斯医学”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言











#免疫治疗# #过敏反应#
50