12问12答 | ASTCT专家探讨CART在骨髓瘤的当前位置及用于早线治疗
2023-11-14 聊聊血液 聊聊血液
美国移植和细胞治疗学会召集专家对CAR T 细胞治疗后线骨髓瘤的关键获批研究进行全面审查,并讨论最近的报告和正在进行的研究,旨在将 CAR T 细胞治疗从目前的五线移向早线治疗。
多发性骨髓瘤的CAR T治疗
自2021年以来,已有两种针对 B 细胞成熟抗原 (BCMA) 的CAR T细胞疗法被美国 FDA 批准用于≥4线既往治疗后(包括免疫调节药物[(IMiD]、蛋白酶体抑制剂[PI]和抗 CD38 抗体)的复发难治多发性骨髓瘤 (RRMM)。CAR T在 RRMM 中均显示出前所未有的活性,但复发仍然很常见,且在快速进展的晚期疾病患者中的可及性和安全性并不理想。
由于数据显示既往 BCMA 靶向治疗后 CAR T 治疗的预后较差,因此CAR T 细胞治疗与其他方案(包括BCMA 靶向 T 细胞结合双特异性抗体)的排序变得越来越具有挑战性,导致可以考虑在骨髓瘤病程早期使用 CAR T 细胞治疗,因为此时 T 细胞可能更健康,骨髓瘤侵袭性更低。早线(大约为1-3线)使用 CAR T 细胞的2项 CAR T 细胞随机研究表明与标准治疗相比,在二线 (CARTITUDE-4) 或三线 (KarMMA-3) 治疗中可获得无进展生存期改善。
鉴于 FDA 可能会将 CAR T 细胞的审批范围扩大到更早线的骨髓瘤治疗,美国移植和细胞治疗学会 (ASTCT) 召集专家对CAR T 细胞治疗后线骨髓瘤的关键获批研究进行全面审查,并讨论最近的报告和正在进行的研究,旨在将 CAR T 细胞治疗从目前的五线移向早线治疗(二线、三线甚至一线),并分享了在当前实践中关于 BCMA 靶向治疗的排序和患者选择优化的见解和考虑(12个问题如下)。
|
|
关于CAR T细胞在骨髓瘤早线治疗中作用的问题 |
|
问题1 |
目前获批的治疗复发性/难治性骨髓瘤的CAR T 细胞疗法是哪两个?有哪些研究和数据促使其获批? |
|
问题2 |
可采用哪些缓解策略降低骨髓瘤 CAR T 细胞治疗后发生重度 CRS 和神经毒性的风险? |
|
问题3 |
除 CRS 和神经毒性外,CAR T细胞疗法还存在哪些特定风险? |
|
问题4 |
哪些因素有助于选择一种 BCMA CAR T 细胞产品而非另一种产品? |
|
问题5 |
许多患者不符合用于批准 CAR T细胞试验的合格标准。临床试验环境之外的 CAR T 细胞治疗数据有哪些? |
|
问题6 |
在产品制备过程中,五药难治性患者有效减少细胞以降低风险或控制骨髓瘤的桥接策略是什么? |
|
问题7 |
有了多种靶向 BCMA 的治疗选择和模式(CAR T细胞、双特异性T细胞衔接抗体),对 BCMA 靶向治疗进行排序有哪些考虑? |
|
问题8 |
是否有 T 细胞标志物可预测 CAR T 细胞治疗后的不良预后,以及 CAR T 细胞在病程早期可能更有效的原因是什么? |
|
问题9 |
正在进行哪些研究,随机研究中报告了哪些数据,以支持将 CAR T 细胞移至骨髓瘤二线或三线治疗? |
|
问题10 |
正在进行哪些研究,将 CAR T 细胞移至骨髓瘤一线治疗需要哪些数据? |
|
问题11 |
将 CAR T 细胞移至骨髓瘤的早期治疗线是否成本高昂,CAR T改善生活质量是否可证明成本差异的合理性? |
|
问题12 |
BCMA靶向治疗后复发的患者有哪些选择,有哪些关于非BCMA T细胞重定向治疗的数据? |
关于12个问题的专家小组意见及相关数据,近日发表于ASTCT官方期刊《Transplantation and Cellular Therapy》。现翻译全文供参考。

要点
已证明 BCMA 靶向嵌合抗原受体 (CAR)-T 细胞在治疗复发性/难治性多发性骨髓瘤 (RRMM) 方面高度有效。
两种 BCMA CAR T 细胞产品已获得 FDA 批准,但目前均需要4线既往治疗,难以找到有效的桥接治疗。
在两项随机 III 期研究中,BCMA CAR T细胞在多发性骨髓瘤二线和三线治疗中优于标准治疗方案,可延长无进展生存期。
作者回顾了早线使用 BCMA CAR T 细胞治疗多发性骨髓瘤对临床实践的意义。
问题1. 目前获批的治疗复发/难治性骨髓瘤的CAR T 细胞疗法是哪两个?有哪些研究和数据促使其获批?
Idecabtagene vicleucel(Ide-cel) 是首个获批用于骨髓瘤的 CAR T 细胞治疗产品,基于2期 KarMMa 研究的结果,该研究入组既往接受过至少3线治疗(包括PI、IMiD和抗 CD38 抗体治疗)的 RRMM 患者(表1)。128例患者中位既往治疗线数为6,其中84%的患者对所有3类治疗中的至少一种药物难治(三类难治),而26%的患者对2种PI、2种 IMiD 和1种 CD38 抗体难治(五药难治)。基于本研究中既往接受过多线治疗的人群,目前 FDA批准ide-cel治疗既往至少接受过4线治疗的患者,但研究中既往接受过3线治疗的患者与≥4 线的患者结局相似。所有剂量的总缓解率 (ORR) 为73%,450x106 CAR T细胞的最终目标剂量ORR为81%,而非常好的部分缓解 (VGPR) 或更好的总体缓解率为52%,450x106细胞剂量为65%,所有剂量组的≥完全缓解 (CR)率为33%,450x106剂量组为39%。高危亚组也达到高缓解率,包括高肿瘤负荷、高危细胞遗传学、存在髓外病变(EMD) 或五药耐药亚组。通过二代测序,大多数达到 CR 的患者也达到了微小残留病 (MRD) 阴性状态(所有可评价患者中)。总体中位无进展生存期 (PFS) 为8.8个月,450x106 目标剂量组为12.2个月,中位总生存期 (OS) 为24.8个月,这在该重度难治性患者人群中是前所未有的。缓解持续时间 (DOR) 取决于缓解深度:获得≥CR 的患者为21.5个月、获得 VGPR 的患者为10.4个月、获得 PR 的患者为4.5个月。毒性包括84%的细胞因子释放综合征 (CRS)(3-4级,仅5%)和18%的神经毒性(3-4级,仅4%),即免疫效应细胞相关神经毒性综合征 (ICANS)。
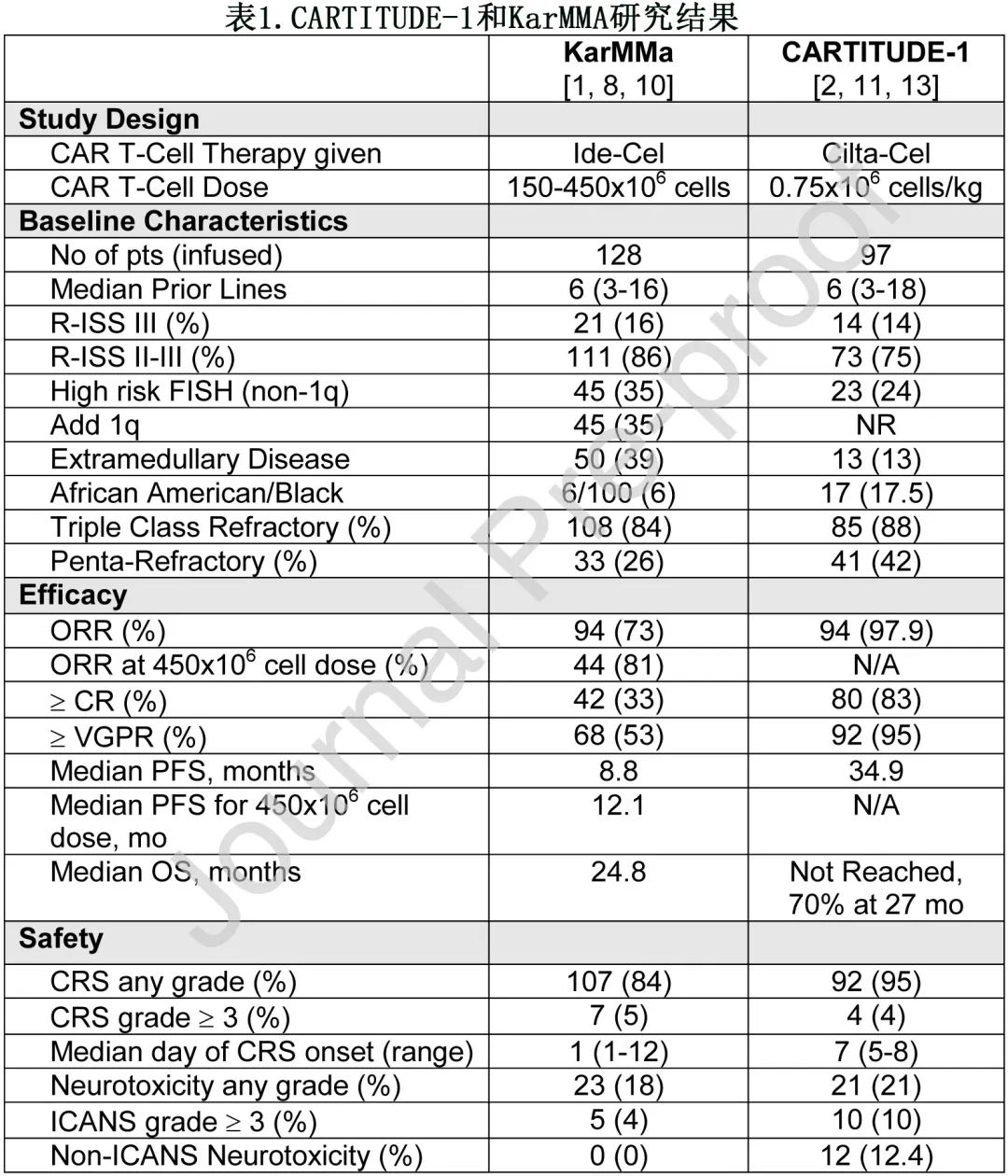
Ciltacabtagene autoleucel(cilta-cel)是基于 1b/2 期 CARTITUDE-1 研究的结果获得批准,该研究入组既往接受过至少3线治疗(包括一种PI、一种 IMiD 和一种抗 CD38 抗体治疗)的 RRMM 患者(但说明书要求4线既往治疗)(表1)。cilta-cel使用与 ide-cel 相似的 4-1BB 共刺激结构域,但 cilta-cel 有两个 BCMA 结合结构域,而 ide-cel 有一个 BCMA 结合结构域。cilta-cel 的剂量也不同,为0.75×106 CAR T细胞/kg 体重,而非固定剂量。97例患者中位既往治疗线数为6,21.9%有高疾病负荷(≥60%浆细胞),13.4%有EMD(KarMMa为39%)。ORR 为97.9%,82.5%在中位随访27.7个月时达到严格意义的CR(sCR)。MRD 阴性 CR 占44.3%。中位 PFS 为34.9个月,中位 OS 尚未达到,但27个月 OS 为70%。高危细胞遗传学、ISSⅢ期、高肿瘤负荷和 EMD 患者的 PFS 和 OS 较短。毒性包括95%的CRS(仅5%为3-5级),至 CRS 发作的中位时间为7天(ide-cel为1天),21%的神经毒性(10%为3-5级)。但cilta-cel的神经毒性不仅包括典型ICANS(16.5%),还包括12.4%患者的非典型神经毒性表现,包括6%患者的帕金森综合征,以及少量颅神经麻痹(最常见的是CN VII)、共济失调和周围感觉运动神经病变,至事件发生的中位时间为27天,至消退的中位时间为70天。
问题2. 可采用哪些缓解策略降低骨髓瘤 CAR T 细胞治疗后发生重度 CRS 和神经毒性的风险?
BCMA CAR T 细胞在 RRMM 中具有令人印象深刻的抗肿瘤效力,在接受多线治疗的患者中产生了前所未有的临床反应,但也存在与 CAR T 细胞扩增相关的免疫毒性,如 CRS 和ICANS,需要密切监测和快速干预。CRS 和 ICANS 的发生率和严重程度取决于 CAR 产品类型、疾病负荷和患者合并症。CRS 是由 CAR T 细胞与恶性浆细胞同时活化触发的细胞因子信号转导级联所致,与 CRS 相关的驱动细胞因子是白细胞介素-6(IL-6),可导致广泛的临床症状,范围从轻度流感样症状至重度多器官功能障碍。在ide-cel 和 cilta-cel 的关键研究中,≥3级CRS 的发生率较低,分别为5%和4%,均仅报告了1起5级 CRS 事件(表1)。
尚缺乏预测 CRS 和 ICANS 的经验证模型。几项研究报告了临床、生物学和产品相关特征与 CRS 和 ICANS 严重程度之间的相关性,显示基线高肿瘤负荷及高 CAR T 细胞扩增和持续存在与重度 CRS 相关,它们和≥2级 CRS 均与重度 ICANS 相关。合并神经病变以及环磷酰胺和氟达拉滨清淋也是ICANS 严重程度的独立预测因素。
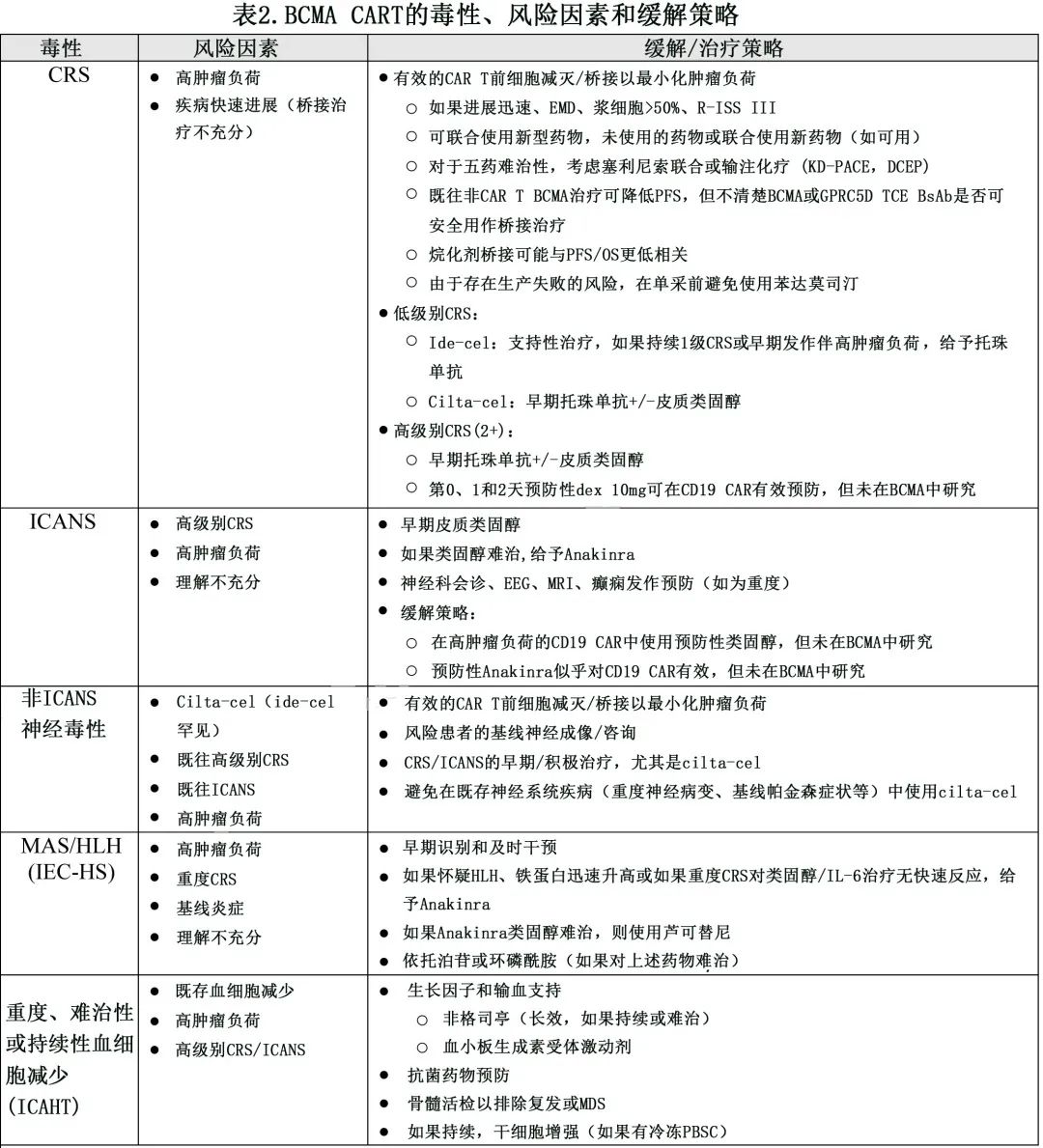
缓解 CRS 和ICANS的策略见表2。托珠单抗在弥漫性大 B 细胞淋巴瘤中的预防性给药显示,其可有效预防重度CRS,但 ICANS 率增加。预防性皮质类固醇和最近的白介素1受体拮抗剂anakinra也用于淋巴瘤CAR T,但尚不清楚这些策略如何影响骨髓瘤的疾病反应。CRS 和 ICANS 的最佳干预时机也尚不清楚,尽管在 B 细胞恶性肿瘤中进行的多项研究的数据表明早期干预有益。CAR T 输注前加强桥接以降低肿瘤负荷,对合并神经系统疾病的患者进行神经影像学和神经学会诊则是其他预防策略。通过早期和更积极的支持治疗和治疗(包括因≥2级 ICANS 住院)监测患者的 CRS 和 ICANS 也是监测和管理策略。对类固醇和托珠单抗无应答的患者应考虑接受其他细胞因子靶向治疗,如anakinra,以缩短副作用的持续时间并防止恶化。
神经毒性事件(包括ICANS)的临床表现各不相同,病程也高度可变;其病因尚不清楚,可与 CRS 同时发生或在 CRS 消退后数天发生。在某些情况下,神经毒性可能发生于治疗后>4周(促使 FDA 说明书禁止患者在输注后2个月内驾驶)。ide-cel 和 cilta-cel 的≥3级ICANS 率非常低,分别为3%和2%,但cilta-cel也与迟发性非典型神经毒性的风险相关,称为运动和神经认知治疗中出现的不良事件 (MNT),包括运动、认知和人格变化,与帕金森综合征相似。约5%的患者在cilta-cel治疗后中位27天观察到MNT。MNT的风险因素与 CRS 相似,确定为高肿瘤负荷、2+级CRS、任何级别 ICANS 或高 CAR T 细胞扩增/持续。因此,在随后的cilta-cel研究中实施了缓解策略,以尝试预防或尽量减少MNT,具体包括:使用更积极的细胞减灭术桥接治疗以降低基线肿瘤负荷,早期积极治疗 CRS 和ICANS,并将神经毒性监测延长至100天以上,在 CARTITUDE-2 和 CARTITUDE-4 研究中,通过这些预防措施,神经认知 MNT的发生率似乎降低至≤1%,但CARTITUDE-2 中的1例患者和 CARTITUDE-4 中的16例 (9.1%) 患者仍发生面神经麻痹。
问题3.除 CRS 和神经毒性外,CAR T细胞疗法还存在哪些特定风险?
血细胞减少,称为免疫细胞相关血液毒性 (ICAHT):
CAR T 细胞后的造血恢复通常延迟,在临床上表现为感染风险增加、危及生命的出血风险增加、资源利用增加和生活质量总体恶化。在一项包括试验性 BCMA CAR T 细胞治疗的研究中,所有细胞系中的≥2级血细胞减少均很常见,水平正常化平均需要6个月以上。此外,≥3级 CRS 或 ICANS 与1个月时计数未恢复显著相关。在ide-cel的真实数据分析中,约65%的患者在1个月后观察到≥3级血细胞减少,包括60%的患者中性粒细胞减少、38%的患者贫血和59%的患者血小板减少;第90天≥3级血细胞减少持续存在与基线骨髓浆细胞负荷升高相关。在 cilta-cel 全球研究中报告的部分国家,血细胞减少可导致与输血能力有限相关的发病率和死亡率显著增加。
在需要频繁输血和/或生长因子支持难治的重度或长期血细胞减少病例中,可考虑使用自体冻存CD34+外周血干细胞 (PBSC) 进行干细胞加强 (SCB) 而不使用预处理化疗,因为骨髓瘤患者通常PBSC可用。在1项研究中,在接受 CD19 CAR T 后接受异基因 PBSC 治疗急性淋巴细胞白血病 (ALL) 的7例患者中,SCB显示出有效的造血恢复疗效;在其他研究中,在接受 CD19 CAR T 后接受自体或异基因 PBSC 治疗淋巴瘤或 ALL 的9例可评价患者中,SCB显示有效的造血恢复。此外在23例接受 BCMA CAR T 治疗骨髓瘤后接受冷冻自体 PBSC 的患者中,18例显示有效的造血恢复。
免疫效应细胞相关性HLH样综合征(IEC-HS):
噬血细胞性淋巴组织细胞增生症 (HLH) 样高炎症反应目前认为是 CAR T 细胞治疗后的常见毒性,最常见于 CD22 CAR T 细胞,但也见于 BCMA 和 CD19 CAR T 细胞;但基于标准临床参数的 HLH 诊断标准与 CRS 有很大重叠。最近IEC-HS和专家制定的管理准则制定了一个更歧视性的标准,以便能够得到统一的承认和适当的干预。尤其是 BCMA CAR T 细胞,根据应用的诊断标准,高达22%的患者报告HLH样高炎症反应,对于这种可能危及生命的毒性,该比例相对较高。高剂量类固醇和anakinra常用于治疗,但有死亡的报道。早期识别、及时干预和制定治疗策略,对于确保在疾病早期接受治疗的患者中 CAR T 细胞的安全性增加至关重要(干预措施见表2)。
低丙球蛋白血症:
BCMACAR T 细胞疗法不仅可耗尽恶性浆细胞,还可耗尽正常浆细胞,从而导致浆细胞再生障碍性贫血、重度低丙球蛋白血症伴免疫球蛋白 G(IgG) 水平<400mg/dL以及感染风险增加。最初几个月内感染风险最大,但低丙球蛋白血症可持续数年。尚无明确的共识或前瞻性数据来指导使用静脉注射免疫球蛋白 (IVIG) 进行 CAR 后 T 预防治疗,但对于 BCMA CAR T 后 IgG 水平降至400mg/dL 以下的患者,许多专家建议开始预防性 IVIG 治疗(每月0.4 g/kg),即使在 CAR T 后的前几个月内无重度或复发性感染。这与骨髓瘤的非 CAR T 治疗建议相反,其中大多数指南建议仅在IgG<400和频繁/重度感染的情况下使用IVIG,主要是由于与 BCMA CAR T 细胞治疗后观察到的更严重的免疫功能障碍相比,标准骨髓瘤治疗后浆细胞完全耗竭较少(浆细胞再生障碍通常伴有 T 细胞和 B 细胞缺陷,类似于常见的多种免疫缺陷,有时还伴有长期中性粒细胞减少)。
也有人提出,IgG<400且 CAR T 后3个月未发生显著感染的患者可考虑参加试验,停止 IVIG 替代治疗并密切监测。然而,即使许多患者在无感染的情况下可以停用IVIG,也必须权衡特定患者的风险和获益,包括是否存在感染的其他风险因素,如 CD4 恢复延迟或中性粒细胞减少时间延长。
问题4. 哪些因素有助于选择一种 BCMA CAR T 细胞产品而非另一种产品?
尽管 ide-cel 和 cilta-cel 靶向作用机制相似的相同抗原,且已在既往接受过多线预治疗的三类暴露 RRMM 患者(中位6线既往治疗后)中进行了研究,但仍存在一些重要差异,包括 CAR T 构建体、细胞剂量、以及两项关键研究 KarMMa 和 CARTITUDE-1 中研究的患者人群(表1)。这些特征包括 KarMMa 中 EMD 的发生率较高 (39% vs 13%)、疾病分期较高(2-3期86% vs 75%)、细胞遗传学高危的数量较多 (35% vs 24%),但KarMMa中的五药难治患者较少 (26% vs 42%)。尽管已发表的一项针对 CARTITUDE-1 中cilta-cel与 KarMMa 中 ide-cel 的疗效结局进行的匹配校正的间接比较显示,cilta-cel的ORR、CR率、DOR和 PFS 高于ide-cel,但该比较未纳入 KarMMa 的患者水平数据,应谨慎解释。在缺乏随机对照试验或至少是真实世界头对头比较的情况下,很难说明一种 CAR T 产品的疗效是否优于另一种;然而可能是由于结合结构域不同(ide-cel小鼠 scFv,cilta-cel为2个骆驼 VH 结合结构域)和细胞剂量差异所致,CRS动力学存在显著差异(ide-cel的中位发作时间为第1天,cilta-cel为第7天),这意味着 cilta-cel 更可能适用于门诊给药,而如果门诊给药,ide-cel更可能需要在输注后几天内入院。
如果可以选择,许多患者更愿意接受迄今为止三类暴露 RRMM 缓解率最高和缓解时间最长的药物(CARTITUDE-1中cilta-cel组的 ORR 为97.9%,中位 PFS 为34.9个月)。因此,如果疾病可以在等待收集槽和制备时得到控制(惰性复发或具备有效的桥接治疗选择),那么在可能的情况下,cilta-cel可能是首选。然而,cilta-cel极高疗效的潜在权衡是非典型神经毒性的发生率更高,包括颅神经麻痹或帕金森综合征的风险,对于细胞减少不充分的骨髓瘤患者进一步增加。此外,cilta-cel的早期真实世界数据报告表明,生产失败率较高,也必须予以考虑(下文进一步讨论)。
一般而言,在骨髓瘤患者中,与高剂量化疗相比,两种产品通常耐受良好且毒性较小,即使在80多岁的患者中也可给药,并进行仔细监测。但是,可用于帮助确定一种产品相对于另一种产品的候选资格(生产槽的可用性除外)的另一个因素是患者合并症。例如,如果患者有基线神经系统疾病(癫痫发作、显著的周围神经病变或帕金森综合征的早期症状),则他们可能更适合 ide-cel 而非cilta-cel,因为 ide-cel 发生非典型神经毒性的风险非常低,或者如果患者有严重的基线神经系统问题,那么他们可能更适合风险更低的BsAb。此外,如果患者患有大包块疾病,由于缺乏桥接治疗的良好选择,预期难以进行细胞减灭(cytoreduce),可能使CAR T(尤其是cilta-cel)的风险增加。建议在无良好细胞减灭选择的高肿瘤负荷患者中避免使用cilta-cel,而对于CAR 前无显著 T 细胞减灭计划的疾病快速进展患者,避免使用任一CAR T 细胞产品。
问题5. 许多患者不符合用于批准 CAR T细胞试验的合格标准。临床试验环境之外的 CAR T 细胞治疗数据有哪些
从美国骨髓瘤 CAR T 联盟数据库发表的196例患者的真实世界数据中获得经验,这些患者在美国11家中心完成了 ide-cel 白细胞单采;159例患者接受 ide-cel 输注,其中17例患者因生产失败 (n=5) 或进展/死亡 (n=12) 而未接受CAR T,而其余患者在末次随访时仍在等待输注。该研究最值得注意的结果之一是,在真实世界中接受 ide-cel 的患者中,75%的患者由于显著的合并症而不符合 KarMMa 研究的条件,但疗效和安全性结果与 KarMMa 研究的结果非常相似,尽管真实世界中的患者病情更重、更虚弱。真实世界 ORR 为84%,CR为42%,中位 PFS 为8.8个月,OS为19.4个月。CRS(84%,5%为3+级)和ICANS(18%,3%为3+级)的发生率也与 KarMMa 几乎相同。
美国骨髓瘤 CAR T 联盟的另一项分析评价了28例肾损害患者亚组,肾损害定义为肌酐清除率<50mL/min或接受透析 (n=1)。尽管患者从 ide-cel 中获益,且 CRS 或 ICANS 风险未增加,但第30天时倾向于具有更长的住院时间和更高的3+级血细胞减少发生率,但到第90天时,血细胞减少与无肾损害的患者不再存在差异。氟达拉滨清淋剂量的调整在肾损害中非常重要,并作为 SOC 常规进行,74%的患者剂量降低>20%。ORR 为96%,CR率为58%,PFS为6.5个月,证实从大多数试验中排除、常见骨髓瘤人群中的安全性和疗效。
美国多发性骨髓瘤 CAR T 联盟最近也提出了第一个真实的cilta-cel安全性和有效性分析。在接受单采的153例患者中,143例接受了cilta-cel。在该队列中,57%的患者不适合参加 CARTITUDE-1 研究,但安全性和疗效与临床试验队列相当。在输注患者中,ORR为89%,CR率为56%,CRS(80%,3级:5%)和ICANS(18%,3级:6%)的发生率和严重程度与试验队列相似。在12%的患者中观察到迟发性神经毒性,最常见的为第7颅神经麻痹 (6%),1%的患者可见帕金森样综合征MNT。中位随访6个月时未达到中位PFS,6个月 PFS 估计为79%。
问题6.在产品制备过程中,五药难治性患者有效减少细胞以降低风险或控制骨髓瘤的桥接策略是什么?
目前在 RRMM 中制备 CAR T 细胞的过程使用患者的自体 T 细胞,这一过程大约需要5-10周,导致约5-30%的患者从未接受预期的 CAR T 细胞输注(真实世界 ide-cel为9%),部分原因是由于生产过程中疾病快速进展,较少见的原因是 CAR T 细胞未能充分扩增。因此,除伴有惰性生化进展的疾病进展缓慢的患者外,建议大多数患者采用桥接治疗。在 KarMMa 研究中,88%的患者接受了桥接治疗,仅有5%的缓解,但桥接选择仅限于患者已经接受的治疗(并且可能失败),并不适用于真实世界。在 CARTITUDE-1 研究中,75%的患者接受了桥接治疗,34%的患者肿瘤缩小。必要时,应在白细胞单采后不久开始桥接治疗,但大多数人建议在白细胞单采前(暂停治疗后)进行2周洗脱期(如果可行),并在清淋前再进行2周洗脱(桥接治疗后),以避免出现 T 细胞功能障碍和血细胞减少的问题。
可有效使用的桥接治疗的数据有限,但应谨慎在计划的 BCMA CAR T 治疗前使用 BCMA 靶向药物,因为 CARTITUDE-2 队列的近期前瞻性数据以及美国骨髓瘤 CAR T 联盟的 ide-cel 真实世界回顾性数据显示,既往接受过 BCMA 治疗的患者的预后相对欠佳。然而,值得注意的是CAR T 联盟报告中,在既往接受不同 BCMA CAR T 细胞治疗的5例患者中,所有5例患者均对 ide-cel 有反应,而大部分有害作用见于既往 BCMA 靶向 T 细胞结合双特异性抗体 (TCE BsAbs) 和抗体药物偶联物 (ADC)。尚不清楚进入 BCMA CAR T 的患者是否仍对 BCMA BsAbs 桥接有反应,是否会观察到相同的有害作用,因为在报告的数据中大多数可能对 BCMA 治疗难治,并且还没有使用 BsAbs 作为桥接治疗的数据。也不清楚针对不同靶点(如靶向 GPRC5D 的talquetamab)的 TCE BsAb 是否可能是更有用的桥接策略,以获得BCMA CAR T,尽管怀疑如果使用任何 TCE BsAb 作为桥接,应在 T 细胞采集后或洗脱期给药,以避免采集耗尽的 T 细胞作为 CAR T 生产的来源。
桥接治疗的其他选择包括塞利尼索为基础的联合治疗、烷化剂联合治疗(包括在当前治疗方案中添加环磷酰胺)或住院患者输注化疗(KD-PACE、DCEP等),还可以使用患者已经接受过但之前未联合使用的新型药物组合。然而,由于苯达莫司汀的清淋作用和 CAR T 制备失败的风险,应尽可能在白细胞单采前避免使用苯达莫司汀。在疾病进展迅速且无良好标准治疗选择的患者中,输注多药联合化疗可能有助于消除疾病,还可缓解后续 CAR T 毒性,如 CRS 和ICANS,因为细胞减灭效果更好(fit患者采用KD-PACE,有心脏病史或不fit患者采用 DCEP 或类似方案。
美国骨髓瘤 CAR T 联盟在 ASCO 2023 上报告各种桥接治疗后结局的更多信息,表明不需要桥接治疗的患者在 ide-cel 后的结局最好(可能是由于惰性疾病更多),此外烷化剂治疗桥接与 PFS 和 OS 较差相关,可能是由于需要烷化剂治疗的患者疾病特征更具侵袭性,但尚不清楚是否存在其他效应。因此,应谨慎使用烷化剂,通常在使用常规化疗时,还应考虑血细胞减少的风险和可能的感染。应进一步探索可增强 T 细胞适应性的药物(包括IMiD),以便在白细胞单采和桥接之前使用,一项已经探索这一点的研究是 KarMMa-2 队列3研究,在采集前和输注 ide-cel 后对 Auto SCT 后3个月未达到 CR 且早期复发风险高的患者进行来那度胺预激 (NCT03601078)。
问题7.有了多种靶向 BCMA 的治疗选择和模式(CAR T细胞、双特异性T细胞衔接抗体),对 BCMA 靶向治疗进行排序有哪些考虑?
FDA 批准的靶向 BCMA 的产品目前包括2种 CAR T 细胞(ide-cel和cilta-cel)和2种 T 细胞结合 (TCE) BsAbs(teclistamab和elranatamab),目前都需要三类暴露和4线既往治疗。虽然之前批准的 BCMA ADC belantamab mafodotin 现在只能通过同情使用获得,但预计在未来几个月内,靶向 BCMA 的产品列表将继续增长,并且在没有头对头试验的情况下,如何选择一个而不是另一个方面的决策将变得复杂。一般而言,TCE BsAbs比 CAR T 细胞产品具有优势,因为它们是“现成的”,可立即获得,而目前获批的自体 CAR T 细胞产品最多需要在2周后采购单采槽,等待数周才能生产;CAR T 细胞也有5%-20%的制造失败风险,取决于产品。因此,由于疾病快速进展而需要立即治疗的患者将转至现成产品,如TCE BsAbs,而复发可控或爆发性较低的患者能够等待一个月的 CAR T 细胞。即便如此,异基因 CAR T 细胞产品目前正在研究中,一旦可用,将不会有与自体产品相同的时间限制。对于那些有成功桥接治疗选择并能获得 CAR T 细胞产生槽的患者,CAR T细胞的“一次性”输注可优于 TCE BsAbs(需要长期持续注射)。两者均需要住院一周或非常密集的门诊监测 CRS 和 ICANS 1-2周;但与 CAR T 相比,BsAbs两个副作用的严重程度通常较低,尤其是重度神经毒性的风险较低。
对于目前正在接受TCE BsAb 的患者该怎么办,应该继续维持长期治疗还是将其用作桥接CAR T 细胞治疗?虽然在对 BCMA 靶向 BsAbs 持续应答的情况下转至 CAR T 的数据有限,数据显示既往 BCMA 双特异性治疗后疾病复发与 ide-cel 或 cilta-cel治疗后 PFS 较差相关。因此,在 BCMA BsAbs 治疗后疾病进展时CAR T挽救治疗可能不是最佳选择,尽管如果是首次接受 BCMA 靶向治疗,CAR T 后复发时患者通常仍可对其他 BCMA 靶向治疗(不同的 CAR T 或BsAbs)产生应答。
如上所述,CAR T细胞治疗的一个独特优势是一次性给药,这与需要重复给药且可能持续给药的 TCE BsAbs 形成鲜明对比。这种无治疗间期对于许多骨髓瘤患者可能相当重要,因为许多患者自诊断后从未真正有过无治疗期。而支持 BsAbs 的一个反驳论点是,它们不需要清淋化疗。对于免疫功能已经受损的骨髓瘤患者,氟达拉滨和环磷酰胺的清淋很容易增加免疫抑制和血细胞减少,通常需要在等待制备的同时进行毒性桥接治疗,并可能增加继发性恶性肿瘤的风险,因此,更虚弱或全血细胞减少的患者可能更适合BsAbs。BsAbs 也不需要像 CAR T 细胞一样靠近转诊中心2个月,避免驾驶2个月。年龄通常不是影响 BCMA CAR T 生理适应性的决定性因素,因为通常对80多岁的骨髓瘤患者给予 CAR T 细胞和BsAb,并且观察到 BCMA CAR T 的毒性远低于自体干细胞移植。然而对于处于更虚弱的人来说,由于毒性不太严重,BsAbs可能是一个很好的选择。
teclistamab 的 I/II 期 Majestec-1 研究显示,在与 KarMMa 和 CARTITUDE-1 研究相似的患者人群中,ORR为63%,中位 PFS 为11.3个月。elranatamab 的 II 期 MagnetisMM-3研究显示,15个月时 ORR 为61%,≥CR率为35%,PFS为51%,在14.7个月随访时未达到中位PFS。既往接受过 BCMA 治疗的亚组中,elranatamab的 ORR 为33%。两种 BCMA-CD3 TCE BsAbs 均获批用于既往4线治疗后的三类暴露 RRMM 患者(与两种 CAR T 的适应症相同)。尽管两种 BsAbs 的缓解率均略低于 CAR T 细胞,但在后线RRMM(如塞利尼索)中仍显著高于其他非 T 细胞重定向治疗,可以认为,BsAbs的 PFS 为11-15个月,与 ide-cel 非常相似(450 x 106目标剂量为12.2个月,所有剂量为8.8个月),因此,尽管必须继续注射直至疾病进展,但对于部分患者可能具有相同或更高的价值。然而,在 CARTITUDE-1 中,cilta-cel的中位 PFS 为34.9个月,因此在没有头对头试验的情况下,cilta-cel似乎是可用的最持久选择。此外,在EMD、III期 R-ISS 和浆细胞≥60%的患者中观察到 BsAbs 的缓解率较低,因此这些患者可能更适合积极的细胞减灭桥接治疗和CAR T(如可能)。
美国 MM 免疫治疗联盟(前称美国 MM CAR T 联盟)和研究正在协助确定这些关于 CAR T 和 BsAbs 的 BCMA 治疗排序问题的真实世界答案。需要在 RRMM 特定亚群中获得更多真实数据,例如肾损害、基线血细胞减少、重度肿瘤负荷或体能状态下降患者。也在进行相关研究,以探究 BCMA 靶向治疗后 BCMA 的表达模式。CAR T 后通过双等位基因缺失缺失缺失 BCMA 表达是罕见的,但新出现的数据显示,尽管在 TCE BsAb 治疗后复发的患者 MM 细胞上持续表达BCMA,但通常会发生影响 BCMA 胞外 BsAb 结合域的 BCMA 基因突变。这是否导致部分 TCE BsAbs 无法识别BCMA,而其他 BsAbs无影响?这就引出了一个问题:如果需要通过 TCE BsAb 桥接CAR T,是否应该使用靶向完全不同抗原(如抗GPRC5D Talquetamab)的TCE BsAb,或是否应该保留该不同靶点用于BCMA 后进展。
问题8. 是否有 T 细胞标志物可预测 CAR T 细胞治疗后的不良预后,以及 CAR T 细胞在病程早期可能更有效的原因是什么?
尽管缓解率较高,但 CAR T 后仍可能疾病进展,潜在原因包括与肿瘤、肿瘤微环境和 CAR T 细胞本身相关的因素。CAR T 细胞扩增和持续存在的能力被认为对预后有直接影响。B 细胞恶性肿瘤的早期研究表明,中央记忆 T 细胞的持续存在对预后有积极影响,并且细胞产物的组成影响输注后这些细胞的存在,初始和干细胞样记忆 T 细胞数量与扩增相关。然后,预生产白细胞单采产品中CD8+CD45RO−CD27+ T细胞(初始或记忆样)的频率确定为 CLL 队列中 CD19 CAR T 细胞后与疾病反应相关的主要因素。进一步的研究将该理论扩展到 BCMA中,并显示在白细胞单采时CD8+CD45RO−CD27+ T细胞较高和 CD4/CD8 比值较高的骨髓瘤患者中,生产产品的抗原应答细胞毒性增加。此外,CD8+CD45RO−CD27+ T细胞的频率和 CD4/CD8 比值在病程和复发时降低。尽管尚不清楚 CAR T 细胞扩增或持续存在对于骨髓瘤 BCMA CAR T 细胞治疗的持久缓解是否必要,但近期的 ide-cel 数据支持 T 细胞表型的重要性,因为PFS≥18个月与缓解持续时间较短的患者相比,前者与单采材料(CD4+CD28+CD27+和CD8+CCR7+CD45RA+CD57-)中较高比例的初治和早期记忆(较少疲惫、较少衰老、增殖更好)T细胞相关,也与产品中功能性 T 细胞表型(BCMA刺激后分泌干扰素-γ)改善相关。
既往治疗可能直接影响 T 细胞健康度,多次复发患者的 T 细胞可能更容易发生活化诱导的细胞死亡。从诊断至复发,骨髓瘤患者的初始 T 细胞百分比随时间推移而降低,且在达雷妥尤单抗治疗后进一步降低,而达雷妥尤单抗暴露后的中央记忆 T 细胞更高。因此,白细胞单采的时间可能会显著改变产品中 T 细胞的组成。与骨髓瘤进展相关的 T 细胞区室变化还可能包括 Th17 T 细胞上调节性 T 细胞的升高以及耗竭标志物如PD-1、TIM3、LAG3和 TIGIT 的表达,其与增殖减少和效应功能降低相关,因此,在病程早期采集 T 细胞可能对预后产生积极影响。此外,在抗 BCMA/CD19 CAR T 细胞后接受早期 IMiD 维持治疗的患者出现 T 细胞再扩增和迟发性临床反应,因此在输注前或输注后操作产品也可能影响结果。剩下的问题包括,是否有耗竭或记忆的 T 细胞标志物,可以帮助预测对 T 细胞治疗的更好反应或预测那些不适合产生持久 CAR T 细胞克隆的标志物,这些答案可能最终有助于指导关于 CAR T 与 TCE BsAbs 的决策。
问题9. 正在进行哪些研究,随机研究中报告了哪些数据,以支持将 CAR T 细胞移至骨髓瘤二线或三线治疗?
两项探索性 II 期研究报告了二线骨髓瘤治疗中 CAR T 细胞的有利结局。KarMMa-2 队列 2a II 期研究 (NCT03601078) 评价了一线 Auto SCT 后18个月内早期复发后给予ide-cel,CARTITUDE-2队列 a II 期研究 (NCT04133636) 评价了既往1-3线治疗后给予cilta-cel。KarMMa-2 中 Ide-cel 作为二线治疗显示 ORR 为83.8%,6个月时 CR 率为45.9%,MRD阴性率为85%,中位 PFS 为11.4个月,而 CARTITUDE-2 队列A在1-3线既往治疗后显示 ORR 为95%,CR率为90%,12个月 PFS 为75%,中位尚未达到。然而这些研究只是概念验证,未进行随机以证明 PFS 更优。
幸运的是现在有两项单独的骨髓瘤 CAR T 随机研究的结果,在 ide-cel 和 cilta-cel 的早线治疗背景下(表3),正等待 FDA 的审查用于批准早线治疗(ide-cel为不考虑治疗线的三类暴露后患者,cilta-cel为PI暴露和来那度胺难治的既往接受过至少1线治疗后)。随机 III 期 KarMMa-3 研究 (【N Engl J Med】Ide-cel对比标准方案治疗RRMM的3期研究结果) 入组既往接受过2-4线治疗的三类暴露 RRMM 患者,并以2:1的比例随机分配至 ide-cel vs 研究者选择的5种 SOC 方案之一,即达雷妥尤单抗/泊马度胺/地塞米松 (Dara/Pom/dex)、Dara/硼替佐米/dex(Dara/Vel/dex)、伊沙佐米/来那度胺/dex(Ixa/Len/dex),elotuzumab/Pom/dex(Elo/Pom/dex) 或卡非佐米/dex。66%为三类难治性,95%为达雷妥尤单抗难治性。主要终点为PFS,入组的386例患者中254例分配至 ide-cel 组,132例分配至 SOC 组,ide-cel组患者88.5%接受了CAR T。在中位18.6个月随访时,ide-cel组的中位 PFS 为13.3个月,SOC组为4.4个月,增加了两倍以上 (HR=0.49; P<0.001)。ide-cel 和 SOC 的 ORR 分别为71%和42%,CR率分别为39%和5%,而 OS 数据尚不成熟。CRS 和 ICANS 率与 KarMMa 相似,88%的CRS,5%为3+ CRS,15%的ICANS,仅3%为3+ ICANS,未观察到帕金森综合征或颅神经麻痹。
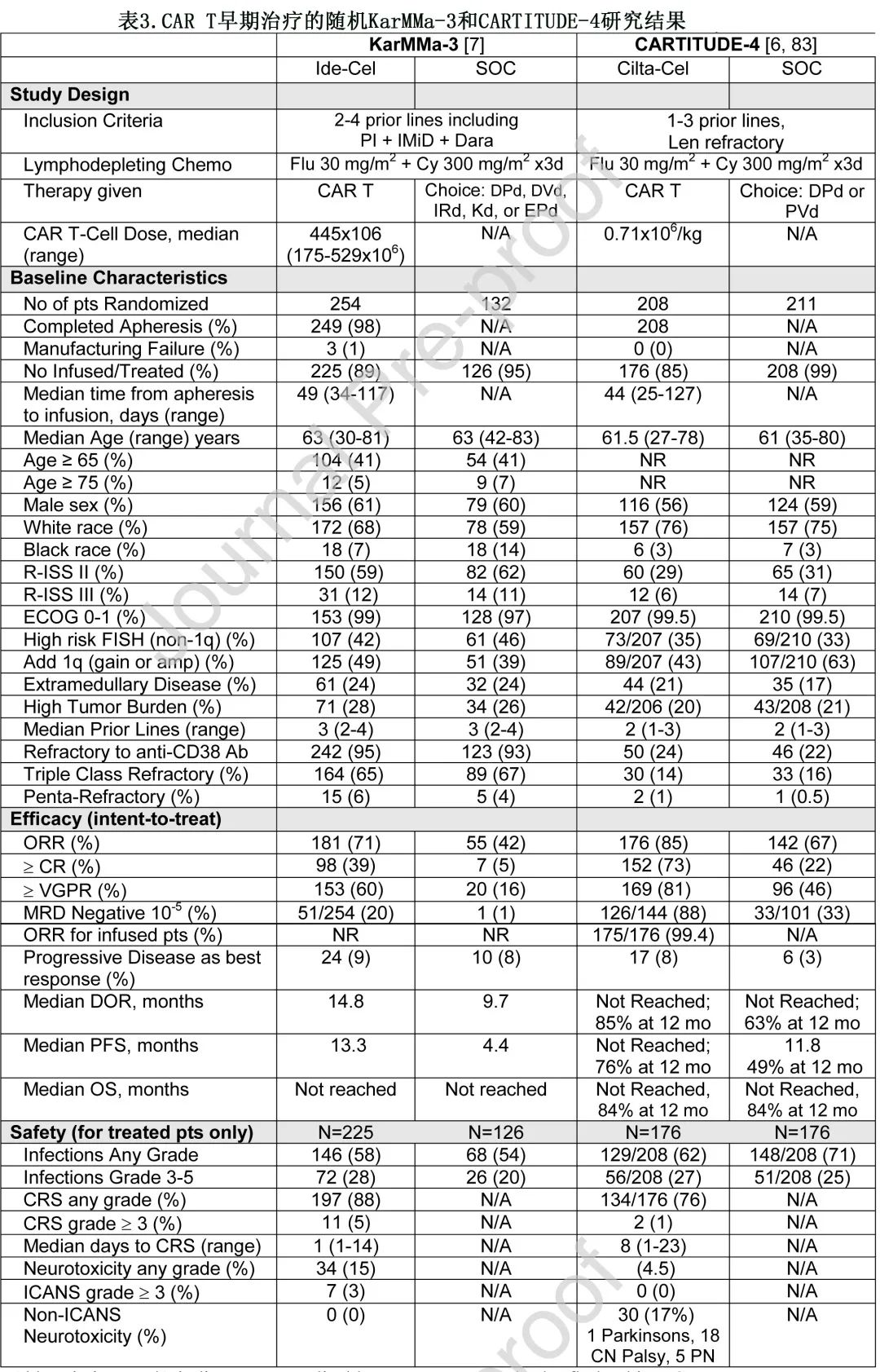
CARTITUDE-4(【NEJM】杨森/传奇CAR-T治疗来那度胺难治性多发性骨髓瘤优于标准治疗) 是一项随机 III 期研究,入组1-3线既往治疗后的来那度胺难治性 RRMM 患者,并比较了cilta-cel与研究者选择的 SOC 方案(Pom/Vel/dex或Dara/Pom/dex)。患者更早线,因为仅23%为 CD38 难治性(KarMMa-3为95%),14%为三类难治性(KarMMa-3为66%),73%既往仅接受过1-2线治疗(KarMMa-3为中位3线)。419例患者随机分配至 cilta-cel 组 (n=208) 或 SOC 组 (n=211)。主要终点是意向治疗随机化人群的PFS。未发生生产失败,176例 (85%)cilta-cel 组接受CAR T。中位15.9个月随访未达到 cilta-cel 组的中位 PFS vs SOC 组的11.8个月 (HR=0.26;P<0.001)。cilta-cel 组12个月时的意向治疗 PFS 为76%,SOC组为49%。cilta-cel 和 SOC 的 ORR 分别为85%和67%。CR 率为73% vs 22%,MRD阴性率 (10-5) 为61% vs 16%。在176例接受 cilta-cel 输注的患者中,ORR为99%,CR率为86%,MRD阴性率为88%(SOC为33%),而 OS 数据尚不成熟。在176例接受 cilta-cel 的患者中,76%观察到CRS,但仅2例 (1%) 3-4级。仅4.5%的患者发生ICANS(均为1级或2级),但1例发生帕金森综合征,9.1%发生颅神经麻痹(多为CN VII),2.8%发生 CAR T 相关周围神经病变,共17%(30/176) 发生非 ICANS 神经毒性(尽管采取了缓解策略)。
在早线骨髓瘤治疗中,与 SOC 选择相比,KarMMa-3和 CARTITUDE-4 中显著改善的 CR 率已转化为显著的 PFS 优势,因此基于 PFS 优势,CAR T细胞治疗很可能将cilta-cel和 ide-cel 上调至二线治疗,但仍需要FDA 审查所有数据。尽管尚未获得两项研究的成熟 OS 数据,但后续复发的大量治疗选择可能使 OS 数据对早线骨髓瘤的研究不太有用。此外,值得注意的是,许多患者目前正在接受四药诱导治疗和三药二线治疗,通常在1-2线治疗后即为三类难治性,2-3线治疗后为五药难治性,因此在骨髓瘤治疗的当前时代,等待 CAR T 用于5线治疗不再实用。关于提前 CAR T 的另一个论据是 RRMM 的高治疗流失率,仅有13%-35%的患者接受4线或更多线治疗(参考【Blood Cancer J】重新定义多发性骨髓瘤的治疗流失:加拿大骨髓瘤研究组分析);但尚不清楚这些患者中是否有人可通过早线 CAR T细胞治疗“治愈”,还应注意的是,一小部分患者最终可能会将慢性可控问题(如骨髓瘤)转变为潜在不可逆和使人衰弱的神经系统问题(如帕金森综合征或颅神经麻痹),因此早期使用 CAR T 的决定决不能掉以轻心,必须向患者彻底告知风险,并通过细胞减灭和 CRS/ICANS 早期积极治疗优化达到风险最小化,尤其是对于cilta-cel。
问题10. 正在进行哪些研究,将 CAR T 细胞移至骨髓瘤一线治疗需要哪些数据?
骨髓瘤目前无法治愈,治疗的类型和类别有限,但希望通过在适当的情况下或联合使用 T 细胞重定向治疗,可以开始看到更多的长期缓解,尤其是在早期使用时,此外T细胞功能更强,患者更健康。但必须充分认识到,为了获得更持久的缓解患者需要暴露的副作用(暂时性或永久性)。对于MM 后续治疗线,通常可以使用单臂或随机 II 期研究证明治疗干预有效(和安全),表明其符合监管批准所需的特定阈值。然而随着骨髓瘤一线治疗可用的高效且耐受性良好的联合治疗,必须在一线背景下设计 CAR T vs SOC 组的确证性3期研究。以最近的 III 期DETERMINATION研究做例子,它确保了当前一线治疗环境中自体 SCT 的作用,其基于自体 SCT 巩固治疗的 PFS显示,与非移植治疗相比,中位 PFS 增加21个月(67.5 vs 46.2个月)。
为阐明一线cilta-cel在适合移植的骨髓瘤中的作用,欧洲骨髓瘤网络 (EMN) 设计了国际 III 期随机 CARTITUDE-6 研究(EMN28,NCT05257083),在新诊断骨髓瘤患者接受 Dara-Vel/Len/dex(D-VRd) 四联诱导治疗后直接比较cilta-cel与自体 SCT 作为巩固治疗,计划在2026年前完成入组。该研究具有 PFS 和≥12个月持续 MRD 阴性 CR 率的双重主要终点,需要满足两个终点来证明获益。前2-3年内 MRD 阴性丢失将被用作较早指标,PFS将用作较晚指标,因为预计 PFS 需要数年才能有结果,并且这些结果将比 OS 提供更多信息,由于目前骨髓瘤患者的平均生存期为8-10年,因此可能需要10年以上的时间才能有OS差异。对于不适合或不希望考虑自体 SCT 的患者,正在进行随机 III 期 CARTITUDE-5 研究 (NCT04923893),以比较标准 VRd 诱导治疗后 len/dex 维持治疗与 VRd 后 cilta-cel巩固治疗。目前尚未获得这些高度预期的一线 CAR T 细胞研究的数据。
为了探索将 ide-cel 转移至一线治疗的作用,KarMMa-2队列3研究 (NCT03601078) 也正在进行中,对于 SCT 后3个月未达到CR,因此早期复发风险较高的患者,使用 ide-cel作为自体 SCT 后的巩固治疗。本研究中来那度胺也用于在白细胞单采前“预充”T细胞,并在 CAR T 细胞输注后1个月开始,以改善 CAR T 细胞的长期持久性。由BMT/CTN(BMTCTN 1902,NCT 05032820) 开展的一项类似研究也正在进行中,以评价 ide-cel在功能性高危患者中的作用(功能性高危定义为CAR T 细胞治疗前尽管进行了 auto SCT 和至少6个月的来那度胺维持治疗,但缓解不佳)。由于这些不是随机研究,尚不确定在这种情况下什么 PFS 是可接受的,但该数据与历史对照相比作为概念验证具有意义。然而随机 KarMMa-9 研究(CA089-1043) 目前正在开发中,将在一线 auto SCT 后第100天未达到 CR 的患者中比较ide-cel +来那度胺与来那度胺单药维持治疗。
问题11. 将 CAR T 细胞移至骨髓瘤的早期治疗线是否成本高昂,CAR T改善生活质量是否可证明成本差异的合理性?
将非常昂贵的 CAR T 细胞移至 MM 一线或二线治疗将产生的另一个问题在于,如果 CAR T 仅提供1-2年的PFS,成本是否值得。虽然 CAR T 的初始价格很高(ide-cel的标价为42万美元,cilta-cel的标价为46万美元,不包括支持治疗和住院时间),但它们是一次性输注,而标准骨髓瘤治疗在2年内的成本可能相似,复发时3-4药组合的费用很容易在前1-2年内超过 CAR T 细胞输注的价格(以美国药物价格计算)。因此与 SOC 相比,既往1-2线治疗后复发疾病的 CAR T 可能至少在经济上实现盈亏平衡。然而,一线患者接受3-6个月短期联合诱导治疗+/-相对便宜的自体SCT,然后通常维持单药维持治疗(有时为两药)3-6年直至复发,因此,一线 CAR T 的 PFS 至少需要几年才能弥补费用上的差异。此外价格也是巨大障碍。
尽管如此,即使最终 CAR T 的成本更高,前期负担更大,但可以认为,患者报告使用 CAR T 时观察到生活质量改善,并且能够停止治疗数年或至少数月,使患者有明显更好的体验和“正常”感觉。KarMMa-3 的患者报告结果显示,与 SOC 相比,疲劳、疼痛、身体功能、总体健康状况和生活质量测量显著改善;尽管与 SOC 治疗相比,在前1-2个月观察到生活质量测量值改善,但副作用更多,当比较一线 CAR T 与大剂量美法仑和自体 SCT 时,差异可能更显著。但只有一份报告阐述了这一点,骨髓瘤中需要更多数据。
问题12. BCMA靶向治疗后复发的患者有哪些选择,有哪些关于非BCMA T细胞重定向治疗的数据?
BCMA CAR T 细胞治疗后复发的骨髓瘤仍可能对其他 BCMA 靶向治疗(包括不同的 CAR T 或 BCMA TCE BsAbs)有反应,因为细胞通常仍表达BCMA,并且复发可能是由于 CAR T 细胞持久性丧失所致(但BCMA BsAbs 治疗失败后 CAR T 结局较差)。但这些患者在 BCMA 靶向治疗失败后(尤其是在一种以上 BCMA 靶向治疗失败后)有治疗选择非常重要。到目前为止,T细胞重定向治疗中研究最严格的2个非 BCMA 靶点是GPRC5D(正在开发的 CAR T 细胞和最近批准的1个TCE BsAb)和 Fc 受体样5(FcRH5,又名5cRL5/IRTA2/CD307)。GPRC5D 和 FcRH5 在骨髓瘤细胞上均过度表达,而在正常组织中表达有限。目前这些有前景的疗法大多仅在临床试验中给药,但 talquetamab(antiGPRC5D BsAb)于2023年08月10日获得 FDA 批准。
在理想情况下,BCMA CAR T后数年复发的患者可接受 GPRC5D CAR T,从而最大的停止治疗时间。2项独立的 I 期研究获得了关于 GPRC5D CAR T 细胞治疗疗效的初步数据。MSKCC 发表的 NEJM 研究(MCARH109)报告了17例患者,其中10例既往接受过 BCMA 治疗。在整个队列中观察到71%的缓解,10例既往接受过 BCMA 的患者中有7例缓解。在 450x106细胞剂量下,1例患者发生4级CRS,2例患者发生3级小脑疾病,而在 25-150x106细胞剂量下未发生小脑疾病或任何 ICANS 或高级别CRS。在 GPRC5D CAR T 细胞的 BMS 研究中报告了17例患者,其中7例 (41%) 既往接受过 BCMA 治疗(除1例外均为BCMA CAR T)。86%的患者缓解,6例既往 BCMA患者中有4例缓解。CRS 发生率为65%,中位发生时间为第3天,ICANS发生率为12%(均为1级)。所有患者均发生On-target off-tumor毒性,但均为1级,18%为皮肤变化,12%为指甲变化,12%为味觉障碍。小脑毒性的发生率似乎较低,但仍在进一步随访和剂量扩展队列中进行评估。
对于BCMA CAR T(和/或抗BCMA TCE BsAb)后复发且不适合其他CAR T 细胞产品或临床试验的患者,靶向 GPRC5D/CD3 的首创现成TCE BsAb talquetamab可选。在 II 期MonumenTAL-1 注册研究的232例患者(中位既往治疗线数为6)中,味觉障碍是一种剂量限制性副作用,见于57-63%的患者。77-80%的患者发生CRS(除1起事件外,其余均为1-2级),67-70%的患者发生皮肤相关事件(皮疹)(除1起3级事件外,其余均为1-2级)。ORR 为64-70%,DOR为7.8-10.2个月,取决于剂量,因为每周一次和每两周一次皮下给药选择均经过检测并获得批准。
Cevostamab(抗FcRH5xCD3 BsAb)是另一种在既往暴露于 BCMA 的患者中具有显著活性的药物。在16例患者的 I 期 GO39775(NCT03275103) 研究中,4例患者对 BCMA 治疗难治。ORR 为94%,其中sCR 7 例,CR 3例,VGPR 5例,PR 1例。数据截止时16例缓解患者中的13例仍处于缓解状态。与其他 BsAb 一样,Cevostamab与感染风险增加相关,但治疗持续时间固定为17个月,以避免长期暴露。
固定持续时间 BsAbs的研究正在进行中,以降低感染风险,还有联合使用2种 BsAbs 或与 IMiD 或其他疗法联合,以尝试在早线治疗 (MonumenTAL-6、Majestec-7、Majestec-4/EMN30) 和后期治疗 (RedirecTT-1、MM22-947) 中获得更持久的缓解。Ib 期重定向 TT-1 研究 (NCT04586426) 是在 ASCO 2023 中首次报告抗BCMA+抗 GPRC5D BsAb (teclistamab +talquetamab)双联治疗在三类暴露 RRMM 中的初步结果。对于报告的前63例患者,中位既往治疗线数为5,78%为三类难治性,43%患有骨EMD,在14.4个月随访时,81%患有CRS,仅3%为3级,仅1例患者患有ICANS。在推荐的 II 期剂量下,EMD患者的 ORR 为92%(12/13),总体为83%(5/6),CR率为31%,EMD为33%。尚未达到中位PFS。这些结果可以其他在不久的将来为多线 CAR T 后复发性 RRMM 患者提供更多的选择,且其他正在进行的研究在联合免疫治疗方式时可能会产生更好的反应。
参考文献
Jr LDA,et al. CAR T-Cell therapy for Myeloma: Where are we now and what is needed to move CAR T-cells forward to earlier lines of therapy? Expert Panel Opinion from the American Society for Transplantation and Cellular Therapy.Transplant Cell Ther . 2023 Oct 30:S2666-6367(23)01644-5. doi: 10.1016/j.jtct.2023.10.022.
作者:聊聊血液
版权声明:
本网站所有注明“来源:梅斯医学”或“来源:MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明“来源:梅斯医学”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言