中国青年学者一作!《Science Immunology》:促进T细胞杀伤敏感,克服前列腺癌免疫治疗耐药性
2023-05-14 BioMed科技 网络
前列腺癌免疫治疗耐药性新突破

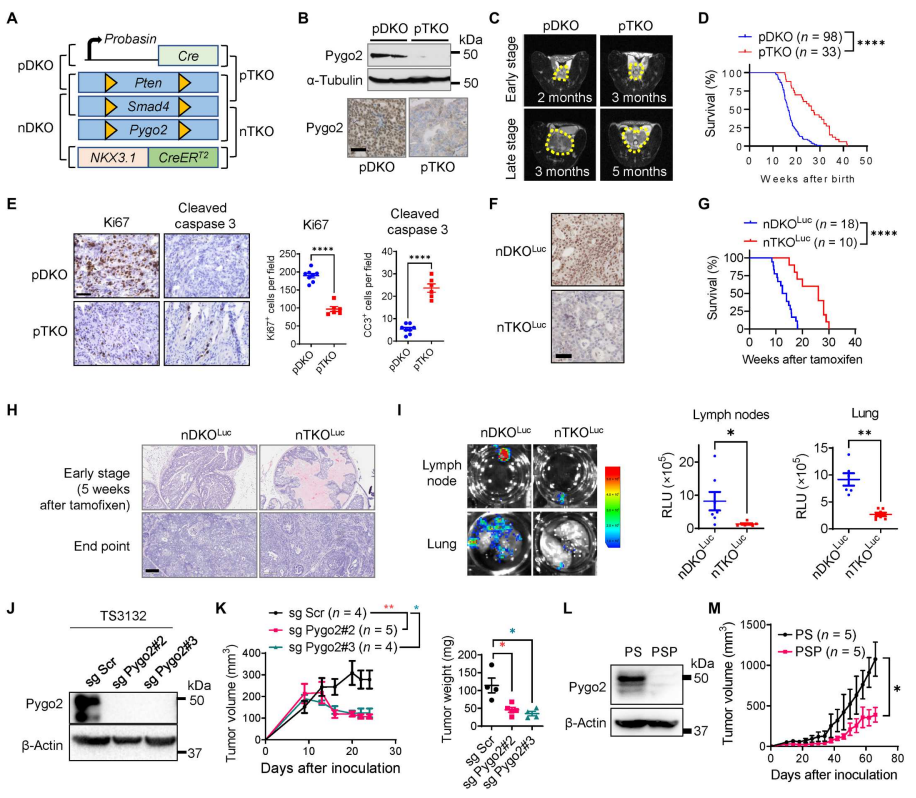
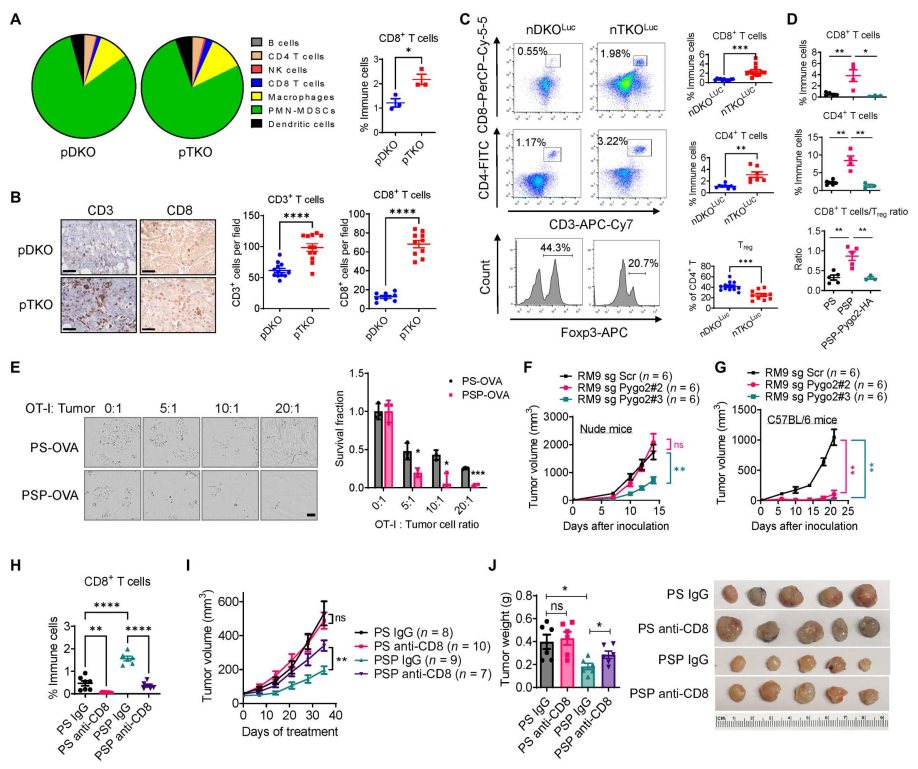
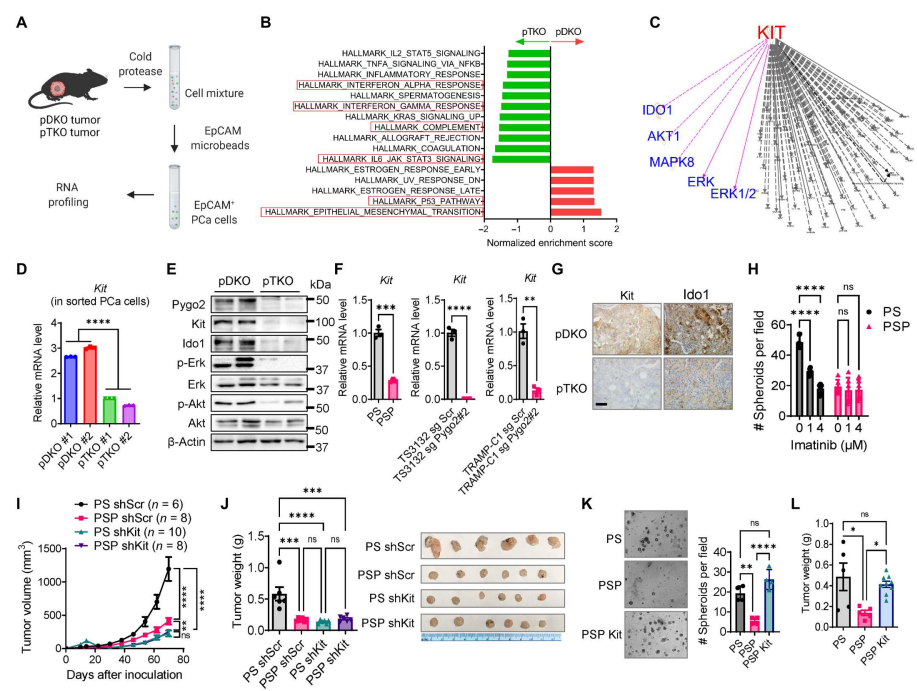
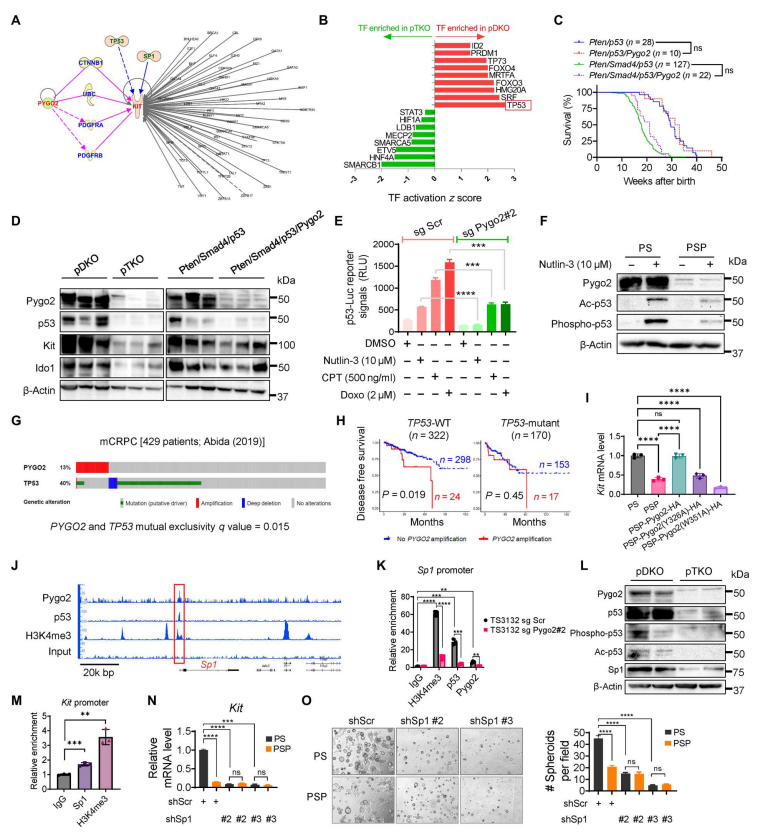
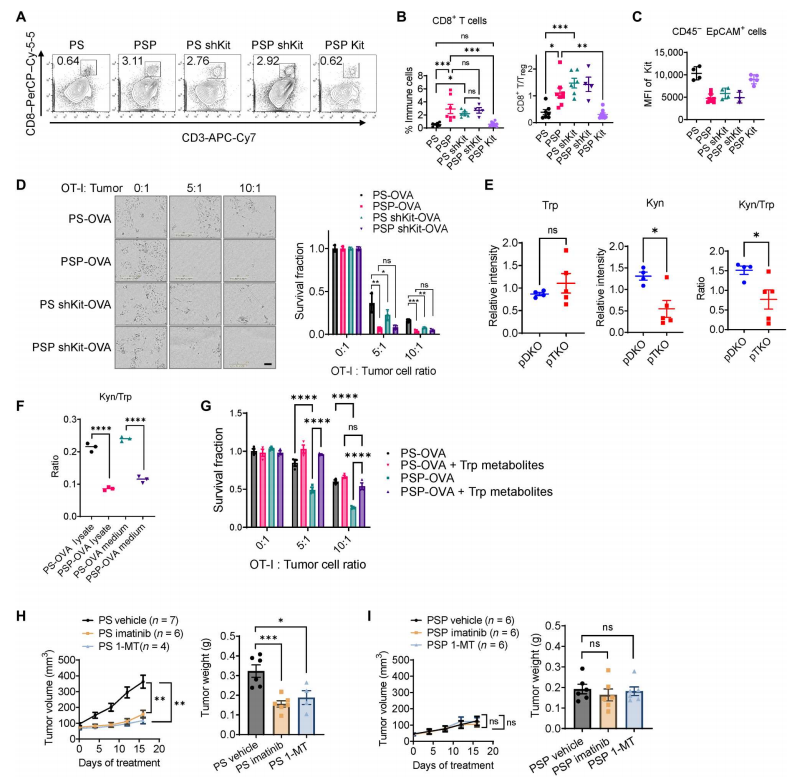
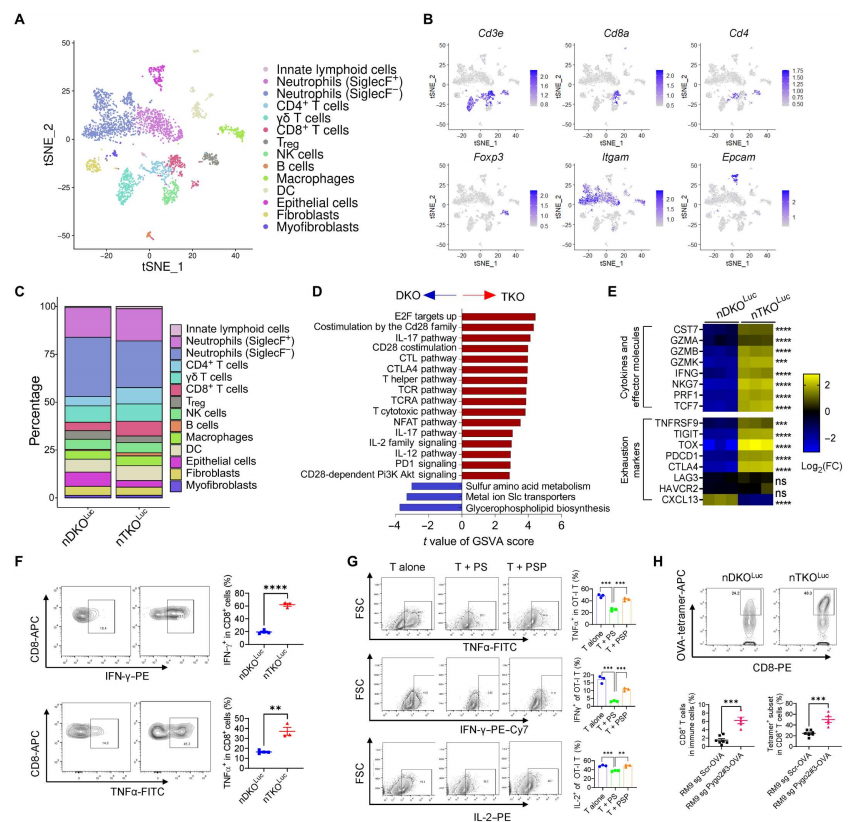

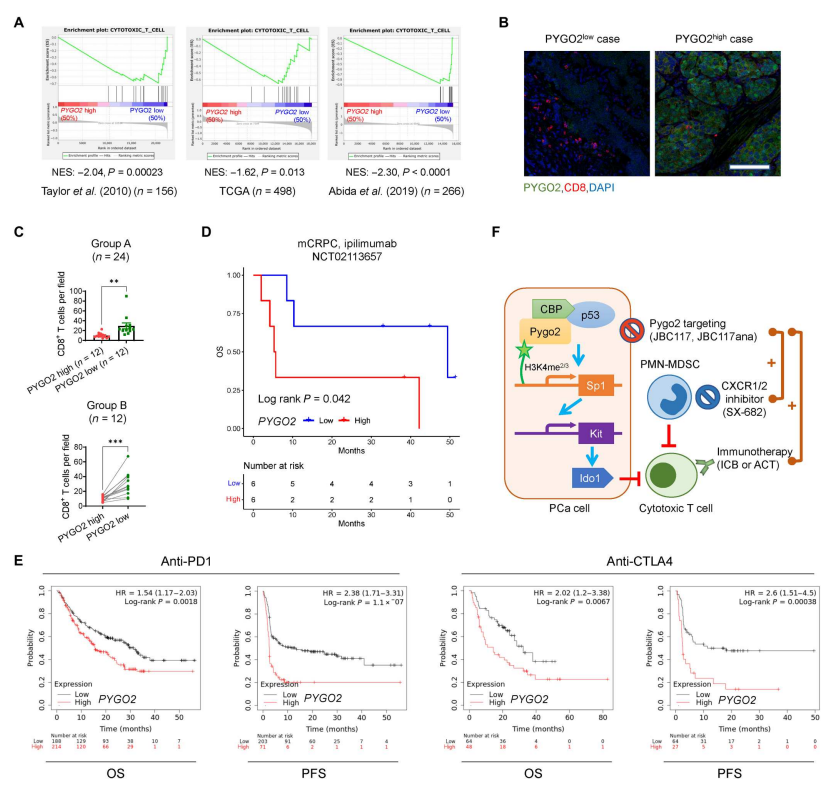
和较差的预后相关】
作者:BioMed科技
版权声明:
本网站所有注明“来源:梅斯医学”或“来源:MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明“来源:梅斯医学”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言
小提示:本篇资讯需要登录阅读,点击跳转登录