Circ Res: Sox17缺失通过HGF(肝细胞生长因子)/c-Met信号促进肺动脉高压
2022-10-14 网络 网络
本研究针对Sox17(SRY-related HMG-box17)通路受损对PAH的功能影响及作用机制进行了探索,并探讨了其作为治疗靶点的潜力。
研究背景:
在大规模的基因组测序的研究中,Sox17(一种内皮特异性转录因子)被认为是肺动脉高压(PAH)的一个假定的致病基因;然而,其作用和分子机制仍有待阐明。本研究针对Sox17(SRY-related HMG-box17)通路受损对PAH的功能影响及作用机制进行了探索,并探讨了其作为治疗靶点的潜力。
研究方法:
在成年小鼠中,肺内皮细胞(ECs)中的Sox17缺失在缺氧条件下诱发PAH,其外显率和严重程度都很高,但在常氧条件下则不然。
研究主要结果:
肺动脉高压(PAH)疾病的关键特征,如肺动脉血管的高度重构、内皮细胞(ECs)的增生和炎症、右心室肥大和肺动脉压力的升高,即使在常氧环境下,长期休息后也持续存在。从作用机制上讲,转录组分析预测,Sox17的缺乏和缺氧的结合激活了肺部ECs的c-Met信号。HGF(肝细胞生长因子)是c-Met的配体,在Sox17缺失的肺部ECs中被调高。在预防和治疗方面,药物抑制HGF/c-Met信号的作用减弱并逆转了PAH的特征。与动物模型的研究结果相似,26.7%的PAH患者(15人中的4人)肺部ECs中的Sox17水平被抑制,而所有14个非PAH对照组中的Sox17水平都很高。86.7%的PAH患者(15人中的13人)肺动脉血管中的HGF水平增加,但对照组未显示这种情况。
研究结果细节:
-
Sox17缺陷和缺氧共同诱发持久性PAH的高外显率。
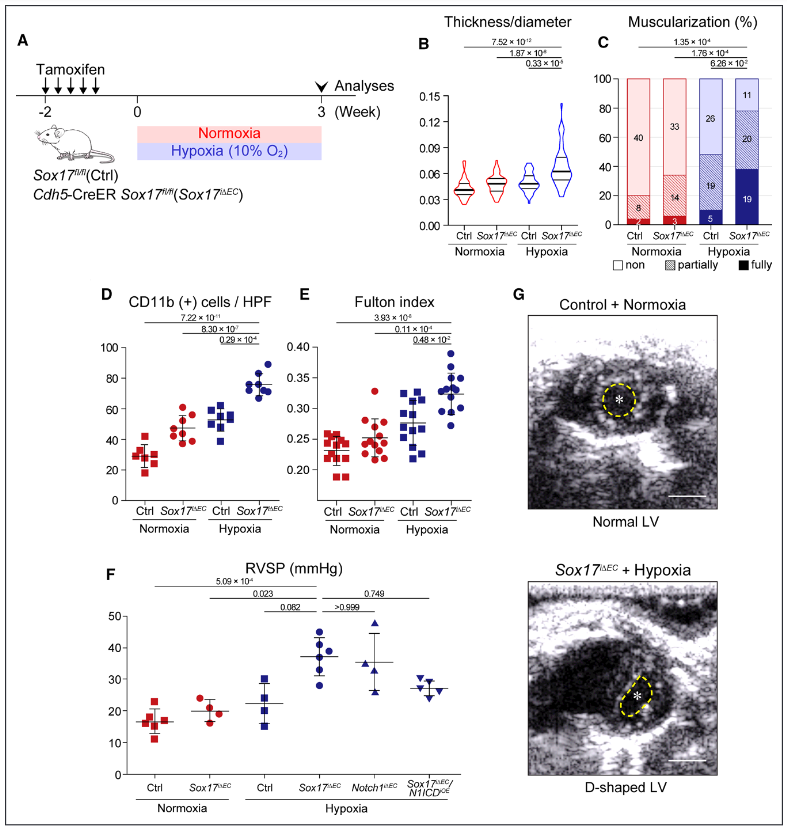
图1. 内皮细胞Sox17缺陷诱导小鼠严重的肺动脉高压(PAH),具有高外显率。A,Sox17缺失诱导的PAH的实验时间表。对照组和Sox17i∆EC小鼠暴露在常氧或低氧环境中3周。B-E,暴露于缺氧的Sox17i∆EC小鼠显示出典型的PAH病理特征,表现为肺壁厚度增加(B)和远端肺动脉血管的过度肌肉化(C),CD11b+细胞的肺部浸润增加(D),以及用Fulton指数测量的RV肥大(E)。F,Sox17i∆EC/缺氧小鼠显示PAH的血流动力学证据,包括RVSP升高,以及D型左心室(LV),与对照组小鼠的正常LV形状形成对比。星号和黄线分别表示左心室腔和心内膜边界。
2. 低氧诱导的PAH因Sox17缺陷而加剧,是ECs过度增殖的基础
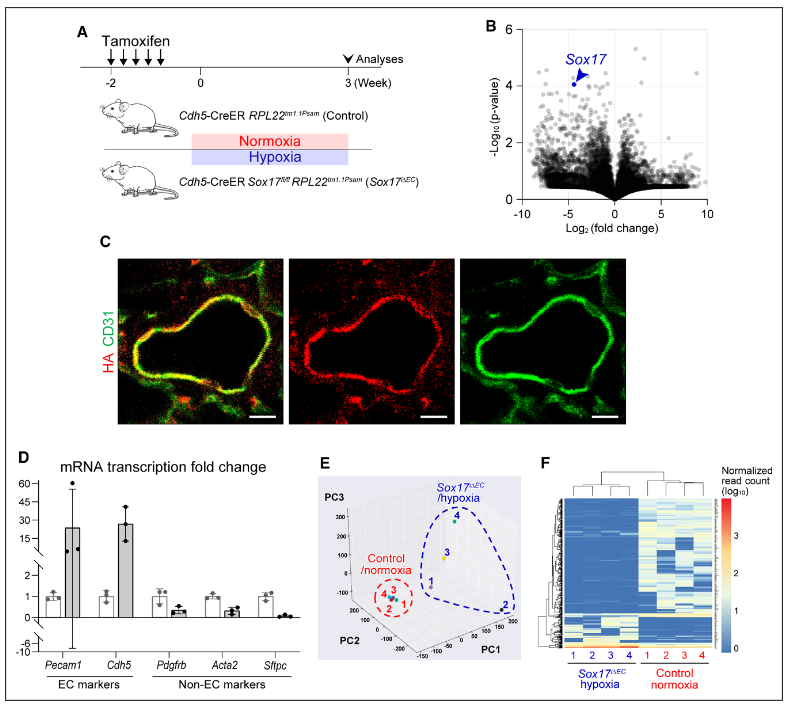
图2.肺内皮细胞(ECs)的转录组分析的验证。A,分离肺部内皮细胞富集的转录物的实验策略。Cdh5-CreER2; RPL221,1Psam小鼠作为对照组维持在常态下,Cdh5-CreER2; Sox17fl/fl RPL221,1Psam小鼠作为Sox17i∆EC/缺氧组在他莫西芬给药后暴露在缺氧环境中,这使得血凝素(HA)标记的核糖体在ECs中特异性合成。然后收获了肺部组织。B,对照组和Sox17i∆EC/缺氧小鼠的肺部ECs中差异表达基因的火山图。Sox17以蓝色突出显示,证实其水平下降。C,免疫荧光图像验证了肺部EC特异性HA免疫染色的情况。D,捕获HA标记的核糖体所引起的EC和其他细胞类型的标记基因的转录本的倍数变化。用于RNA测序的肺部组织样本的转录水平通过定量PCR验证。E, 三维主成分(PC)分析和(F)无监督聚类清楚地将对照组和Sox17i∆EC/缺氧组的RNA测序数据分开。
3. Sox17缺失促进了缺氧环境下ECs的异常增殖和炎症激活。
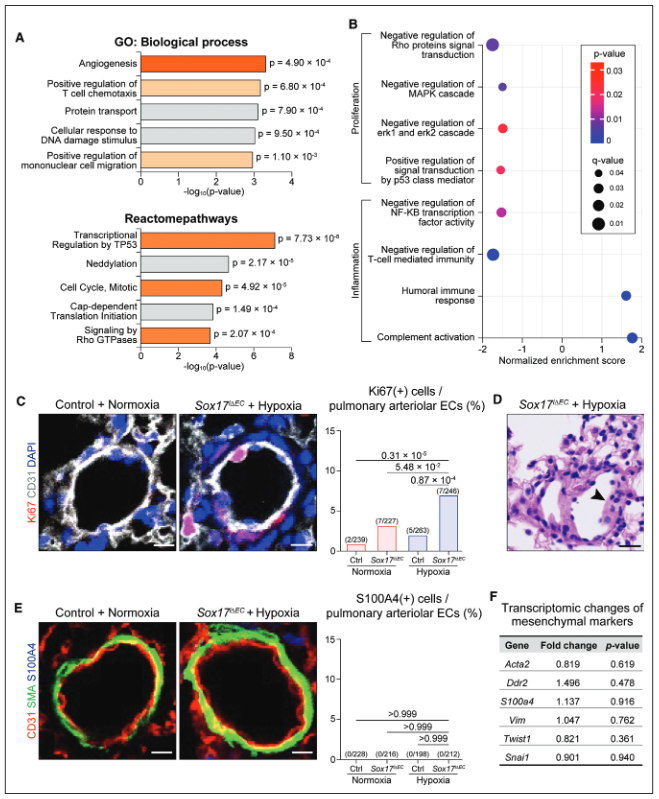
图3.Sox17的缺失促进了缺氧压力下肺内皮细胞(ECs)的异常增殖和炎症激活。A,通过基因(GO)分析,前5个富集的基因,与细胞增殖相关的基因组显示为深橙色,与炎症相关的基因组显示为浅橙色。B,与细胞增殖和炎症有关的GSEA结果的点图。C,远端肺动脉血管中Ki67的免疫染色,这是一种增殖的标记,并对ECs进行量化。D,组织学图像显示Sox17i∆EC/缺氧小鼠的肺动脉血管因ECs的异常堆积而湮灭。E,远端肺动脉血管中S100A4的免疫染色及其在ECs中的定量。F,根据RNA测序数据,间质标志物没有明显的转录变化。
4. 通过调节HGF/c-Met途径挽救PAH的发病机制。
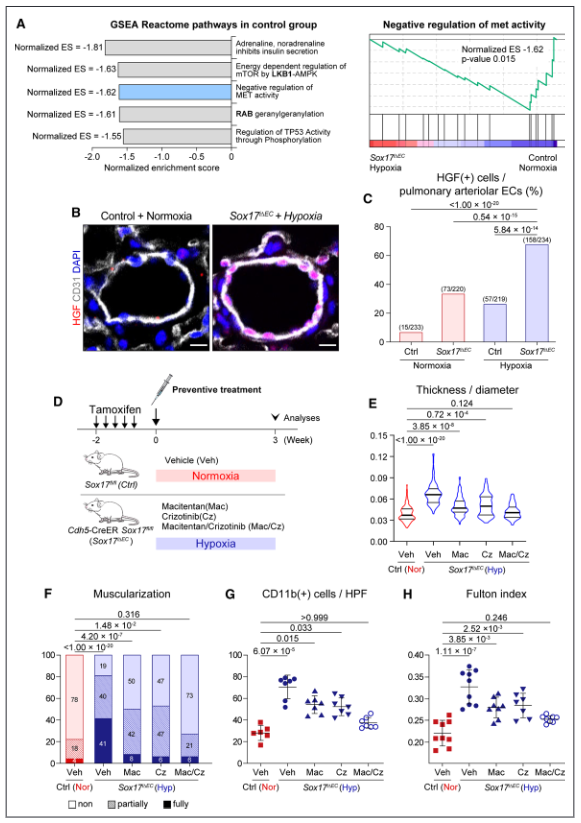
图4.抑制HGF(肝细胞生长因子)/c-Met信号传导可以防止Sox17的缺失所引起的PAH的疾病进展。A,通过基因集富集分析(GSEA;左)和GSEA图显示Sox17i∆EC/缺氧小鼠中c-Met信号的负调控(即激活)的负富集(右),排名靠前的反应组途径。B,Sox17i∆EC/缺氧小鼠远端肺动脉血管中HGF上调的代表图像。C,各实验组小鼠远端肺动脉血管中HGF+内皮细胞(ECs)的百分比。D,预防性抑制c-Met的实验时间计划。E-H,c-Met抑制联合马西坦对PAH表型的削弱与对照组小鼠相当,表现为肺动脉远端壁厚减少(E)和肌肉化(F),CD11b+细胞的肺部浸润减弱(G),并改善了RV肥大(H)在Sox17i∆EC/缺氧小鼠中。
5. c-Met抑制剂可逆转临床前PAH小鼠模型。
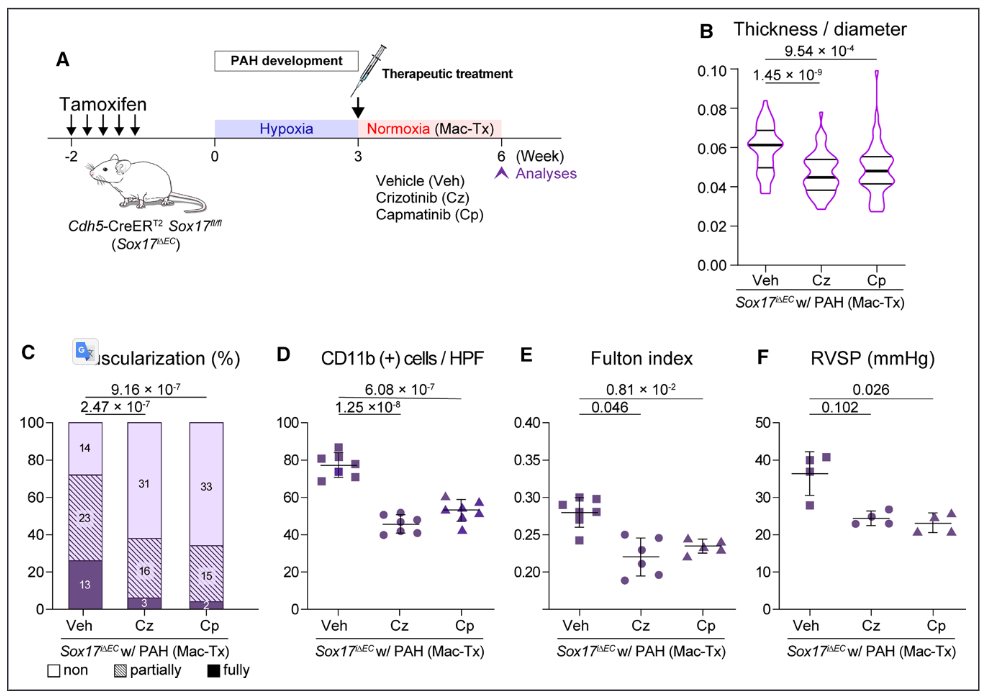
图5.c-Met抑制剂可逆转已建立的肺动脉高压(PAH)动物模型。A, c-Met抑制治疗的实验时间计划;B-F,通过抑制c-Met与马西坦结合,逆转了Sox17i∆EC小鼠的PAH表型,表现为壁厚减少(B)和远端肺动脉血管的肌肉化(C),CD11b+细胞的肺部浸润减少(D),改善房室肥大(E),以及降低房室收缩压(F)。E-H,在Sox17i∆EC/缺氧小鼠中,c-Met抑制联合马西坦对PAH表型的削弱与对照组小鼠相当,表现为肺动脉远端壁厚减少(E)和肌肉化(F),CD11b+细胞的肺部浸润减弱(G),并改善了RV肥大(H)。
6. PAH患者中得到验证!
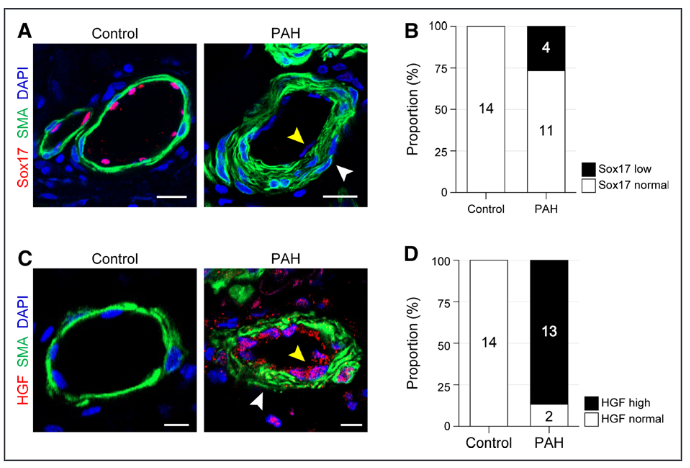
图6.与对照组相比,肺动脉高压(PAH)患者的肺动脉内皮细胞(ECs)中Sox17表达受抑制,HGF(肝细胞生长因子)表达增加。A, 对照组和PAH患者的肺组织切片中的Sox17进行免疫染色。B,Sox17在肺动脉血管中的表达水平比例。C,对照组和PAH患者的肺组织切片中HGF的免疫染色。D,肺动脉血管中HGF表达水平的比例。
研究结论:
肺动脉血管中Sox17水平的下调增加了对PAH的易感性,尤其是在缺氧环境下。 该研究结果表明,HGF/c-Met信号的反应性上调是治疗PAH的一个新的可药用的目标。
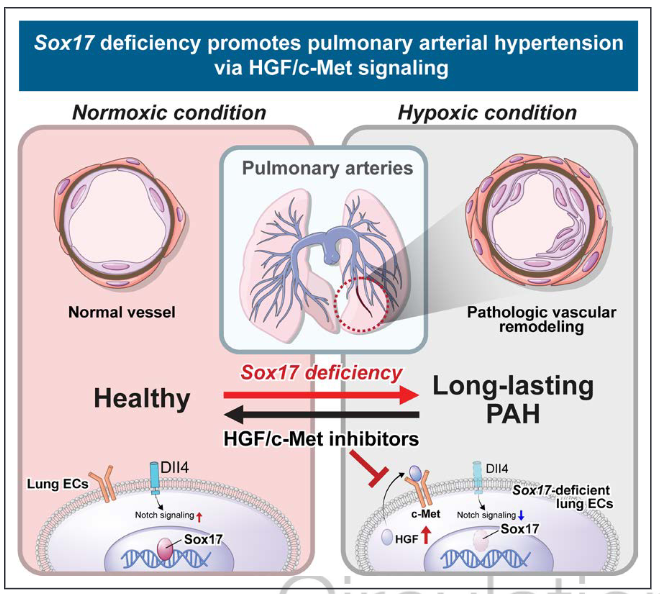
图7.总结性的图示。示意图描述了Sox17在肺动脉健康中的作用,以及它的丧失通过HGF(肝细胞生长因子)上调和Notch信号传导受损导致肺动脉高血压。
研究意义:
Sox17缺失和缺氧共同诱发了小鼠中具有高外显率的PAH。此外,肺内皮细胞中的Sox17水平在PAH患者中被抑制。缺氧可能是使易感个体进一步增加PAH风险的第二击,这表明减少暴露于缺氧条件,如吸烟、阻塞性睡眠呼吸暂停或空气污染,可以作为预防策略来实施,以减少PAH的负担。抑制HGF(肝细胞生长因子)s/c-Met信号传递在预防和治疗方面都成功地治疗了实验性PAH,这意味着这一途径可能作为PAH的一个新的可药用的目标。值得注意的是,大多数PAH患者的肺动脉血管中HGF水平上调。
通讯及Last 作者:Injune Kim,韩国科学和技术高级研究所。
其实验室的主要目标是进一步了解调控血管发育、血管平衡和血管疾病的转录调节。我们专注于内皮特异性转录因子Sox7和Sox17,它们属于SoxF亚家族,以了解各种血管背景下的主要转录调节。其研究确定了Sox7和Sox17是血管发育中的促血管生成调节因子,并阐明了其表达和功能的分子机制。另外,脑动脉中的Sox17对维持成年后的血管完整性至关重要,它的缺失会导致颅内动脉瘤,这是高血压情况下出血性中风的主要原因。

参考文献:
Soon Park C, Hyun Kim S, Young Yang H, Kim JH, Theo Schermuly R, Seul Cho Y, Kang H, Park JH, Lee E, Park H, Myung Yang J, Wook Noh T, Lee SP, Sik Bae S, Han J, Seok Ju Y, Park JB, Kim I. Sox17 Deficiency Promotes Pulmonary Arterial Hypertension via HGF (Hepatocyte Grow Factor)/c-Met Signaling. Circ Res. 2022 Oct 7:101161CIRCRESAHA122320845. doi: 10.1161/CIRCRESAHA.122.320845. Epub ahead of print. PMID: 36205124.
版权声明:
本网站所有注明“来源:梅斯医学”或“来源:MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明“来源:梅斯医学”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言