Adv Sci:武汉大学陈实/王连荣/王雅洁组合作揭示了SorL1基因缺失导致AD的病理
2024-09-09 iNature iNature
该研究揭示了SorL1基因缺失导致AD的病理机制。
Sortilin相关受体1(SorL1)缺陷是家族性阿尔茨海默病(AD)的遗传易感性,但其病理机制尚不清楚。在SorL1缺陷大鼠中,海马神经元中发现整体内体-溶酶体网络(ELN)紊乱。在SorL1缺陷大鼠中删除淀粉样蛋白前体(APP)无法完全挽救海马ELN中的神经元异常和SorL1缺陷幼鼠的空间记忆障碍。这些体内观察结果表明,APP是SorL1调节ELN的货物之一,会影响海马依赖性记忆。当SorL1耗尽时,内溶酶体会吸收更多的溶酶体通量并损害溶酶体消化,导致病理性溶酶体储存和海马胆固醇和铁稳态紊乱。这些干扰破坏了物质-能量-亚细胞结构原有的稳态,使SorL1基因缺失的海马体中的能量代谢以脂肪酸而非葡萄糖为基础进行重新编程。尽管脂肪酸氧化增加了ATP供应,但它不能像葡萄糖分解代谢那样降低氧化磷酸化过程中有害副产物ROS的水平。因此,SorL1基因缺失的大鼠表现出海马退化,其空间记忆受损。
2024年9月3日,武汉大学陈实/王连荣/王雅洁组合作在Advanced Science 在线发表题为“Endo-Lysosomal Network Disorder Reprograms Energy Metabolism in SorL1-Null Rat Hippocampus”的研究论文。该研究揭示了SorL1基因缺失导致AD的病理机制。

2007年,人们发现Sortilin相关受体1(SorL1)的单倍型不足会增加阿尔茨海默病(AD)的风险。外显子组测序显示,SorL1编码变异与早发性家族性AD密切相关。编码序列截短的突变仅发生在AD患者中,证实了SorL1作为AD关键保护因子的作用。
SorL1被鉴定为属于低密度脂蛋白(LDL)家族的分选受体,在小鼠和人类中枢神经系统的海马神经元中高度表达。SorL1直接与淀粉样蛋白前体(APP)相互作用,负责将APP从内体反向运输到反高尔基网络(TGN),从而促进APP重新定位到质膜并减少淀粉样蛋白-β斑块(Aβ)的生成。SorL1不仅运输APP,还运输脑源性神经营养因子(BDNF)和神经胶质源性神经营养因子(GDNF)。该分子还影响突触蛋白和产生红细胞生成素的肝细胞癌A4(EphA4),它们分别是神经递质释放和突触结构的突触调节剂。SorL1的这些已知功能支持了遗传学研究中的断言,即该蛋白质是AD发病机制中的重要因素。
此外,SorL1在AD中的作用不仅限于调节APP到Aβ的加工,而且该蛋白质可能具有与AD相关的其他病理功能。最近的研究将SorL1与内体功能障碍联系起来,这是AD的另一个病理特征。随后,两项关于SorL1缺失对人类诱导性多能干细胞(iPSC)影响的研究发表,均表明SorL1缺陷的神经元发生显著的内体增大(EE)。病理性EE已在SorL1单倍体不足小型猪模型中得到证实,但SorL1缺陷的病理仍不清楚。
AD脑神经元中的EE是早期细胞病理学标志,发生在Aβ聚集体出现前几十年。这一发现表明内体成熟延迟或内吞网络阻塞,是内体-溶酶体功能障碍的征兆。内溶酶体网络(ELN)由内体和溶酶体组成,它们是以流体和动态方式相互转化的膜状细胞器。ELN对于各种物质(包括蛋白质、离子和脂质)的运输、分选、降解和重新分布至关重要。在ELN中,内体穿梭于溶酶体和其他膜状细胞器之间,而溶酶体主要负责生物分子和亚细胞结构的降解,因此是代谢传感信号中枢。胆固醇是细胞膜的主要成分,其细胞内分散由溶酶体通过与内质网(ER)、过氧化物酶体、TGN和线粒体的相互作用介导。当内吞作用由LDL受体介导时,胆固醇酯被运送到溶酶体的限制膜。在溶酶体中,LDL衍生的胆固醇酯被溶酶体酸性脂肪酶水解为游离胆固醇。大多数游离胆固醇立即与具有疏水性固醇结合域的蛋白质结合,从而转运出溶酶体。溶酶体相关膜蛋白(Lamp)包括Lamp1和Lamp2,能够高亲和力地直接结合胆固醇,并参与胆固醇从溶酶体中排出。
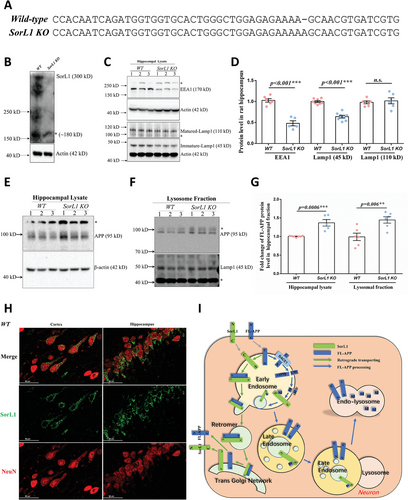
全长APP在SorL1缺失的海马ELN中的积累(图源自Advanced Science )
溶酶体也是细胞铁运输和体内平衡的控制中心。细胞外Fe3+通过ELN进入溶酶体,并在晚期内体和溶酶体的酸性腔内还原为Fe2+。催化此过程的酶的活性取决于细胞器的酸性pH值。溶酶体将还原铁释放到细胞质不稳定铁池(LIP)中,并准备转移或利用到不同的细胞区室。线粒体是铁利用的主要场所,用于血红素和铁硫(Fe-S)簇的生物合成,后者是大多数呼吸链复合物的辅助因子。因此,溶酶体介导的铁稳态调节也参与线粒体能量产生。由于Fe2+反应性强,过量的游离Fe2+会在Fenton反应中生成过氧化氢(H2O2)破坏膜脂等生物大分子,引发细胞死亡。
对病理性溶酶体蓄积的认识最近有所提高,溶酶体中底物的积累可导致致病的下游级联反应,包括线粒体功能障碍。这种现象是因为健康的线粒体稳态是通过溶酶体介导的线粒体自噬从网络中清除和降解受损的线粒体来维持的。当溶酶体受损时,线粒体功能也会受到影响。相反,受损的线粒体会减少维持溶酶体酸性消化环境的腺苷5'三磷酸(ATP)供应,这也会导致溶酶体功能障碍。这样,溶酶体和线粒体之间必须始终保持有效的串扰和相互作用。这一共识已在多种溶酶体贮积症(LSD)中得到证实,例如戈谢病、C型尼曼-匹克病和克拉伯病,这些疾病也被认为是神经退行性疾病的潜在机制。
在SorL1缺陷型iPSC和单倍体不足型小型猪中观察到EE,这表明SorL1表达不足会导致ELN功能障碍和溶酶体损伤,这仍有待评估。因此,作者生成了SorL1缺陷型大鼠系,并研究了海马中SorL1缺陷的细胞病理学。
参考消息:
https://onlinelibrary.wiley.com/doi/10.1002/advs.202407709
作者:iNature
版权声明:
本网站所有注明“来源:梅斯医学”或“来源:MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明“来源:梅斯医学”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言









#阿尔茨海默病# #SorL1基因缺失#
67