中山大学黄军就、松阳洲教授Nature子刊连发新成果
2016-09-07 佚名 生物通
导语:近期,中山大学生命科学学院的黄军就和松阳洲(Zhou Songyang)教授带领的两项学术成果,接连发表在Nature子刊《Scientific Reports》杂志。近期,中山大学生命科学学院的黄军就和松阳洲(Zhou Songyang)教授带领的两项学术成果,接连发表在Nature子刊《Scientific Reports》杂志。在过去的十多年,松阳洲教授在分子细胞学领域的研究中做出了独
导语:近期,中山大学生命科学学院的黄军就和松阳洲(Zhou Songyang)教授带领的两项学术成果,接连发表在Nature子刊《Scientific Reports》杂志。

近期,中山大学生命科学学院的黄军就和松阳洲(Zhou Songyang)教授带领的两项学术成果,接连发表在Nature子刊《Scientific Reports》杂志。在过去的十多年,松阳洲教授在分子细胞学领域的研究中做出了独创性的贡献。他对人体细胞端粒调节机理和胚胎干细胞的蛋白组学和功能性的研究处于国内外相关领域的前沿。
“80后”的黄军就教授是位年轻的学者,2015年4月,他带领的研究小组,完成了第一次在人类胚胎进行的基因修改实验,他们利用CRISPR/Cas9基因编辑技术改造了导致一种潜在致命血液疾病——β-地中海贫血的基因。这一爆炸性新闻一经发布便受到了国内外科学界的广泛关注,并引发了支持者和反对者激烈的辩论。并且,因为此项研究,黄军就入选全球知名科研期刊《自然》(Nature)杂志2015年度对全球科学界产生重大影响的十大人物。
端粒酶的激活或端粒的选择性延长(ALT),对于肿瘤逃避功能异常端粒所介导的衰老,是必不可少的。在大约85%到90%的端粒酶阳性癌细胞中,抗端粒酶药物可以有效抑制肿瘤的生长。然而,这些细胞仍然有可能在切换到ALT机制后绕开药物治疗,以维持其端粒的完整性。但是这个切换背后的机制还是未知的。8月31日《Scientific Reports》在线刊登了该研究小组的一项研究成果。在这项研究中,研究人员利用端粒酶阳性的肿瘤细胞(HTC75),通过诱导端粒特异性DNA损伤、α地中海贫血X连锁综合蛋白(ATRX)敲除和删除死亡相关蛋白(DAXX),来探究端粒酶ALT切换的机制。令人惊讶的是,在治疗后,研究人员在ALT样的HTC75细胞中发现了两个重要的ALT特征:ALT相关的早幼粒细胞白血病体(APBS)和端粒重复序列的染色体外环状DNA。此外,在ALT样的HTC75细胞中,研究人员利用CRISPR/Cas9技术敲掉hTERT,可导致端粒以一种独立于端粒酶的方式发生延伸。总之,这是首次有研究表明,在端粒酶阳性肿瘤细胞中,诱导端粒DNA损伤、破坏ATRX/DAXX复合物和抑制端粒酶的活性,都可能导致ALT的切换。
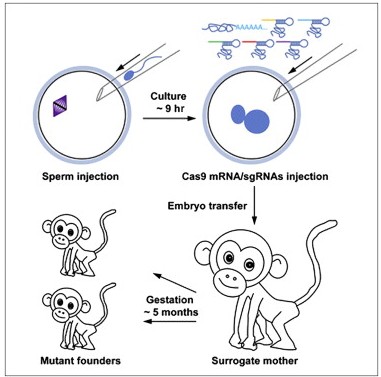
9月2日,黄军就和松阳洲教授带领的研究小组,又在该杂志发表题为“Efficient Production of Gene-Modified Mice using Staphylococcus aureus Cas9”的研究成果。众所周知,CRISPR/Cas是小鼠受精卵中基因编辑的一种高效的基因组编辑工具。然而,目前只有酿脓链球菌Cas9(SpCas9)已经进行了系统的测试用于制备基因修饰小鼠。SpCas9识别的PAM限制了这一系统的潜在靶位点的数量。金黄色酿脓葡萄球菌Cas9(SaCas9),以其较小的尺寸和独特的PAM偏好性,而被作为受精卵基因组编辑的另一种替代。
这项研究表明,SaCas9能有效而特异性地编辑小鼠受精卵中的X连锁基因Slx2和常染色体基因Zp1。SaCas9介导的酪氨酸酶(TYR)基因中断,可导致具有镶嵌毛色的C57BL/6J小鼠。此外,当研究人员将靶定Slx2、Zp1和Tyr的gRNAs,与SaCas9 mRNA共同注入小鼠受精卵时,多重打靶可行之有效地破坏多个基因。当将一个编码Flag的单链DNA寡核苷酸和SaCas9 mRNA、gRNA共同注入小鼠受精卵时,能够在组蛋白H1c的C末端插入一个Flag标签。这些结果表明,SaCas9可以特异性地切割靶基因位点,从而在小鼠受精卵中实现成功的基因敲除和精确的基因敲入,同时,这项研究还强调了使用SaCas9用于植入前胚胎基因组编辑和制备基因修饰动物模型的潜力。
原始出处:
Zhang X1,2, Liang P1,2,3, Ding C3, Zhang Z2, Zhou J4, Xie X2, Huang R2, Sun Y2, Sun H2, Zhang J2, Xu Y3, Songyang Z1,2,3, Huang J1,2,3.Efficient Production of Gene-Modified Mice using Staphylococcus aureus Cas9.Sci Rep. 2016 Sep 2
Hu Y1,2, Shi G1,2, Zhang L1, Li F1, Jiang Y1, Jiang S1, Ma W1, Zhao Y1, Songyang Z1,2, Huang J1,2.Switch telomerase to ALT mechanism by inducing telomeric DNA damages and dysfunction of ATRX and DAXX.Sci Rep. 2016 Aug 31
作者:佚名
版权声明:
本网站所有注明“来源:梅斯医学”或“来源:MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明“来源:梅斯医学”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言
小提示:本篇资讯需要登录阅读,点击跳转登录






nature子刊.有病吧.哈哈
73
#Nat#
39
#新成果#
39
继续关注
0
继续学习
81