靶向IL-4R单克隆抗体 (AK120) 治疗特应性皮炎和哮喘,中国II期临床试验已经启动
2021-10-16 Allan MedSci原创
制药公司Akeso宣布,其候选药物抗IL-4R单克隆抗体(AK120)已经获得中国国家药品监督管理局药品审评中心(CDE)的批准,以在中国启动治疗中重度哮喘的II 期临床试验。
制药公司Akeso宣布,其候选药物抗IL-4R单克隆抗体(AK120)已经获得中国国家药品监督管理局药品审评中心(CDE)的批准,以在中国启动治疗中重度哮喘的II 期临床试验。
同时,AK120治疗中重度特应性皮炎全球II期临床试验在美国首个研究中心完成了首例患者入组。
IL-4和IL-13是引发II型炎症的两个关键因素。AK120可特异性结合IL-4R,与IL-4和IL-13竞争与IL-4Rα结合,从而阻断下游信号转导通路,达到治疗以II型炎症为主的特应性疾病的目的,如特应性皮炎、哮喘和嗜酸性粒细胞性食管炎。
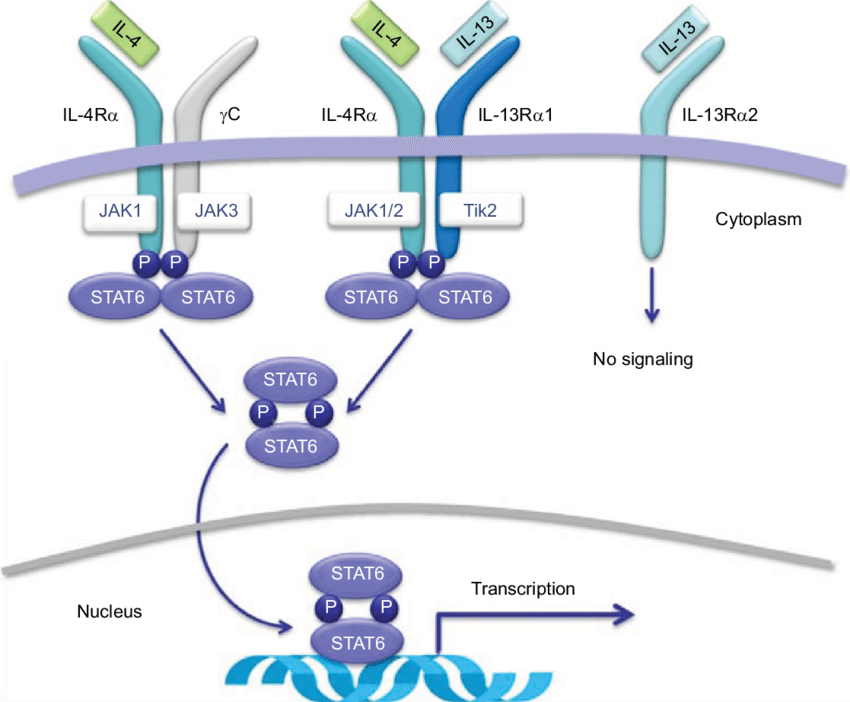
在安全性方面,AK120治疗特应性皮炎的健康受试者单剂量递增Ia期临床试验和AK120治疗特应性皮炎的多剂量递增Ib期临床试验已在新西兰和澳大利亚完成。根据试验中获得的初步数据,AK120 在健康成年受试者(剂量高达 600 毫克,单次剂量)和特应性皮炎受试者(剂量高达 300 毫克,每周一次,多次剂量)中是安全且耐受良好的。
在疗效方面,早期临床试验表明,AK120在特应性皮炎患者中具有与dupilumab相当或更好的潜在临床疗效。根据临床前药效学,AK120在哮喘方面的成药性更好。可显著降低哮喘模型肺泡灌洗液中白细胞、嗜酸性粒细胞和外周血特异性免疫球蛋白E(IgE)抗体水平。
目前,我国尚缺乏具有自主知识产权的治疗中重度哮喘和中重度特应性皮炎的生物制剂,临床需求也很大。随着AK120治疗特应性皮炎和哮喘的临床试验进入后期临床开发阶段,AK120有望在不久的将来为国内以II型炎症为主要发病机制的特应性疾病患者带来希望。
抗IL-4R单克隆抗体被认为是治疗过敏性疾病的重要靶点。根据公开数据,随着IL-4R靶向药物渗透率的不断提高,预计到2024年,IL-4R抗体药物的全球市场销售额将达到约122亿美元,其中中国市场将约占6.07亿美元。目前,dupilumab是全球唯一获批上市的抗IL-4R单克隆抗体,2020年该药全球销售额超过40亿美元。
原始出处:
作者:Allan
版权声明:
本网站所有注明“来源:梅斯医学”或“来源:MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明“来源:梅斯医学”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言













#I期临床试验#
101
#II期临床试验#
117
#克隆#
103
#I期临床#
77
学习
87