一、病史简介
患者,男性,69岁,上海人,2021-11-04入住中山医院感染病科。
主诉:间断发热8月余,发现右背肿物2周。
现病史:
-
2021-02起 无诱因出现发热,Tmax 38.0℃,无咳嗽咳痰、腹痛腹泻等伴随症状,自服小柴胡冲剂后好转,此后间断类似发热4-5次。
-
10-18 受凉后再次发热,伴头晕,自服中成药后发热头晕有好转;10-21 自觉右背部肿物,约5X5cm,质软,无皮肤红肿、疼痛、皮温升高等,未予重视。后逐渐出现胸闷、活动后气促,爬4层楼需要休息;乏力明显,伴纳差、轻度腰痛。10天内右背肿物进行性增大,逐渐出现胀痛;且胸闷、气促进行性加重,步行20米即需休息。
-
11-01 至上海某医院查血常规:Hb 48g/L,WBC 51.31X10^9/L,N 93.3%;CRP 19mg/L;BNP:122.6pg/ml;肿瘤标志物阴性。腹部CT:左肾结石、肝脏低密度灶、脾脏增大,附见右侧胸腔积液。诊断为“极重度贫血、细菌性感染、胸腔积液、肾结石、脾大”,家属要求转院。
-
当天至我院急诊,查体见右背部肿物约10X15cm,质软,皮温不高,背部肿物超声示:右背部皮下实质占位-考虑MT可能,血肿不完全除外;胸部CT平扫:右侧背部及胸壁混杂密度灶,右侧胸腔积液、右肺部分不张。予美罗培南抗感染。
-
11-04 收入我院感染病科。患者近1月体重下降5kg。
既往史:2021-03 外院诊断腰部、上肢、胸部接触性皮炎,予外涂药物对症治疗后好转。否认高血压、糖尿病等慢性病史。
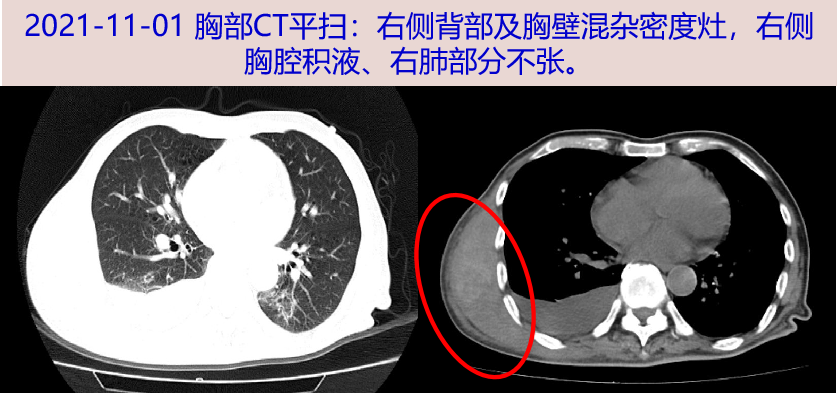
二、入院检查(2021-11-04)
【体格检查】
-
T:36.9℃ P:90次/分 R:18次/分 BP:117/75mmHg
-
神清,精神尚可,贫血貌,皮肤巩膜无黄染,全身浅表淋巴结无肿大,右背部见一不规则肿块,约20X10cm,质软,有波动感,无皮温升高、皮肤破溃,背部可见多处皮肤色素沉着。左肺呼吸音清,右下肺呼吸音降低,心率90次/分,律齐。腹平软,肝脾肋下未及,肝肾区无叩击痛,双下肢不肿。颈软,脑膜刺激征阴性,病理征阴性,四肢肌力V级,四肢针刺觉对称。
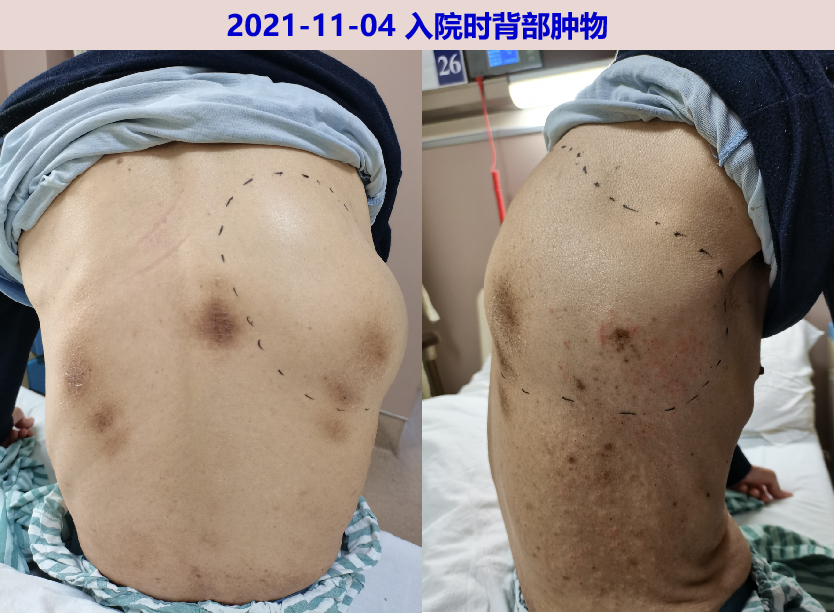
【实验室检查】
-
血常规:RBC 1.7 X10^12/L,Hb 57g/L,HCT 18.3 %,MCH 33.5 pg,MCHC 311 g/L,WBC 49.07X10^9/L,N 92.5%, L 4.7%, PLT 176X10^9/L;
-
外周血涂片:N 97%,L 1%,L 2%,未见异常细胞;红细胞呈缗钱状排列;
-
网织红细胞百分比 8.8 %;
-
炎症标志物:hs-CRP 6.9 mg/L,ESR 6 mm/H,PCT 0.09ng/mL,铁蛋白 452ng/ml;
-
尿常规:蛋白: ±,隐血 阴性,WBC 阴性;
-
生化:可疑M蛋白,ALT/AST 8/23 U/L,LDH 242 U/L;总蛋白 98g/L, 白蛋白 28g/L, 球蛋白 72g/L;sCr 75 μmol/L, UA 699 μmol/L,Ca 2.22mmol/L;
-
免疫球蛋白+补体全套:IgG 3.1g/L, IgA 56.78g/L, IgM 0.39g/L, IgE 11IU/ml, 补体C3 0.28 g/L,补体C4 0.3g/L, 总补体 46g/L,血β2微球蛋白 22.39 mg/L
-
细胞免疫:淋巴细胞计数 2171 cells/μL, CD4 T细胞计数 679 cells/μL;
-
病毒:EBV-DNA(-) , CMV-DNA(-);HIV抗体 阴性;
-
甲状腺功能、肿瘤标志物、自身抗体(-);
【辅助检查】
-
2021-11-05 心超:1.二尖瓣前叶稍增厚伴轻度二尖瓣反流 2.极少量心包积液
三、临床分析
-
血液系统肿瘤:患者慢性病程,近期背部病灶进行性加重,伴白细胞异常升高,其他炎症标志物不明显,同时存在重度贫血,从一元论考虑需首先考虑血液系统疾病,如慢性白血病、多发性骨髓瘤、淋巴瘤等。可进一步行PET/CT、骨髓涂片+活检、局部病灶穿刺活检以明确。也不除外血液系统疾病基础上,合并局部软组织感染可能。
-
慢性低毒力病原体感染:患者间断低热,右背部肿块近期增大,有波动感,但无红肿、压痛,CRP、ESR、PCT升高不明显,需考虑慢性低毒力感染,如分枝杆菌、诺卡菌、放线菌等。但似乎无法解释患者白细胞异常升高、重度贫血。可进一步行病灶穿刺活检以明确。
-
慢性HIV感染:可出现乏力、盗汗或体重减轻、低热等慢性、非特异性症状,该患者近期出现背部肿块,慢性HIV感染患者可出现卡波氏肉瘤,结节期交叉排列的只有轻度异型性的梭形细胞束形成界限清楚的结节,CD34呈阳性,本例入院时查HIV抗体阴性,CD4T淋巴细胞不低,无典型卡波氏肉瘤的典型皮肤表现,故暂时没有依据。
四、进一步检查、诊治过程和治疗反应
-
11-05 B超引导下行右背部肿块穿刺活检,组织匀浆涂片找细菌、真菌、抗酸杆菌阴性,组织匀浆XPERT MTB/RIF 阴性。
-
11-05 PET/CT:颅骨、双侧锁骨、肩胛骨、双侧肱骨、胸骨、双侧肋骨、脊柱多处、骨盆骨多处及双侧股骨髓腔内密度增高伴糖代谢弥漫性增高,SUVmax 为6.6。右侧胸壁及背部皮下见低密度肿块伴糖代谢异常增高,范围约为86.9×54.0mm,SUVmax 3.7;左肺上叶、下叶见斑片模糊灶伴糖代谢增高,最大SUV值约为1.2;右肺下叶见条片灶;脾脏增大。
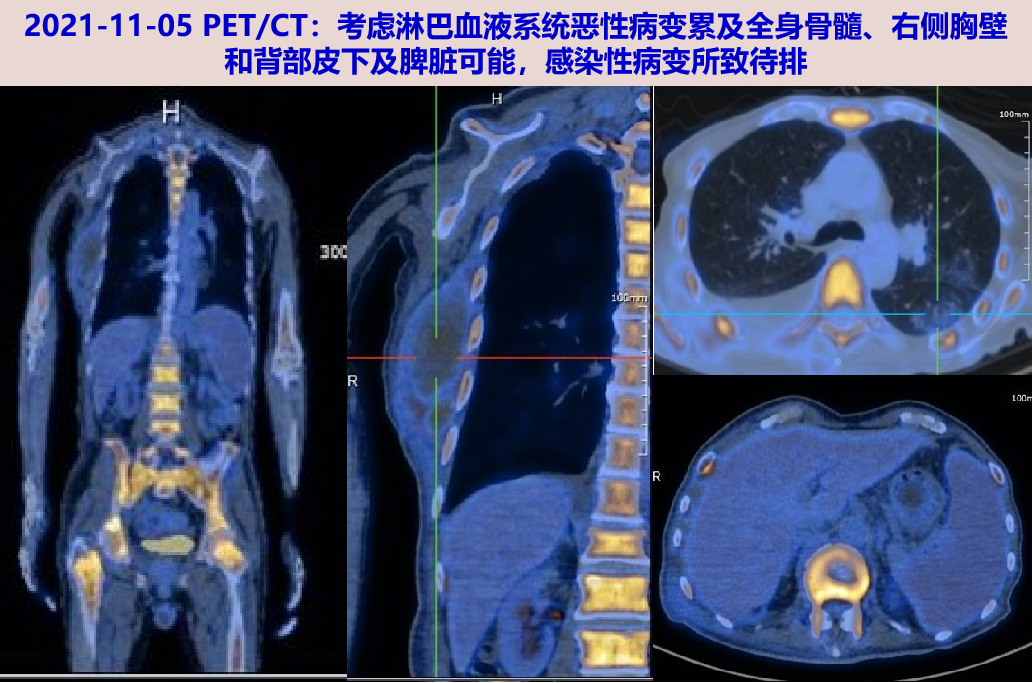
-
11-06 右背部肿块病理:镜下活检肌肉组织间及肌肉周围见少量炎症细胞及增生短梭性细胞。
-
11-07 背部肿块mNGS:阴性;免疫固定电泳:阳性;IgA-λ M带;M蛋白浓度 53.4g/L,百分比 54.5%。κ/λ 0.08;游离轻链κ 6.5 mg/L, 游离轻链λ 83.9 mg/L;
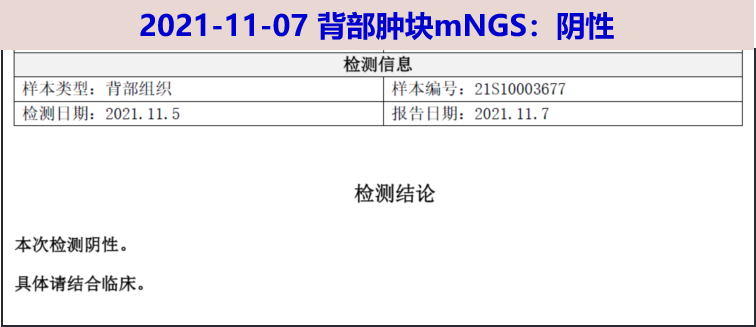
-
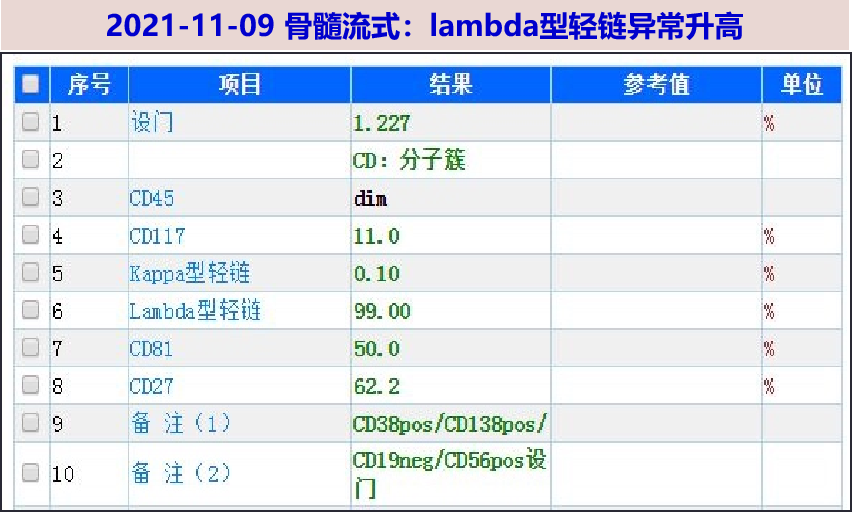
11-09 行骨髓穿刺+活检,涂片:片中浆细胞比例升高占 25.5%,部分提及偏大胞浆偏多,偶见双核及多核浆细胞。考虑多发性骨髓瘤可能。流式:lambda型轻链异常升高。活检初步病理:骨小梁间造血组织未见,仅可见大片浆细胞,浆细胞瘤可能大,待进一步行组化及基因检测明确。

-
11-10 骨髓活检最终病理:符合浆细胞骨髓瘤;右背部穿刺组织细菌、真菌培养:阴性;

-
11-11 右背部肿块病理:少量肌纤维母细胞曾生伴淋巴细胞浸润,未见明确肿瘤证据。

-
11-11血液科会诊考虑多发性骨髓瘤(IgA-λ型,ISS III期,R-ISS III期)诊断明确,转血液科,予以多柔比星脂质体+VRD方案化疗,具体方案:脂质体多柔比星20mg d1,硼替佐米1.9mg d1、8、15,来那度按25mg d1-14,地塞米松40mg d1、8、15。患者外周血白细胞持续升高,以中性粒细胞为主,骨髓增生极度活跃,外周血可见杜勒小体,考虑不除外类白或慢性中性粒细胞白血病(CNL),建议完善CSF3R检测,因患者个人原因,拒绝。
-
11-12 出院,血液科持续随访中……
五、最后诊断与诊断依据
最后诊断:
诊断依据:
六、经验与体会
-
多发性骨髓瘤(MM)典型特征为浆细胞肿瘤性增殖,并产生单克隆(monoclonal, M) 免疫球蛋白,在所有癌症中占比为1%-2%,在血液系统恶性肿瘤中占比略多于17%。该患者有发热、贫血、高球蛋白血症,虽无骨痛、高钙、肾功能不全,仍需考虑多发性骨髓瘤可能,该患者PET/CT提示多发骨代谢增高,最终骨髓涂片+活检均证实为本疾病。约7%的MM患者诊断时可见髓外浆细胞瘤(extramedullary plasmacytoma, EP),PET/CT检出EP的能力最佳,诊断时存在EP者生存情况较差,另有6%的患者会在后续病程中发生EP。EP可表现为大的略带紫色的皮下肿块。本例背部病灶病灶无明确肿瘤细胞证据,可能与病灶近期迅速增大、坏死,穿刺组织未能穿到肿瘤细胞而以炎症反应为主,仍需考虑EP。
-
本例患者间断发热8月,未及时就诊,首诊时已发现重度贫血、右背部肿块进行性增大,且炎症标志物不高,肿块无明显皮肤发红和疼痛等感染征象,白细胞异常升高,鉴别诊断需考虑慢性白血病。该患者外周血象以中性分叶核粒细胞为主,伴毒性颗粒,NAP积分显著升高,同时有脾脏增大,需除外慢性中性粒细胞白血病(CNL)可能。罕见病例会有MM和CNL合并情况,但粒细胞内有dohle小体时,需除外骨髓瘤细胞分泌刺激因子样物质而导致的粒系增殖的类白反应,故也许除外MM继发的类白反应。
致谢:感谢复旦大学附属中山医院血液科王伟光教授及检验科陈朴教授对本例的专业指导!
参考文献
[1] Siegel RL, Miller KD, Fuchs HE, Jemal A. Cancer Statistics, 2021. CA Cancer J Clin 2021; 71:7
[2] 《中华传染病杂志》编辑委员会,发热待查诊治专家共识,中华传染病杂志,2017,35(11):641-655
[3] XC SHI,XQ LIU,BT ZHOU,et al. Major causes of fever of unknown origin at Peking Union Medical College Hospital in the past 26 years,Chin Med J 2013;126(5):808-812
作者:金文婷 马玉燕
版权声明:
本网站所有注明“来源:梅斯医学”或“来源:MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明“来源:梅斯医学”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言









谢谢分享。
77