TRANSPLANTATION:MEK1/2-PKM2通路调节心脏移植排斥期间促炎同种异体浸润巨噬细胞的免疫代谢重新编程
2024-02-17 Bob Wang MedSci原创
这些发现表明,MEK1/2-PKM2通路对促炎性AIM的免疫代谢重新编程至关重要,这意味着它可能是临床心脏移植中一个有前途的治疗目标。
同种异体移植排斥反应是一种严重的并发症,可能导致移植物功能障碍,并最终导致心脏移植后的移植物失败。适应性和先天免疫系统合作控制同种移植排斥的过程。最近的研究表明,先天免疫细胞,特别是巨噬细胞,在同种移植物反应中发挥着至关重要的作用,有助于移植物排斥和接受。
在移植物血管重建后,受体髓细胞迅速浸润了缺血性同种异体移植物。细胞内警报蛋白,包括HMGB1、核DNA和线粒体DNA,由于缺血再灌注损伤和同种异体排斥反应引起的移植组织损伤而释放。细胞内警报素随后触发骨髓细胞上的Toll样受体,导致它们分化为促炎巨噬细胞并介导同种移植排斥。促炎巨噬细胞是抗原呈递细胞,能够检测、处理和呈现同素抗原,以激活异体活性T细胞反应。
此外,促炎巨噬细胞通过促炎细胞因子直接促进局部炎症并加重移植损伤,包括白细胞介素(IL)-1β、IL-6和肿瘤坏死因子-α。这个初始促炎阶段通常在移植后达到3至5d的峰值。然而,对同种异体移植的影响是持久的。先前的研究表明,巨噬细胞的早期激活似乎能够获得即使没有抗原或其他刺激也能持续存在的记忆特征。
此外,这一过程的失调或持续的优势会导致移植物的病理重塑和纤维化增加,这意味着巨噬细胞的早期激活可能会对异体移植结果产生长期功能影响。需要专注于调节移植后促炎巨噬细胞早期激活的研究,以进一步改善移植结果。
细胞代谢的传统定义包括合成代谢和分解代谢,它们产生细胞维持和生长所需的ATP和生物合成前体。然而,最近的研究表明,环境条件,如营养素和氧气,可以触发免疫细胞中关键代谢调节事件和下游重新编程事件的变化,以响应模式识别受体和细胞因子受体。越来越多的研究表明,代谢过程和反应在免疫效应中发挥着更广泛的作用。
例如,巨噬细胞代谢重新编程对于满足应对关键环境变化的能量和代谢物需求至关重要。当巨噬细胞受到炎症性疾病时,它们的能量生成模式会迅速转向糖酵解。在促炎巨噬细胞中切换到糖酵解使它们适应炎症阶段所需的快速、短暂的激活。
促炎巨噬细胞表型与糖酵解速率的急剧增加密切相关。相反,阻断关键糖解途径酶或受体可以抑制促炎巨噬细胞的代谢再编程,并干扰其促炎症功能。当我们研究代谢途径和中间体在免疫反应中的精确功能时,出现了操纵代谢再编程的新的治疗机会。
2024年1月19日发表在TRANSPLANTATION的文章,描述了在心脏移植排斥(HTR)期间MEK1/2-PKM2通路的代谢重新编程中的关键作用。基于单细胞转录组数据分析,我们的研究表明,同种异体浸润巨噬细胞(AIM)表现出显著的促炎和糖酵解活性升高,这与MEK/ERK信号激活呈正相关。

MEK/ERK信号通路在AIMs代谢重新编程中的重要作用在体外和心脏移植模型中进一步证明了使用巨噬细胞特异性Mek1/2敲除小鼠。此外,MEK1/2抑制剂曲米替尼对慢性心脏移植排斥反应有保护作用。总而言之,我们的数据表明,MEK途径可能是HTR的潜在治疗靶点。
我们分析了来自心脏移植物浸润免疫细胞的单细胞RNA测序数据,以表征AIM的激活模式和代谢特征。我们使用流式细胞仪来确定AIM中的iNOS和PKM2表达以及MEK/ERK信号激活水平。然后我们生成巨噬细胞特异性Mek1/2敲除小鼠,以确定MEK1/2-PKM2途径在HTR期间AIMs的促炎表型和糖酵解能力中的作用。
研究结果显示,单细胞RNA测序分析表明,AIMs的促炎和糖酵解表型显著升高。流式细胞仪分析验证了iNOS和PKM2表达在AIMs中显著上调。此外,MEK/ERK信号在AIMs中被激活,并与促炎和糖解特征呈正相关。巨噬细胞特异性Mek1/2缺失可显著保护慢性心脏同种异体移植排斥反应,并抑制AIMs的促炎表型和糖解能力。
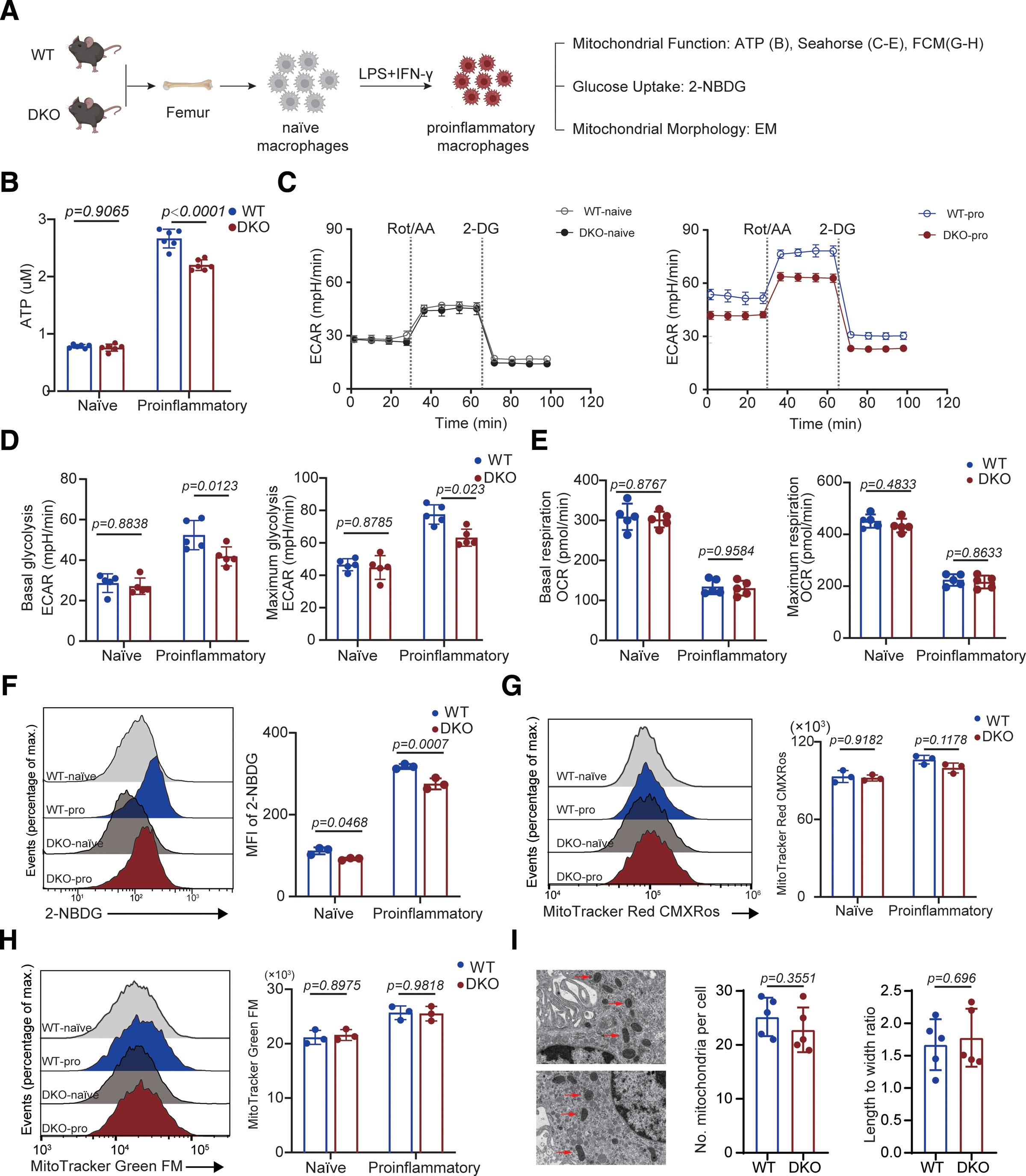
图1:促炎巨噬细胞的代谢重新编程需要MEK/ERK途径
Mek1/2消融还降低了脂多糖+干扰素γ刺激巨噬细胞的促炎表型和糖解能力。Mek1/2消融损害了巨噬细胞中的核易位和PKM2表达。PKM2过度表达部分恢复了Mek1/2缺陷巨噬细胞的促炎表型和糖解能力。此外,美国食品药品监督管理局批准的MEK1/2抑制剂曲米替尼改善了慢性心脏同种异体移植排斥反应。
综上所述,我们的研究表明,MEK1/2-PKM2通路通过在同种异体移植排斥期间支持巨噬细胞中的糖酵解,积极促进促炎反应。这些发现表明,它可能是临床心脏移植的一个有前途的治疗目标。
原文出处
Chen, Zhang MD1,2; Li, Yuan MD1,2; Niu, Yuqing MM1,2; Zhang, Xi MD1,2; Yu, Jizhang MD1,2; Cui, Jikai MD1,2; Ran, Shuan MD1,2; Wang, Song MD1,2; Ye, Weicong MD1,2; Xia, Jiahong MD, PhD1,2,3,4,5; Wu, Jie MD, PhD1,2,3,4,5. MEK1/2-PKM2 Pathway Modulates the Immunometabolic Reprogramming of Proinflammatory Allograft-Infiltrating Macrophages During Heart Transplant Rejection. Transplantation ():10.1097/TP.0000000000004899, January 19, 2024. | DOI: 10.1097/TP.0000000000004899
作者:Bob Wang
版权声明:
本网站所有注明“来源:梅斯医学”或“来源:MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明“来源:梅斯医学”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言





#心脏移植# #MEK1/2-PKM2#
24