Nature:生存时间延长67%!科学家瞄准肿瘤微环境,找到治疗胶质母细胞瘤的关键基因!
2017-07-17 王鑫英 BioTalker 奇点网
终于,在克利夫兰诊所Jeremy Rich教授团队的不懈努力下,一种体内筛选抗肿瘤药物靶点的新方法诞生了! Rich教授是胶质母细胞瘤领域的专家,可是对于这种侵袭性极强,中位生存期只有15个月,5年生存率在6%左右,被称为「癌症之王」的癌症,他也束手无策。 在Rich教授看来,这可能是研究的方法出了问题。 「传统药物研发是从体外培养癌细胞开始的,然后做高通量筛选。」Rich教授在论文中表
终于,在克利夫兰诊所Jeremy Rich教授团队的不懈努力下,一种体内筛选抗肿瘤药物靶点的新方法诞生了!
Rich教授是胶质母细胞瘤领域的专家,可是对于这种侵袭性极强,中位生存期只有15个月,5年生存率在6%左右,被称为「癌症之王」的癌症,他也束手无策。
在Rich教授看来,这可能是研究的方法出了问题。
「传统药物研发是从体外培养癌细胞开始的,然后做高通量筛选。」Rich教授在论文中表示,「这种方法筛选出来的药物远远算不上成功,在胶质母细胞瘤领域尤甚。」
药物研发路上的这条拦路虎,把Rich教授逼到了另一条道路,尽量模拟肿瘤的原生环境,然后在这种条件下筛选药物作用靶点。
借助于Johannes Zuber博士在冷泉港开发的RNAi技术,Rich教授团队开发出了一个在小鼠体内筛选药物靶点的新技术平台。
采用这个技术,他们找到了胶质母细胞瘤在肿瘤微环境下生存所必需的57个关键基因,让人吃惊的是,这57个关键基因与体外培养筛选找到的基因没有一个是重合的。当他们靶向其中一个叫JMJD6的基因时,超过1/4的胶质母细胞瘤模式小鼠,生存期至少延长了67%!显然,Rich教授打开了癌症药物研发的一个新方向。相关的研究成果,于7月5日刊登在《自然》上。
肿瘤的生长环境是极其恶劣的,营养不足、空间有限,压力山大。相较而言,生活在培养基里面的癌细胞就幸福多了,营养充分、条件适宜,无忧无虑、茁壮成长。在这两种迥然不同的条件下,癌细胞所必需的生存技能显然是不同的。
靶向与肿瘤微环境有关的基因,这也是Rich教授想要改变研究策略的基本出发点。
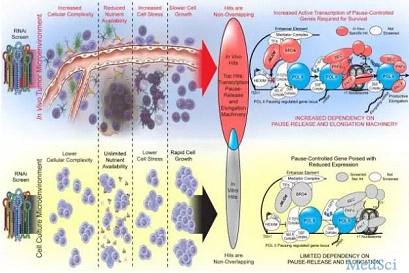
基于肿瘤在体内(上)生长和体外(下)生长环境不同,开发的RNAi筛选技术示意图
这种筛选技术的流程分为以下几个步骤:首先,是构建短发夹RNA(short hairpin RNA,shRNA)库。shRNA能够抑制靶基因的表达。研究人员将shRNA整合到带有双重荧光报告基因的载体上。他们构建了1586种shRNA,靶向406个已知的染色质及转录调节基因(每个基因对应2-4种shRNA)。
然后,研究人员将患者的肿瘤细胞转移到小鼠颅腔中,保证其在肿瘤微环境中生长,并将上述shRNA库转移至肿瘤细胞中。
之后是筛选带有shRNA的肿瘤细胞。当shRNA成功转移到细胞内时,会发出绿色的荧光,根据绿色荧光,就可以出筛选带有shRNA的肿瘤细胞了。
接下来是构建筛选平台:研究人员将筛选出的肿瘤细胞分为两部分。一部分在体外培养,另一部分移植到小鼠颅腔中(体内培养)。两种培养方式分别设立实验组和对照组。
研究人员给实验组施加化学药物,这种药物可以让shRNA表达,还会让第二种荧光(红色荧光)报告基因表达。这样,活跃表达shRNA的肿瘤细胞就会同时发出绿色荧光和红色荧光,同时,这种shRNA的靶基因的表达也会受到抑制。而对照组不予处理,对照组的肿瘤细胞只能发出绿色荧光。
在生长到3周时,研究人员将小鼠安乐死,并从小鼠颅腔取出肿瘤组织进行分离,然后再将实验组或对照组的细胞进行测序并对shRNA的表达进行了量化。
如果一种shRNA的靶基因对肿瘤细胞的存活是关键的,那么,在实验组中这个靶基因受到抑制后,细胞就不能存活。相对于对照组,实验组细胞中相应shRNA的量也就减少。通过比较实验组和对照组同种shRNA含量的变化,研究人员就可以筛选出肿瘤细胞存活的关键基因了。
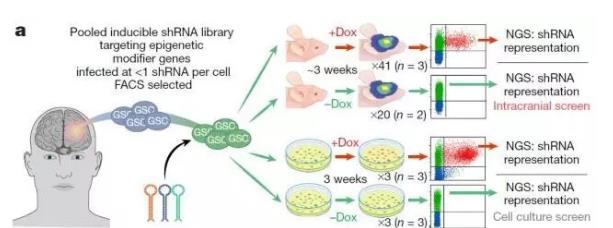
筛选方法示意图
在比较体外培养和体内培养的筛选结果后,研究人员们震惊了:两种培养方式中,影响肿瘤细胞存活的关键基因几乎没有重叠!在体内培养时,肿瘤细胞存活所需的57个基因,对体外培养的肿瘤细胞存活来说,是不重要的。
进一步的分析发现,体外培养时肿瘤存活所需的关键基因多是跟细胞的代谢和大分子的合成有关,而体内培养时所需的关键基因多是与转录调节有关,而这受到肿瘤微环境的影响。
为了找到胶质母细胞瘤的治疗靶点,研究人员选择了这57个基因中的12个与肿瘤应对环境压力有关的基因,进行了进一步的研究。其中的一个基因JMJD6,可以调节许多基因的表达,而这些基因对肿瘤细胞的生存是极其重要的。
研究人员还发现,在胶质母细胞瘤患者的肿瘤中,JMJD6基因的表达量很高,并且病情越严重,JMJD6基因的表达量也越高。
这让研究人员很兴奋,如果不让这个基因表达,会出现怎样的结果呢?于是他们将肿瘤细胞的JMJD6基因敲除,分别在体外、移植到小鼠颅腔中培养。
这次,又得到了可喜的结果:体外培养时,敲除JMJD6基因对肿瘤的生长或存活并没有什么影响;但是,相比于没有敲除JMJD6基因的肿瘤小鼠,敲除了JMJD6基因的肿瘤小鼠存活的时间更长了(对照组小鼠60天时全部死亡,超过1/4的实验组小鼠存活时间大于100天)。
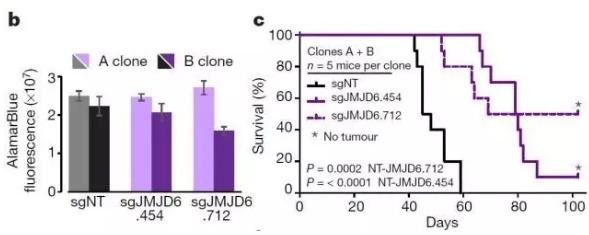
敲除JMJD6基因,对体外培养(b)的肿瘤生长无影响,却延长了小鼠的寿命。
这真是太神奇了!正如本研究的第一作者Tyler Miller博士所说,「我们的研究结果提示,靶向肿瘤应对压力的基因,要比靶向细胞增殖的基因,治疗效果更好!这为胶质母细胞瘤的治疗开辟了新的途径!」
这种筛选方法,能够更接近天然肿瘤环境, 针对此种方法筛选出的靶点开发的药物,也将能给患者提供更好的疗效。
据研究人员讲,这种方法也可以用于筛选其他类型癌症的潜在治疗靶点。我们期待,研究人员能尽快开发出针对此类靶点的新药物,给癌症患者带来实际的利益!
原始出处:
Miller T E, Liau B B, Wallace L C, et al. Transcription elongation factors represent in vivo cancer dependencies in glioblastoma. Nature (2017) doi:10.1038/nature23000
作者:王鑫英 BioTalker
版权声明:
本网站所有注明“来源:梅斯医学”或“来源:MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明“来源:梅斯医学”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言








#母细胞瘤#
68
#Nat#
80
#关键基因#
77
#生存时间#
76
#胶质母细胞#
83