ATP合成酶/偶联因子6在缺氧性肺动脉高压中的影响:一个实验性的大鼠模型
2022-11-30 网络 网络
源性PGI2抑制剂偶联因子6(CF6)参与了MCT诱导的PAH。本研究旨在探讨缺氧诱导的PAH与CF6之间是否存在关联。
研究背景:
低氧诱导的肺动脉高压(PAH)以前列环素(PGI2 )紊乱为特征,其表现方式与野百合碱(MCT)诱导的PAH相同。内源性PGI2抑制剂偶联因子6(CF6)参与了MCT诱导的PAH。本研究旨在探讨缺氧诱导的PAH与CF6之间是否存在关联。
研究方法:
本研究在2019年1月至2020年6月期间进行。共135只雄性Wistar大鼠(8周岁,体重200-250克)被随机分为五组:(A)对照组,(B)缺氧1周,(C)缺氧2周,(D)缺氧3周,(E)缺氧4周。通过西方印迹法、免疫组化法、反转录聚合酶链反应法和酶联免疫吸附法测定CF6在肺组织和肺血管及尾静脉的血液样本中的表达。
研究结果:
低氧诱导大鼠的血液动力学和形态学变化表明PAH的发展。结果显示,肺组织中CF6的mRNA和蛋白水平、线粒体ATP合成酶的活性与缺氧时间之间存在相关性,与对照组相比,暴露于缺氧4周的组别有明显增加。
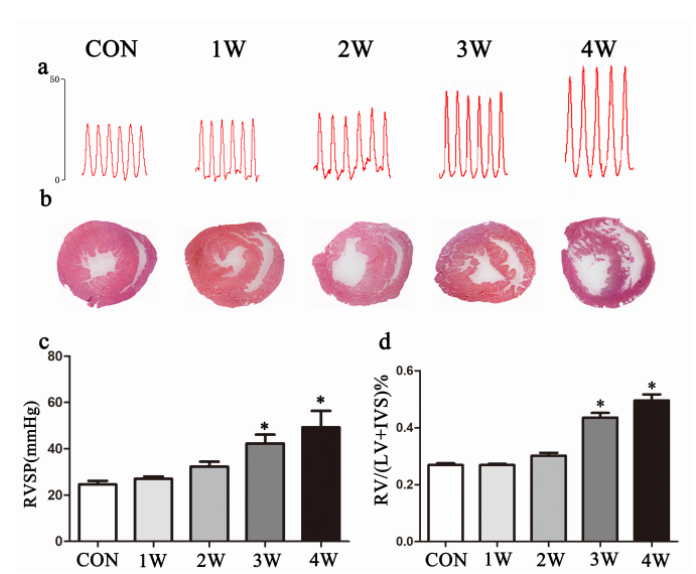
与对照组相比,缺氧4周组的ATP酶抑制因子1(IF 1)mRNA的表达下降与肺组织中ATP合成酶活性的结果一致。然而,CF6的水平和ATP合成酶的活性在肺部血管和尾静脉的血样中没有差异。
研究讨论:
在缺氧诱导的PAH中,CF6在肺组织中表现出下调的表达,但在肺血管和循环中却没有。因此,我们推测CF6和ATP合成酶可能在缺氧诱导的PAH中发挥重要作用。
参考文献:
Lı N, Shı Y, Yın J, Sun L, Zhang Q, Bao S, Zhang J, Lı Y, Wang M, Zhang Y, Xue M, Qı L, Lı Y, Yan S, Lı X. Impact of ATP synthase/coupling factor 6 in hypoxic pulmonary arterial hypertension: An experimental rat model. Turk J Med Sci. 2022 Oct;52(5):1468-1477. doi: 10.55730/1300-0144.5485. Epub 2022 Oct 19. PMID: 36422496.
版权声明:
本网站所有注明“来源:梅斯医学”或“来源:MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明“来源:梅斯医学”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言