【协和医学杂志】全胰切除术与胰十二指肠切除术治疗胰腺癌的手术疗效和生活质量对比分析:基于倾向性评分匹配的回顾性队列研究
2024-08-24 协和医学杂志 协和医学杂志
本研究旨在比较接受上述两种术式的胰腺癌患者在术后并发症、短期死亡率、长期生活质量及生存期方面的差异,以期为TP的临床应用积累更多循证医学证据,同时为胰腺癌患者最佳手术策略的制订提供参考。
胰腺癌恶性程度高、进展快、预后极差。手术切除是目前公认的早期和局部进展期胰腺癌的首选治疗方法,亦是唯一可能获得治愈的治疗手段[1]。胰十二指肠切除术(PD)是治疗胰头癌的重要术式,但存在难度高、创伤大、切除脏器多、消化道重建复杂、术后并发症发生率高等严重局限性,甚至可导致患者死亡[2]。其中胰瘘是PD术后最常见且最凶险的并发症,其导致的腹腔出血、腹腔感染和败血症是PD术后患者死亡的最主要原因[3],因此,亟待探寻新的胰腺癌治疗策略。
近年来,全胰切除术(TP)得到了越来越广泛的认可,部分学者认为其可作为高危胰瘘患者PD的替代方法[4-6]。此外,对于PD术中胰颈切缘经反复扩切后冰冻病理仍回报阳性的胰腺癌患者,TP是达到根治性切除的必要术式,有助于延长患者生存期[7-8]。
本研究旨在比较接受上述两种术式的胰腺癌患者在术后并发症、短期死亡率、长期生活质量及生存期方面的差异,以期为TP的临床应用积累更多循证医学证据,同时为胰腺癌患者最佳手术策略的制订提供参考。
资料与方法
1.1 研究对象
本研究为回顾性队列研究,研究对象为北京协和医院2016年1月至2021年12月行TP(TP组)和2019年1月至2021年12月行PD(PD组)的胰腺癌患者。
纳入标准:术后病理诊断为胰腺导管腺癌。排除标准:(1)术前合并心、肝、肾等脏器功能衰竭者;(2)术中联合多脏器切除者;(3)重要临床资料明显缺失者(如手术细节、术后并发症情况和病理信息等)。
根据危险因素的不同,将PD组患者分为胰瘘高风险PD组和复发高风险PD组。其中胰瘘高风险定义为胰管直径≤3 mm或胰腺质地软[6,9]。复发高风险定义为术中冰冻病理显示胰颈切缘阳性但患者家属拒绝行TP,或术后石蜡标本病理回报示胰颈切缘阳性。
本研究已通过北京协和医院伦理审查委员会审批(审批号:K24C0176),并豁免患者知情同意。
1.2 观察指标
收集胰腺癌患者的临床资料,包括年龄,性别,体质量指数(BMI),美国麻醉医师协会(ASA)分级,术前是/否合并高血压、糖尿病、冠心病、胰腺炎、梗阻性黄疸、低白蛋白血症,是/否行新辅助化疗,手术时间,术中出血量、输血量,是/否保留幽门、行腹腔镜手术、静脉切除重建,术后并发症发生率(胰瘘、胃排空障碍、胆瘘、乳糜瘘、腹腔感染、术后出血等)及Clavien-Dindo分级,ICU停留时间,呼吸机使用时间,住院时间,30 d死亡率。
其中术后并发症的判定参考《胰腺术后外科常见并发症防治指南(2022)》[10]。
短期手术疗效指标包括:Clavien-Dindo分级、术后并发症发生率、呼吸机使用时间、ICU停留时间、住院时间、30 d死亡率;
长期手术疗效指标包括:总生存期(仅限TP组与复发高风险PD组)。
采用生命质量核心量表(QLQ-C30)进行长期术后生活质量评估。该量表由欧洲癌症治疗研究组织于1993年所研制,是目前国际上应用最广泛的针对恶性肿瘤患者生活质量评估的调查问卷[11]。
QLQ-C30量表由1项总体健康状况指标、5项功能方面指标(身体功能、角色功能、情绪功能、认知功能及社会功能)、3项症状相关指标(疲劳、恶心与呕吐、疼痛)、6项单项指标(呼吸困难、失眠、食欲丧失、便秘、腹泻、经济困难)共30个条目组成,可从多维度对患者的生活质量进行全面评估。
所有患者出院后采用电话或门诊复诊的方式完成随访,了解患者的治疗计划及生存情况,并在取得患者同意后由患者本人填写QLQ-C30量表,对阅读困难者由其直接照护者或随访人员协助填写。所有患者随访时间截至2023年12月。
1.3 质量控制
本研究在研究设计、数据处理过程中采取以下方法控制偏倚:
|
1 |
严格按照纳入标准和排除标准筛选研究对象; |
|
2 |
保证临床资料的完整性,观察指标的客观性、可量化性; |
|
3 |
对于存在争议的临床数据,由至少2名研究人员综合评定后共同判读; |
|
4 |
采用倾向性评分的方式匹配研究对象,以减少混杂因素的干扰。 |
1.4 样本量估算
本研究采用倾向性评分法对TP组和胰瘘高风险PD组患者进行1:2匹配,最终纳入TP组患者29例、胰瘘高风险PD组患者56例,并据此进行检验效能分析。根据TP组、胰瘘高风险PD组术后并发症Clavien-Dindo分级≥Ⅲa发生率分别为17.24%、8.93%,采用GofChisquarePower方法进行效能分析,结果显示在显著性水平α=0.05时,检验效能为72.70%。如根据TP组无胰瘘发生,胰瘘高风险PD组胰瘘发生率为19.64%进行计算,检验效能为98.32%。
此外,如以TP组患者32例、复发高风险PD组患者15例进行相关计算。根据TP组无胰瘘发生,复发高风险PD组胰瘘发生率为20.00%,经计算检验效能为86.56%。提示,当前样本量在检测差异时具有中高等程度的统计效能,可在一定程度上确保研究结果的可靠性和科学性。
1.5 统计学处理
采用SPSS 22.0软件进行统计学分析。计量资料如符合正态分布(年龄),以均数±标准差表示,组间比较采用独立样本t检验;如不符合正态分布(手术时间、术中出血量、QLQ-C30评分等),以中位数(四分位数)表示,组间比较采用Mann-Whitney U检验;性别、ASA分级等计数资料以频数(百分数)表示,组间比较采用卡方检验或Fisher精确概率法。
采用倾向性评分法对TP组和胰瘘高风险PD组患者进行1:2匹配,设置卡钳值为0.1(匹配时概率上允许的误差)。采用Graphpad Prism 6.0软件绘制Kaplan-Meier生存曲线,Log-rank检验比较TP组和复发高风险PD组患者生存率差异,Cox回归进行预后分析。以P<0.05为差异具有统计学意义。
2 结果
2.1 一般临床资料
共入选符合纳入与排除标准的TP组患者32例(均联合脾切除),PD组患者174例,其中胰瘘高风险PD组99例,复发高风险PD组15例。TP组32例患者中,18例为胰腺切缘冰冻病理回报阳性,6例为术中探查示病变广泛、同时累及胰腺头颈部和体尾部,6例为胰腺质地糟脆、胰管直径细、胰肠吻合困难,2例为胰体尾部萎缩。
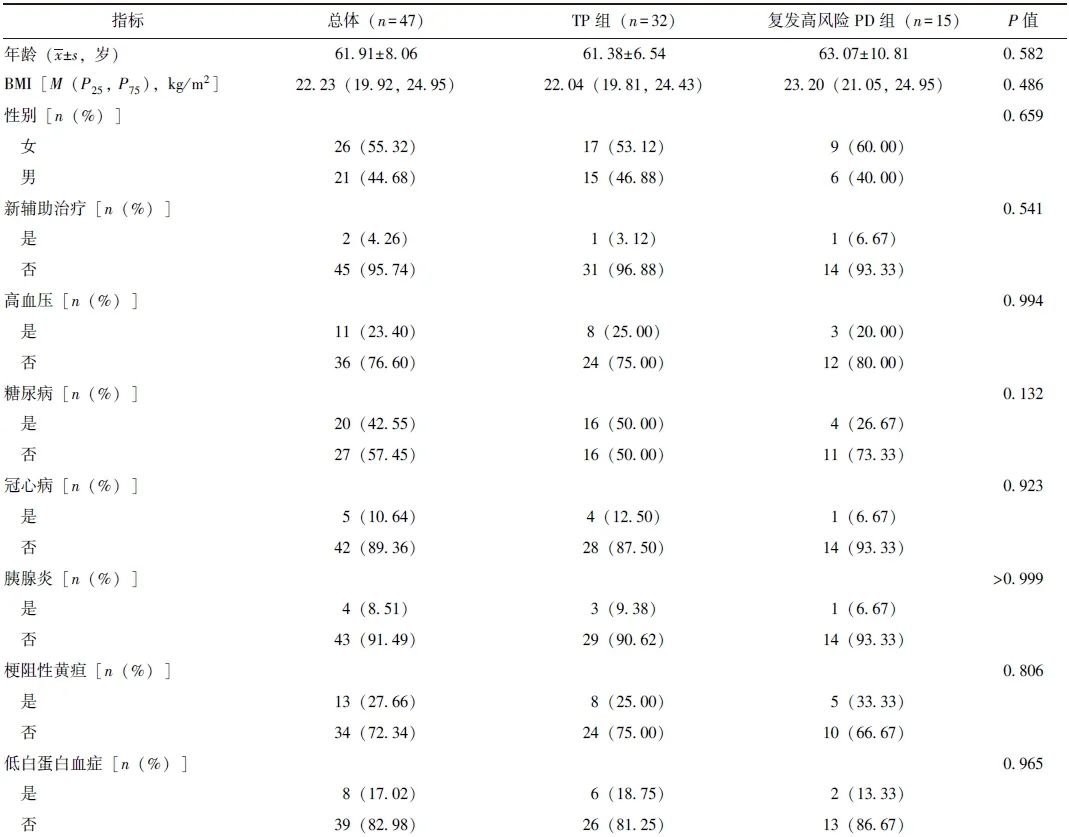
在基线资料方面,TP组糖尿病患病率和静脉切除重建率显著高于胰瘘高风险PD组(P均<0.05),见表1。TP组与复发高风险PD组基线资料均无统计学差异(P均>0.05),见表2。
表1 TP组和胰瘘高风险PD组基线资料比较
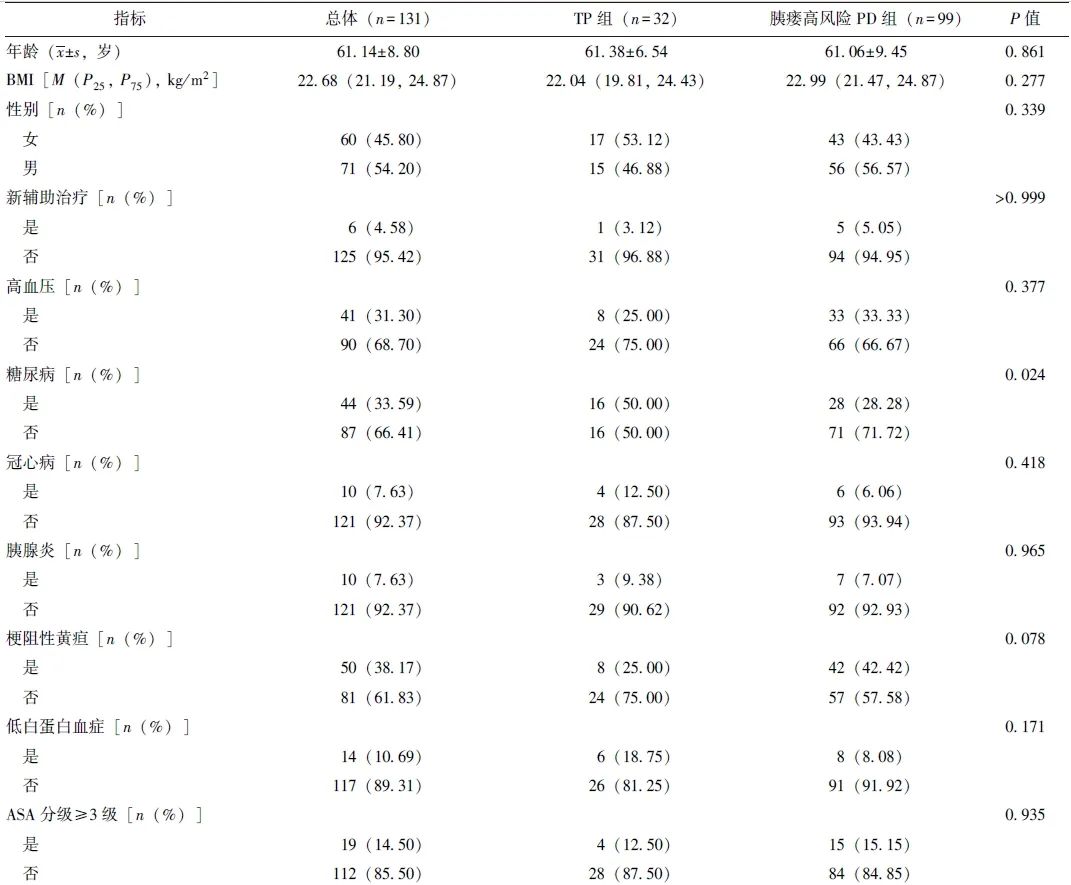

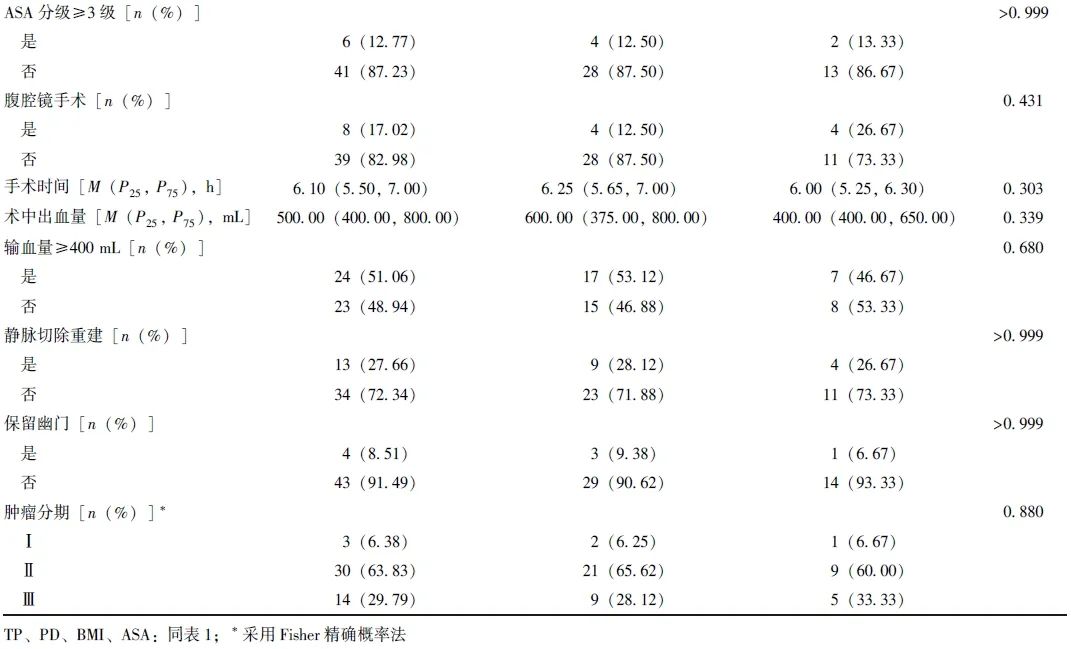
表2 TP组和复发高风险PD组基线资料比较
2.2 TP组和胰瘘高风险PD组短期手术疗效和长期生活质量比较
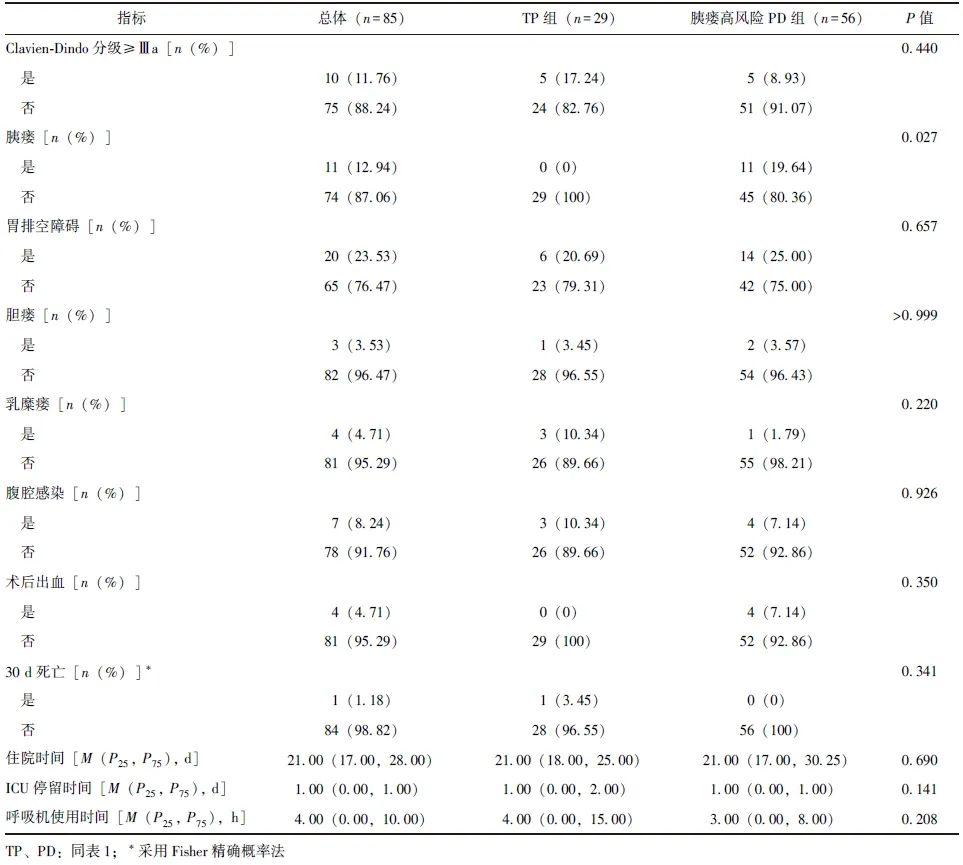
采用倾向性评分法对TP组和胰瘘高风险PD组患者进行1:2匹配,最终纳入TP组患者29例、胰瘘高风险PD组患者56例。两组匹配后患者基线资料差异均无统计学意义(P均>0.05)。TP组无胰瘘发生,胰瘘高风险PD组胰瘘发生率为19.64%,差异具有统计学意义(P=0.027),两组其他术后并发症发生率、Clavien-Dindo分级、住院时间、ICU停留时间、30 d死亡率等短期手术疗效指标均无统计学差异(P均>0.05),见表3。
表3 倾向性评分匹配后TP组和胰瘘高风险PD组短期手术疗效比较
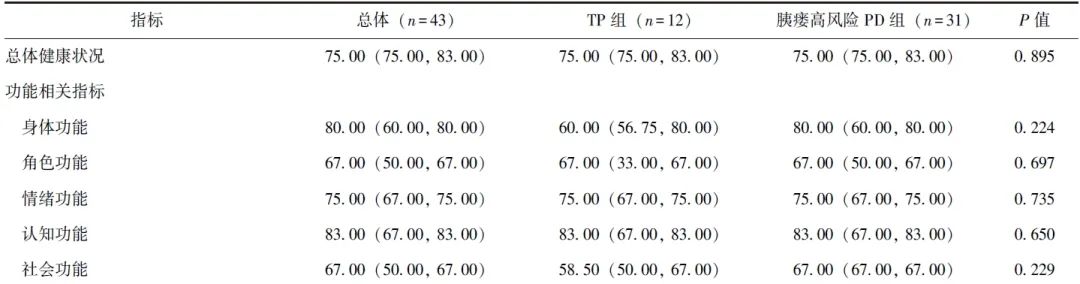
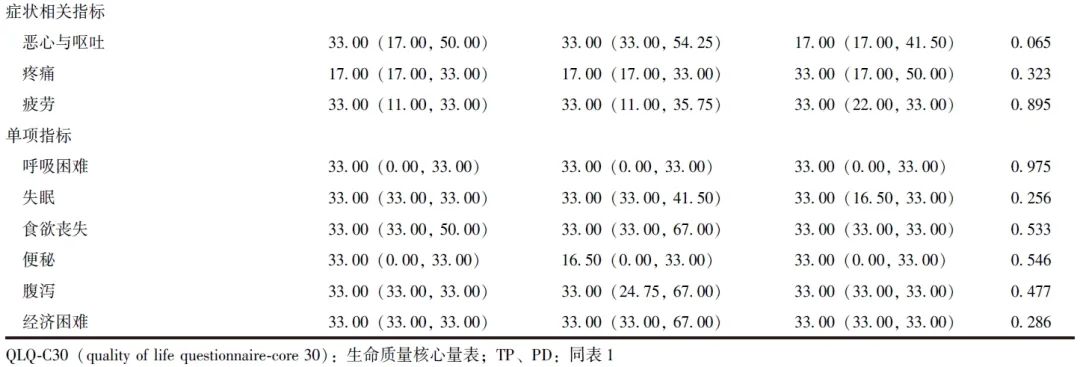
排除失访和死亡病例后,TP组12例完成随访,胰瘘高风险PD组31例完成随访。两组患者中位随访时间均为36个月,QLQ-C30评分均无显著差异(P均>0.05),见表4。
表4 倾向性评分匹配后TP组和胰瘘高风险PD组长期QLQ-C30评分比较[M(P25, P75),分]
2.3 TP组和复发高风险PD组短期手术疗效和长期预后分析
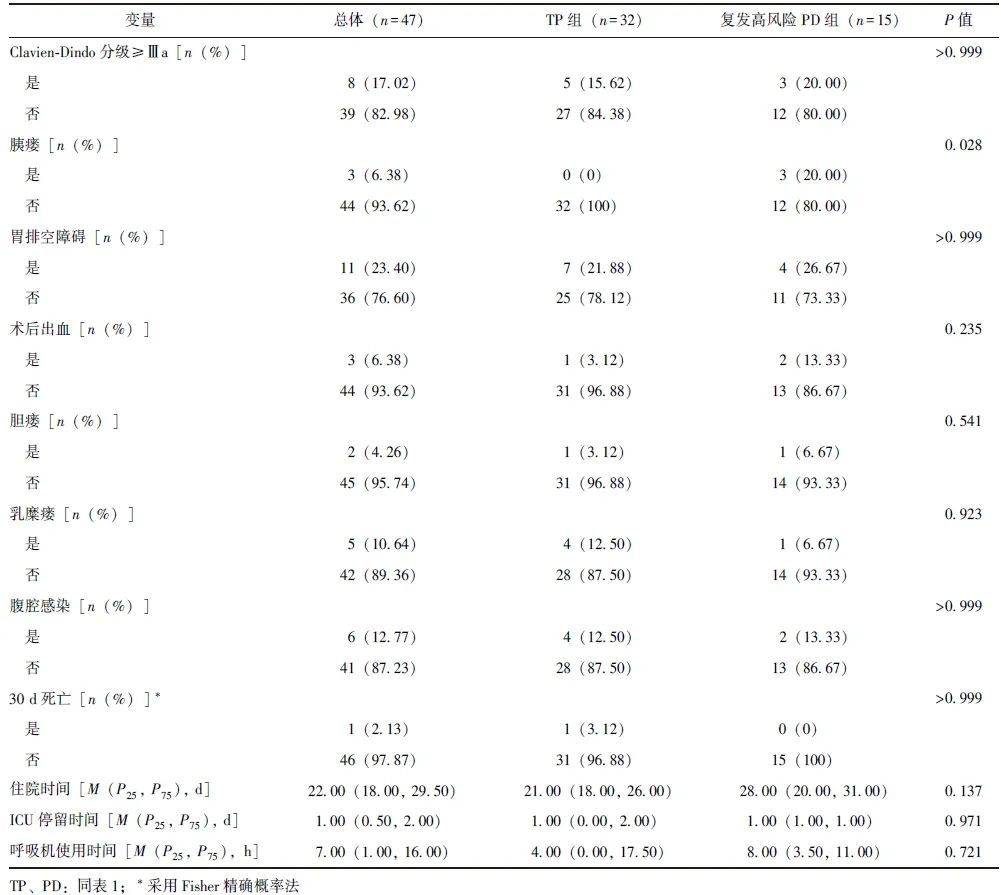
由于TP组和复发高风险PD组基线资料均无统计学差异(P均>0.05),故TP组32例、复发高风险PD组15例均纳入分析。TP组无胰瘘发生,复发高风险PD组胰瘘发生率为20.00%,差异具有统计学意义(P=0.028),两组其他术后并发症发生率、Clavien-Dindo分级、住院时间、ICU停留时间、30 d死亡率等短期手术疗效指标均无统计学差异(P均>0.05),见表5。
表5 TP组和复发高风险PD组短期手术疗效比较
截至末次随访,复发高风险PD组死亡12例,TP组死亡14例,无失访病例。与复发高风险PD组比较,TP组中位总生存期更长(37.68个月比15.24个月,HR=2.551,95% CI:1.144~5.689,P=0.018),见图1。
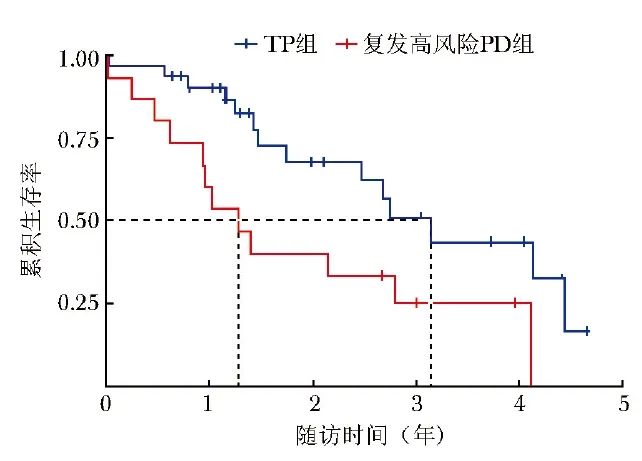
图1 TP组和复发高风险PD组Kaplan-Meier生存曲线
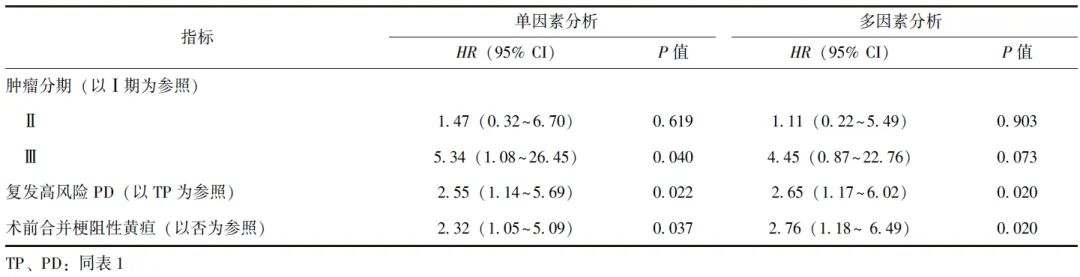
因复发高风险PD组仅2例患者完成QLQ-C30量表,故TP组和复发高风险PD组未进行长期生活质量比较。单因素Cox回归纳入自变量包括:性别,年龄,BMI,是/否接受新辅助治疗,是/否合并基础疾病(高血压、糖尿病、冠心病)、胰腺炎、梗阻性黄疸,是/否合并低白蛋白血症,ASA分级,手术时间,是/否行腹腔镜手术,术中出血量和输血量,是/否行静脉重建,是/否保留幽门,术后并发症情况及是/否为复发高风险TP,以生存结局和生存时间为因变量,结果显示肿瘤分期为Ⅲ期、复发高风险PD、术前合并梗阻性黄疸与胰腺癌患者预后不良具有相关性(P均<0.05)。多因素Cox回归显示,复发高风险PD、术前合并梗阻性黄疸是胰腺癌患者长期预后不良的独立危险因素,见表6。
表6 TP组和复发高风险PD组患者长期预后影响因素的Cox比例风险模型分析结果
3 讨论
本研究基于倾向性评分法,评估了TP在胰腺癌患者中的应用价值,结果显示,在短期手术疗效方面,胰瘘高风险PD组(19.64%)、复发高风险组(20.00%)胰瘘发生率均高于TP组(0),差异均具有统计学意义(P均<0.05),胰瘘高风险PD组、复发高风险组其他短期手术疗效指标与PD组均无统计学差异(P均>0.05)。
在长期手术疗效和长期生活质量方面,TP组和胰瘘高风险PD组QLQ-C30评分均无统计学差异(P均>0.05);与复发高风险PD组比较,TP组中位总生存期更长(37.68个月比15.24个月,HR=2.551,95% CI:1.144~5.689,P=0.018),且多因素Cox回归显示,复发高风险PD、术前合并梗阻性黄疸是胰腺癌患者长期预后不良的独立危险因素。提示,对于胰瘘高风险的胰腺癌患者,TP可获得与PD相当的短期手术疗效和长期生活质量,且术后无胰瘘负担。对于复发高风险的胰腺癌患者,TP在保证手术安全性的基础上可显著改善预后。
胰腺癌具有恶性程度高、侵袭性强、预后差的特点,如何改善胰腺癌患者预后,是临床研究的热点和难点。近20年来,随着手术技术的进步及围术期护理水平的提升,TP在胰腺外科受到广泛关注,其手术安全性亦逐渐得到认可,并成为胰腺炎/胰腺癌治疗的主流术式之一[12]。
笔者团队认为,目前TP的手术指征包括:
|
1 |
胰腺癌累及全胰腺,或病灶呈多灶性生长; |
|
2 |
慢性胰腺炎累及全胰腺,胰腺功能严重受损,临床症状明显,保守治疗无效; |
|
3 |
胰腺导管内乳头状黏液瘤(IPMN)累及全胰腺,尤其主胰管型IPMN,或术中切缘提示可疑恶变; |
|
4 |
胰腺神经内分泌肿瘤呈弥漫性生长累及全胰腺; |
|
5 |
胰头切除术后残余胰腺吻合困难。 |
Casadei等[13]开展的一项单中心、前瞻性、观察性研究对73例行TP和184例行PD治疗的胰腺癌患者进行了连续随访,结果发现两组术后并发症发生率和总生存率均无显著差异,其中119例(TP组35例,PD组84例)进行生活质量评估的患者中,两组5个维度评分亦无显著差异。
Zhu等[14]基于SEER数据库中743例接受TP和4005例接受PD治疗的胰头部导管腺癌患者的临床资料,比较了两种术式的临床疗效,结果显示经倾向性评分匹配后两组患者的30 d与90 d死亡率、总生存率均无显著差异,再次证明了TP的安全性。
PD是治疗胰腺癌的经典术式,但存在术后胰瘘高发的局限性,尤其对于高风险患者。为降低术后胰瘘风险及其带来的严重后果,近年来有学者推荐将TP作为PD的替代术式,以治疗胰头切除术后胰瘘高风险患者[15]。
关于胰瘘高风险PD的定义,目前尚未达成一致标准。有研究将胰瘘风险评分(FRS)≥7分[16]或替代胰瘘风险评分(a-FRS)>20%[17]作为胰瘘高风险PD的判定标准,也有研究者认为上述定义较为复杂,推荐胰腺质地软和/或胰管直径≤3 mm的判定方法[9,15]。
2023年Schuh等[3]提出了简化的胰瘘风险评估策略,即根据胰管大小和胰腺质地分类可准确预测术后胰瘘事件,胰腺质地软与主胰管直径≤3 mm可显著增加PD术后胰瘘发生风险。
本研究中,笔者亦采用该方法对胰瘘高风险进行定义。倾向性评分匹配前,TP组患者具有更高的糖尿病患病率,可能与此类患者胰腺病变更为广泛,胰岛细胞功能受损更严重有关。此外,此类患者更易出现肿瘤侵犯门静脉或肠系膜上静脉,以致TP术中静脉重建的比例更高,对手术医师的能力和经验提出了更高要求。倾向性评分匹配后结果显示,胰瘘高风险PD组胰瘘发生率为19.64%,而TP组无病例发生胰瘘,两组其他手术疗效评价指标、生活质量评分均无显著差异。
本研究与最新研究结果相一致:2023年Stoop等[6]开展的荟萃分析纳入1项随机对照研究和4项观察性研究共334例TP 患者和373例胰瘘高风险PD患者,结果显示TP组与胰瘘高风险PD组90 d死亡率、并发症发生率及远期(中位随访30~52个月)QLQ-C30评分均无显著差异。同年发表的一项双中心前瞻性随机对照研究纳入了2010—2019年期间31例胰瘘高风险PD患者和30例TP联合胰岛自体移植(TP-IAT)患者结果显示,TP-IAT组术后90 d内包含胰瘘在内的腹部并发症发生率更低(53.3%比90.3%,P=0.0016),两组无病生存率、疾病特异性生存率及总生存率均无显著差异[15]。
提示,对于PD术中探查发现胰腺质地糟脆、胰管直径细、胰-肠吻合困难的患者,其术后胰瘘发生率极高,采用TP治疗可取得与PD相当的短期手术疗效和长期生活质量,TP作为一种纾困方案,可避免发生胰瘘相关严重并发症和死亡,成为此类患者的新治疗选择。
由于胰腺癌浸润广泛、边界不清,且常呈多中心生长,只有术中借助冰冻病理检查才可明确肿瘤侵犯范围,从而确定手术方案。部分学者认为TP是局部进展期胰腺癌或多中心胰腺癌达到根治的必要术式[18-19]。既往研究发现,对于PD术中胰颈切缘阳性(R1切除)的胰腺癌患者,单纯扩大切除范围获得阴性边缘并不能改善其生存率[8]。但对于中转TP的患者,既可避免术后胰瘘和由此导致的出血等严重并发症,也可减少复发风险,患者总生存期明显延长[19-20]。
目前,胰腺癌术中胰颈切缘阳性是局部复发的危险因素已达成广泛共识[21-22]。2019年欧洲胰腺癌研究小组发表的随机对照试验表明,胰颈切缘阳性不仅可显著增加胰腺癌患者局部复发风险,而且可降低患者的总生存率和无复发生存率[23]。虽然部分研究者持不同观点,但相关研究样本量较小,结果可信度受限[24]。
本研究将术中冰冻病理示胰颈切缘阳性但拒绝行TP治疗和术后病理回报胰颈切缘阳性的胰腺癌患者定义为复发高风险PD。结果显示,与TP组相比,复发高风险PD组远期预后更差,提示部分胰腺癌患者或可通过术中中转TP而受益,继而延长其生存期。
临床实践中,部分患者可能因担心TP术后消化不良和糖尿病风险而拒绝接受TP。虽然接受TP的患者均会发生胰腺内分泌和外分泌功能不全[4],但经药物治疗多数患者可获得良好的控制,且不影响总体生活质量[25-26]。
2023年赵维纲教授团队发表的一项回顾性研究对80例行TP治疗和80例完全胰岛素缺乏的1型糖尿病患者进行了长期追踪,中位随访20个月时,TP 患者的糖化血红蛋白水平、连续血糖监测评估时间及血糖变异系数与1型糖尿病患者均相近,所有TP患者均恢复正常食物摄入量,且在每日约900 mg胰酶替代治疗的基础上,超过90%的患者未发生脂肪性腹泻[27]。
Shaw等[28]研究发现,中位随访时间9.3年时,行胰腺手术患者的糖尿病依赖性生活质量评分与普通人群中非胰源性糖尿病患者相似,且相较于非癌症患者,糖尿病对癌症患者的整体生活质量影响更小。提示,经过规范化干预,TP未对术后胰腺功能和生活质量产生重大影响,对于复发高风险胰腺癌患者,经过获益与风险权衡,可考虑行TP治疗。
本研究局限性:(1)为单中心小样本回顾性研究,且未涵盖术后血糖控制情况,可能导致分析结果存在一定偏倚;(2)仅采用QLQ-C30量表进行生活质量评估,可能无法全面反映患者临床症状;(3)未统计无复发生存时间。
综上所述,对于胰瘘高风险胰腺癌患者,TP可取得与PD相当的术后并发症发生率、短期死亡率及长期生活质量,且TP无胰瘘负担,可能更有利于患者术后康复。对于复发高风险胰腺癌患者,TP可在保证手术安全性的基础上,显著延长其生存期。鉴于本研究样本量较小,且存在多方面局限性,确切结论尚需大样本前瞻性研究进一步验证。
参考文献
[1]Schneider M, Hackert T, Strobel O, et al. Technical advances in surgery for pancreatic cancer[J]. Br J Surg, 2021, 108(7): 777-785.
[2]Li T Y, Qin C, Zhao B B, et al. Risk stratification of clinically relevant delayed gastric emptying after pancreaticoduodenectomy[J]. BMC Surg, 2023, 23(1): 222.
[3]Schuh F, Mihaljevic A L, Probst P, et al. A simple classification of pancreatic duct size and texture predicts postoperative pancreatic fistula: a classification of the international study group of pancreatic surgery[J]. Ann Surg, 2023, 277(3): e597-e608.
[4]Marchegiani G, Perri G, Burelli A, et al. High-risk pancreatic anastomosis versus total pancreatectomy after pancreatoduodenectomy: postoperative outcomes and quality of life analysis[J]. Ann Surg, 2022, 276(6): e905-e913.
[5]Sommier L, Panaro F. Decision-making in high-risk leakage duodenopancreatectomy: pancreatic anastomosis or total pancreatectomy?[J]. Hepatobiliary Surg Nutr, 2023, 12(4): 567-569.
[6]Stoop T F, Bergquist E, Theijse R T, et al. Systematic review and meta-analysis of the role of total pancreatectomy as an alternative to pancreatoduodenectomy in patients at high risk for postoperative pancreatic fistula: is it a justifiable indication?[J]. Ann Surg, 2023, 278(4): e702-e711.
[7]林荣贵, 黄鹤光, 陈燕昌, 等. 胰颈切缘阳性的胰头腺癌行全胰十二指肠切除术的临床疗效[J]. 中华消化外科杂志, 2014, 13(11): 864-866.
[8]Hernandez J, Mullinax J, Clark W, et al. Survival after pancreaticoduodenectomy is not improved by extending reps to achieve negative margins[J]. Ann Surg, 2009, 250(1): 76-80.
[9]Stoop T F, Ghorbani P, Scholten L, et al. Total pancreatectomy as an alternative to high-risk pancreatojejunostomy after pancreatoduodenectomy: a propensity score analysis on surgical outcome and quality of life[J]. HPB(Oxford), 2022, 24(8): 1261-1270.
[10]中华医 学会外科学分会胰腺外科学组, 中国研究型医院学会胰腺疾病专业委员会, 中华外科杂志编辑部. 胰腺术后外科常见并发症防治指南(2022)[J]. 中华外科杂志, 2023, 61(7): e1-e18.
[11]Nolte S, Liegl G, Petersen M A, et al. General population normative data for the EORTC QLQ-C30 health-related quality of life questionnaire based on 15,386 persons across 13 European countries, Canada and the Unites States[J]. Eur J Cancer, 2019, 107: 153-163.
[12]Scholten L, Latenstein A E J, van Eijck C, et al. Outcome and long-term quality of life after total pancreatectomy(PANORAMA): a nationwide cohort study[J]. Surgery, 2019, 166(6): 1017-1026.
[13]Casadei R, Ricci C, Taffurelli G, et al. Is total pancreatectomy as feasible, safe, efficacious, and cost-effective as pancreaticoduodenectomy? A single center, prospective, observational study[J]. J Gastrointest Surg, 2016, 20(9): 1595-1607.
[14]Zhu J S, Jiang Z Y, Xie B, et al. Comparison of oncologic outcomes between pancreaticoduodenectomy and total pancreatectomy for pancreatic adenocarcinoma[J]. Surg Endosc, 2023, 37(1): 109-119.
[15]Balzano G, Zerbi A, Aleotti F, et al. Total pancreatectomy with islet autotransplantation as an alternative to high-risk pancreatojejunostomy after pancreaticoduodenectomy: a prospective randomized trial[J]. Ann Surg, 2023, 277(6): 894-903.
[16]Callery M P, Pratt W B, Kent T S, et al. A prospectively validated clinical risk score accurately predicts pancreatic fistula after pancreatoduodenectomy[J]. J Am Coll Surg, 2013, 216(1): 1-14.
[17]Mungroop T H, Van Rijssen L B, Van Klaveren D, et al. Alternative fistula risk score for pancreatoduodenectomy(a-FRS): design and international external validation[J]. Ann Surg, 2019, 269(5): 937-943.
[18]Crippa S, Tamburrino D, Partelli S, et al. Total pancreatectomy: indications, different timing, and perioperative and long-term outcomes[J]. Surgery, 2011, 149(1): 79-86.
[19]Crippa S, Belfiori G, Tamburrino D, et al. Indications to total pancreatectomy for positive neck margin after partial pancreatectomy: a review of a slippery ground[J]. Updates Surg, 2021, 73(4): 1219-1229.
[20]Schmidt C M, Glant J, Winter J M, et al. Total pancreatectomy(R0 rep) improves survival over subtotal pancreatectomy in isolated neck margin positive pancreatic adenocarcinoma[J]. Surgery, 2007, 142(4): 572-578.
[21]Sugiura T, Uesaka K, Mihara K, et al. Margin status, recurrence pattern, and prognosis after rep of pancreatic cancer[J]. Surgery, 2013, 154(5): 1078-1086.
[22]López J C, Ielpo B, Iglesias M, et al. The impact of vascular margin invasion on local recurrence after pancreatoduodenectomy in pancreatic adenocarcinoma[J]. Langenbecks Arch Surg, 2024, 409(1): 122.
[23]Ghaneh P, Kleeff J, Halloran C M, et al. The impact of positive rep margins on survival and recurrence following rep and adjuvant chemotherapy for pancreatic ductal adenocarcinoma[J]. Ann Surg, 2019, 269(3): 520-529.
[24]Joliat G R, Allemann P, Labgaa I, et al. Prognostic value of positive histological margins in patients with pancreatic head ductal adenocarcinoma and lymph node involvement: an international multicentric study[J]. HPB(Oxford), 2021, 23(3): 379-386.
[25]Andrén-Sandberg Å, Ansorge C, Yadav T D. Are there indications for total pancreatectomy in 2016?[J]. Dig Surg, 2016, 33(4): 329-334.
[26]Stoop T F, Ateeb Z, Ghorbani P, et al. Impact of endocrine and exocrine insufficiency on quality of life after total pancreatectomy[J]. Ann Surg Oncol, 2020, 27(2): 587-596.
[27]Zhao T Y, Fu Y, Zhang T P, et al. Diabetes management in patients undergoing total pancreatectomy: a single center cohort study[J]. Front Endocrinol(Lausanne), 2023, 14: 1097139.
[28]Shaw K, Thomas A S, Rosario V, et al. Long term quality of life amongst pancreatectomy patients with diabetes mellitus[J]. Pancreatology, 2021, 21(3): 501-508.
作者:协和医学杂志
版权声明:
本网站所有注明“来源:梅斯医学”或“来源:MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明“来源:梅斯医学”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言









#胰腺癌# #胰十二指肠切除术# #全胰切除术#
49