【AJH】改善骨髓纤维化异基因移植预后的13个问题
2024-03-20 聊聊血液 聊聊血液
作者审查了近期关于异基因移植治疗骨髓纤维化的诊疗变化和更新,通过13个问题进行阐述,旨在改善接受异基因 HSCT 的 MF 患者的预后。
骨髓纤维化异基因移植
骨髓纤维化 (MF) 是一种费城染色体阴性骨髓增殖性肿瘤 (MPN),可能为原发性骨髓纤维化(PMF),或继发于原发性血小板增多症或真性红细胞增多症(继发性骨髓纤维化,SMF)。异基因造血干细胞移植 (HSCT) 仍是MF 患者唯一的治愈性治疗,且每年接受异基因 HSCT 的 MF 患者数量稳步增加。多年来随着非复发死亡率 (NRM) 的降低,HSCT变得更安全,使得 HSCT在治疗 MPN中更具吸引力,但NRM和复发仍是两个需要解决的显著并发症。
《American Journal of Hematology》近日发表综述,作者审查了近期关于异基因移植治疗骨髓纤维化的诊疗变化和更新,通过13个问题进行阐述,旨在改善接受异基因 HSCT 的 MF 患者的预后。13个问题具体包括:患者选择、预后系统、脾肿大的管理、预处理方案、预测移植结局、干细胞来源、干细胞供体、移植物抗宿主病 (GvHD) 预防、急变期患者、造血重建、疾病标志物、供体嵌合及复发的治疗。

1. 选择进行异基因HSCT的MF患者:器官功能
第一步是全面评估,以确保患者有足够的器官功能储备来承受移植过程的生理应激,包括预处理方案的毒性及移植后并发症,如移植物抗宿主病 (GVHD)、长期血细胞减少和感染。此外心理社会评估很重要。应评估心脏、肺、肝和肾功能,且通常每个机构都有HCT的常规实践。心脏功能通常通过超声心动图或 MUGA 扫描进行测量,EF 50%通常是临界值。此外需要特别注意肺动脉收缩压 (PASP),肺动脉高压 (PASP >24mmHg) 与较差预后显著相关(OS 58.9% vs. 88.8%;p=0.024),主要是由于增加 NRM(21.6% vs. 7.1%;p=0.007)。应通过完整的肺功能检查评估肺功能,充分的肺功能定义为一氧化碳弥散量(DLCO)和FEV1 > 50%。通常使用估计的 GFR 或实际肌酐清除率>60mL/min评估肾功能。肝功能测量应确保胆红素小于正常值上限的2倍,除非患者有Gilbert综合征。
MF是一种老年病,诊断时的中位年龄为67岁。HSCT一般没有明确的年龄上限,但由于老年患者中器官功能和合并症更常见,既往HSCT多用于<60岁患者,且清髓性预处理(MAC)方案更为常见。过去几十年中减低强度预处理(RIC)的使用改善了患者获得异基因移植的机会。即使患者70多岁,如果特别fit,也可考虑进行移植;但目前没有试验对老年MF患者进行研究,以评估中危-2或高危DIPSS是否仍可预测>70岁患者进行移植的生存优势。
2. 预后系统:选择MF患者进行异基因干细胞移植
在彻底的体格检查后,还需要评估患者的疾病是否值得承担异基因HSCT的风险。过去几年已经开发出了多种预后评分系统,用于识别可能进展的患者,从而具有高发病率和死亡率风险。目前应用最广泛的是DIPSS:年龄>65岁、有全身症状、外周血原始细胞计数≥1%、白细胞计数(WBC)> 25X109/L赋分1分,血红蛋白<100g/L赋分2分。DIPSS有4个分类:低危、中危-1、中为-2、高危,分别为0、1~2、3~4分或5-6分。在年龄校正的DIPSS中,WBC> 25X109/L为1分,血红蛋白<100g/L、全身症状和外周血原始细胞计数≥1%为2分。对DIPSS分型MF患者中行异基因HSCT与未行HSCT的生存情况进行比较,发现在DIPSS中危-2和高危MF患者中,HSCT具有生存优势;DIPSS中危-1无统计学差异,低危患者生存明显不利。中危-2和高危DIPSS患者应考虑行异基因HSCT。继发性MF患者可使用DIPSS-Plus或MYSEC-PM,MYSEC-PM中危-2或高危患者应考虑移植。
3. DIPSS中危-1患者是否应接受异基因HSCT?
DIPSS中危-1患者通常不认为适合HSCT,但一种新的预后评分MIPSS-70(突变IPI系统)可用于识别存在有害突变(包括ASXL1、EZH2、SRSF2、IDH1/2和U2AF1)的患者。结合细胞遗传学数据,可使用进一步增强的预后工具MIPSS70+ v2.0。虽然归为DIPSS中危-1,但携带一种或多种有害突变的患者预期寿命缩短,因此可考虑接受HSCT。另外一种仅使用核型和突变分析的预后评分系统(GIPSS,genetically inspired prognostic scoring system,遗传启发的预后评分系统)已设计出来,其基于不良核型、无CALR-1突变、存在ASXL1、SRSF2或U2AF1,将患者分为低危组、中危1组、中危2组和高危组,中位生存期分别为26、8、4、2年。GIPSS在MF患者中优于DIPSS。
选择患者之前需要仔细考虑许多因素,包括接受或不接受HSCT的倾向:DIPSS中危-1且有HLA相合同胞供者的40岁患者可能选择接受移植,尽管通常没有指征。在对DIPSS分层的MF患者进行移植和非移植生存率比较的研究中,这一点非常清楚:在EBMT登记系统中,移植组82例患者为DIPSS低危,248例为中危-1,186例为中危-2,551例为高危。换句话说,近1/4的患者在DIPSS中危-1的情况下接受了移植,8%的患者在DIPSS低危的情况下接受了移植。
4. RR6模型
最近的研究表明,在接受芦可替尼治疗的患者中,6个月时脾脏体积缩小35% (RSV35)是重要的生存指标,其他指标包括芦可替尼剂量和红细胞输注需求。RR6模型可应用于芦可替尼治疗6个月后的MF患者,以识别:(1)已获批二线治疗的候选患者(高危和特定中危患者);(2)适合异基因HSCT的患者(在开始芦可替尼治疗时移植指征不明确的高危患者);(3)由于生存期有限(高危和特定中危患者),需要进行研究性二线干预试验。
5.脾肿大的影响和移植前治疗
脾肿大是骨髓纤维化的标志之一,巨脾可增加移植功能不良和移植失败的风险,与不良HCT结局相关。
HSCT前有三种治疗脾肿大的方案:(1)JAK2抑制剂治疗,(2)脾切除术,(3)脾照射。JAK2抑制剂现在是MF患者的标准治疗,并且可使50%以上患者的脾脏缩小。据报道,对于芦可替尼难治性患者,fedratinib可达到68%的最佳总SVR35, 86%的缓解者持续缓解。塞利尼索/芦可替尼、pelabresib/ 芦可替尼或navitoclax/芦可替尼等不同药物的联合治疗不仅显示出与芦可替尼单药治疗相比的SVR35改善,而且在某些情况下还可减少骨髓纤维化。脾切除术是移植前减少脾脏体积的第二种方案;在大多数患者中可行,但也有并发症,尤其是血栓形成;脾切除术与更快的血液学恢复相关,但可能有更高的复发风险,因此没有生存优势。最后,与脾切除术相比,脾照射可缩小脾脏体积,且无明显血管并发症,初步效果良好。但对于巨脾患者,可能仅在移植后采出现明显的脾脏缩小,在这种情况下,如果移植物功能不佳且供者嵌合状态完全,可在移植后进行脾切除术。预计接受脾切除术的患者应接种脑膜炎奈瑟菌、肺炎链球菌和流感嗜血杆菌疫苗,并进行相应抗生素预防。
6.预处理方案
目前最常见的预处理方案为氟达拉滨联合烷化剂(白消安、美法仑或塞替派),其中氟达拉滨剂量范围为120~180 mg/m2。一项前瞻性随机试验比较了氟达拉滨-白消安与氟达拉滨-塞替帕,结果NRM、复发和生存无统计学差异,但白消安组100天混合嵌合率(77%)高于塞替派组(32%)(p=0.005),两组的3年复发率均较高(分别为36%和24%)。氟达拉滨联合美法仑治疗110例患者,中位随访64个月,5年OS为65%。据报道,两种烷化剂联用可提高移植后1个月内完全供者嵌合的患者比例,并显著减少复发:在一项研究中,接受塞替派-白消安-氟达拉滨(TBF)治疗的完全嵌合率为87%,而接受FLU-BU、FLU-MEL或FLU-THIO治疗的患者为45%;两组的5年复发率分别为9%和43%;由于NRM具有可比性,两组的5年无病生存率(DFS)分别为63%和43%。在其他研究中TBF联合治疗也获得较好结果,复发率较低。下表为部分回顾性和一项前瞻性随机研究。
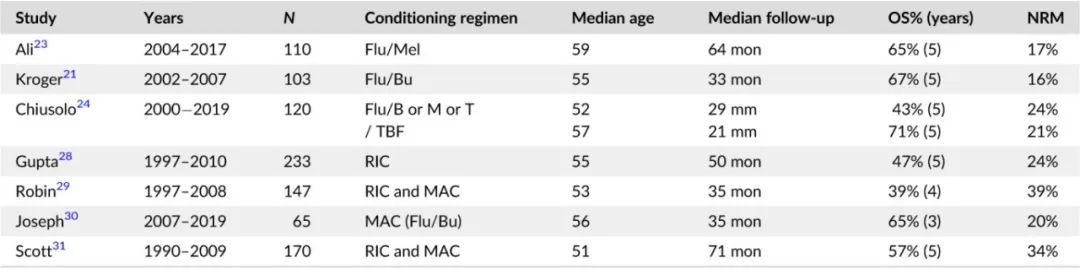
在一项登记组大型研究中,单因素分析显示,OS并未随着时间的推移而改善,可能是由于患者的年龄中位数从49岁增加至目前的59岁;但在包括患者年龄和供者类型的多因素分析中,尽管复发和NRM风险的变化的意义仍然临界,但OS随时间有所改善(p=0.01)。这凸显出骨髓纤维化患者接受异基因移植的复杂性,以及改进预处理方案和GvHD预防的必要性。
7.预测移植结局
MIPSS70在预测HCT结局方面具有效用,与高危组相比中危组的OS较好(HR=0.49;P=0.039)。同样,HCT前MIPSS70+ v2.0中危患者的OS (HR=0.29)也优于高危患者,而VHR的OS明显低于HR患者(HR=5.05)(小编注:原文标注的参考文献[19]有误,应为[23])。
对于接受HCT的MF患者,有一种结合临床-分子特征的风险评分,将MF患者分层为4个风险组:低危(评分0-2分),中危(评分3-4分),高危(评分5分)和极高危(评分>5分),5年OS分别为83%、64%、37%、22%。
一项CIBMTR /EBMT联合研究提出了一种基于患者年龄、贫血和供者类型的MF异基因移植的简单预后评分:年龄>50和相合无关供者(与相合同胞供者相比)赋分1分,Hb<10和不相合无关供者为2分;低、中、高危患者的总生存、NRM、DFS差异均有统计学意义。值得注意的是,283例DIPSS中危1患者中有高达92例根据该评分为低危;在咨询DIPSS中危1患者时,可以考虑这一点。
8.干细胞来源和干细胞供者
与最近CIBMTR/EBMT提出的简单移植评分一致,相合同胞供者(MSD)移植的结局显著优于其他供者类型。对于没有合适的HLA相合供者的MF患者,也正在评估单倍体相合移植,但移植失败和NRM高于MSD移植。因此MSD仍然是最佳选择(如果有的话),其次为相合无关供者。抗胸腺细胞球蛋白(ATG)联合后置环磷酰胺(PTCY)可能是MF患者不相合无关供者和HAPLO移植预防GvHD的有效手段。
大多数报告HCT结局的研究主要采用PBSC作为干细胞来源,目前还没有直接比较骨髓移植和PBSC治疗结局的研究。
9. GvHD预防
对于非去T细胞干细胞移植,标准的GvHD预防措施是钙调神经磷酸酶(CNI)联合甲氨蝶呤或西罗莫司;CNI + MTX平台还可加上ATG,正如替代供者(alternative donor)移植中常做的那样,可降低急性和慢性GvHD的发生率。另一种变化是在CNI + MTX + ATG方案的基础上,在围移植期给予芦可替尼,目的是进一步减少疾病和传入的异基因反应性T细胞的炎性成分。该方案已成为一项先导临床试验的对象,研究在他克莫司+西罗莫司的基础上加用两种剂量水平的芦可替尼(每日2次,每次5 mg和10 mg)。所有患者均植入,III-IV级GvHD期发生率为11%,存在一定程度的中/重度慢性GvHD(24%)。该研究与德国研究不同,后者是四种药物预防方案(ATG + CNI+ MTX +芦可替尼),而前者是三种药物预防方案(他克莫司+西罗莫司+芦可替尼)。
鉴于骨髓纤维化的炎性性质,预计未来几年内将开发出其他GvHD预防方案。事实上PTCY联合CNI和吗替麦考酚酯(MMF)是另一种广泛应用的方案,最初设计用于单倍体相合移植,最近也用于HLA相合移植。对于骨髓纤维化患者,有报道使用单倍体相合移植物和PTCY预防,最近也有报道PTCY用于HLA相合移植:对于后者预计GvHD将得到更好的控制,尽管可能以降低移植物抗白血病(GvL)为代价,从而使单倍体相合移植和HLA相合移植的总生存期相当。也可以使用降低剂量PTCY,早期结果非常令人鼓舞,NRM为7%。
体外去T细胞清除是预防GvHD的另一种方法:纪念斯隆·凯特琳报告,使用CD34作为干细胞来源,随后白消安、氟达拉滨美法仑预处理和ATG预防排斥反应,结果27例患者无移植失败,急性和慢性GvHD发生率低,3年生存率为88%。虽然患者数量少,但在没有移植后免疫抑制治疗的情况下,这些初步结果仍有意义。
异基因HSCT的成功取决于在不丧失GvL效应的情况下减轻GvHD的能力,这就是为什么移植平台(包括预处理方案、干细胞来源和GvHD预防)均需予以考虑。MF患者年龄较大,应优先考虑针对GvHD的适当保护。
10.急变期和加速期
如果原始细胞比例增加至10%-19%,慢性期 MF 可进展为加速期MF,其生存率降低、AML转化风险增加。对于这类患者,RIC移植显示出与慢性期骨髓纤维化相当的疾病控制。因此,如果有合适供者且患者适合HSCT,那么继续进行HSCT是合理的。对于急变期患者,移植前一般需要给予MF诱导治疗以控制疾病,可选择以HMA为基础的方案,或者如果患者适合强化诱导,则给予强化诱导序贯进行移植。诱导后ORR为39% ~ 59%,HSCT后3年OS为18% ~ 33%。
11. 造血重建和移植物衰竭 (GF)
MF异基因移植后血细胞减少可有三种不同形式,致死性感染的风险增加。第一种是血液系统恢复延迟,但患者最终摆脱输血依赖。第二种可能性是完全供者嵌合,初始粒细胞恢复,但持续依赖红细胞和血小板输注,称为移植物功能不良 (PGF)。第三种也是最令人担忧的情况,即原发性移植物衰竭,患者没有表现出粒细胞恢复的迹象,也没有表现出供者嵌合的迹象。一项关于移植物衰竭的研究发现骨髓纤维化的诊断和替代供者是风险因素:在具有0、1和2个风险因素的患者中,GF的发生率分别为0%、9%和24%。因此对于接受替代供者移植物的 MF 患者,可以预期高达25%的患者会表现出一种或另一种形式的移植后移植物衰竭。
根据供者嵌合的程度不同,治疗方法也不同:在显示混合供者或仅宿主来源细胞的患者中,移植物已完全失败,唯一的解决方案为早期二次移植。在一项二次早期半相合移植物的研究中,74%的患者恢复,4/19例原发性移植失败为MF患者。在一项大型登记研究中,1/3的 MF 患者因移植物衰竭而接受二次移植,因移植物衰竭而接受早期二次移植的 NRM 高达47%。但另一方面,如果存在完全供者嵌合,那么在没有预处理方案的情况下,CD34阳性细胞增强可挽救超过70%的患者。完全供者嵌合患者的另一种选择是给予血小板生成素模拟药物,使用 romiplostin 或艾曲波帕可在超过50%的移植物功能不良患者中诱导三系恢复。
12.HSCT后疾病标志物和嵌合
评价移植后的疾病反应不同于常规治疗,因其目标为根除恶性克隆。驱动突变(JAK2、MPL或CALR)可用于评估异基因 HSCT 后的微小或可测量残留病 (MRD),并可能对应供者嵌合作为另一种标志物;它们可以在外周血或骨髓中测量。预处理方案似乎在确定供者嵌合的程度方面具有相关作用,从而确定MF复发的风险。一项随机研究比较白消安-氟达拉滨方案 (BU-FLU) 与塞替派-氟达拉滨(THIO-FLU)方案,BU-FLU 方案第+100天完全供者嵌合的患者比例为24%,而THIO-FLU为68%;总体累积复发率为 36%(BU-FLU) 和24%(THIO-FLU)。因此,氟达拉滨联合一种烷化剂具有较低程度的完全供者嵌合和较高的复发率。最近一项 BU-FLU 方案的研究证实 MF 患者的混合嵌合率较高 (43%)、复发率较高 (40%)。与之相反,使用两种烷化剂(塞替派-白消安或 BU-FLU-美法仑)具有高度完全供体嵌合(超过90%)和低复发风险 (<20%)。在老年或fragile患者中减少两种烷化剂的剂量很重要:根据经验将白消安的剂量减少到一天,在老年患者中仍可保持良好的根除效果。
因此,监测供者嵌合和驱动突变对评估植入程度和复发风险至关重要。完全供者嵌合和复发强烈依赖于预处理方案的类型,两种烷化剂联合似乎在控制基础疾病方面具有优势,也可能在生存期方面具有优势。
13.复发的治疗
原发疾病的复发是负面事件。在欧洲血液和骨髓移植组 (EBMT) 最近的一项研究中,复发风险在过去二十年中明显下降,可能是由于在移植前更多地使用芦可替尼,移植前给予芦可替尼具有有利作用,尤其是在应答者中。应该区分分子学复发和血液学复发:前者见于再次出现驱动突变的患者,伴或不伴供体嵌合下降,但血细胞计数正常,可能骨髓活检正常;血液学复发的患者分子标志物为阳性,伴血液学异常(白细胞-血小板增多)或血细胞减少,伴或不伴循环原始细胞,脾脏增大,骨髓活检伴纤维化。不幸的是,MF的这些血液学体征在移植后1个月未消失,脾肿大或骨髓纤维化可能持续数月或数年。因此,有必要将分子标志物与血液学体征相结合,以评估患者是否出现分子学或血液学复发。
图1概述了分子学标志物持续或再次出现的MF 患者可以考虑的治疗。

异基因 HSCT 后,患者通常显示驱动突变消失和完全供者嵌合(FDC)(最左侧),然后可进行随访。但部分患者(中心)可能缓慢清除驱动突变,伴或不伴混合供者嵌合 (MDC),如果患者仍在接受免疫抑制治疗 (IST),应停止治疗;如果其导致分子学标志物和 FDC 阴性,患者可接受随访。如果患者已停止 IST 且无慢性GvHD,则可选择去甲基化药物试验或DLI;使用的 HMA 为地西他滨 20 mg/m2持续5天或阿扎胞苷 75 mg/m2 持续5天,每28天一次或根据耐受性,同时每月监测嵌合。如果嵌合改善,则完成6个周期,然后观察。如果发生cGVHD,可根据临床指征重新开始 IST 治疗。对于DLI,初始剂量可能取决于 HLA相合的程度。对于 HAPLO 不相合和无关不相合移植,保守的起始剂量可能为1X105 CD3/kg,对于 HLA 相合亲缘和无关移植,保守的起始剂量可能为1X106 CD3/kg。在无 GvHD 的情况下,应每21-28天递增一次剂量。应每月评估供者嵌合。如果患者再次FDC 且驱动标记为阴性,则应进行随访;如果患者未转换为FDC,可考虑进行清淋(通常为FLU-CY)或清淋加骨髓消融(一剂美法仑),随后再次进行DLI。如果所有这些方法均失败,且患者出现血液学复发,则二次移植是唯一可能的治愈方法。应结合临床状况和患者年龄考虑二次移植的优势。根据供者可用性和供者检索结果,使用的供者可以是相同的,也可以是不同的。
总结
尽管有多种新的 JAKi 可用于治疗骨髓纤维化,但它仍无法治愈,异基因移植仍是唯一的治愈方法。由于部分疾病特异性特征,如脾脏较大、骨髓环境不利伴纤维化、输血负荷(通常显著)和高龄,骨髓纤维化具有其自身的细微差别。由于新的移植策略,HSCT在骨髓纤维化中越来越安全,甚至在老年患者中亦可提供。MF 患者早期考虑 HSCT 是移植成功的关键。
参考文献
Ali H, Bacigalupo A. 2024 update on allogeneic hematopoietic stem cell transplant for myelofibrosis: A review of current data and applications on risk stratification and management. Am J Hematol. 2024;1‐8.doi:10.1002/ajh.27274
作者:聊聊血液
版权声明:
本网站所有注明“来源:梅斯医学”或“来源:MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明“来源:梅斯医学”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言










#骨髓纤维化# #异基因移植#
70