最全综述:可切除非小细胞肺癌围手术期免疫治疗现状和最新进展
2024-11-16 苏州绘真医学 苏州绘真医学
本综述总结了 ICIs 的生物学原理,并全面概述了可切除早期 NSCLC 围手术期 ICIs 相关临床试验。
在过去十年中,肺癌死亡率降低,一个原因是免疫疗法的进展。免疫检查点抑制剂(ICI)改变了晚期非小细胞肺癌(NSCLC)的治疗格局,最近多项临床试验评估了 ICI 用于可切除 NSCLC 患者新辅助、辅助和围手术期治疗的安全性和有效性。美国食品药品监督管理局(FDA)已批准含铂双药化疗之后辅助阿替利珠单抗、新辅助纳武利尤单抗和含铂双药化疗、含铂双药化疗之后辅助帕博利珠单抗,以及新辅助/辅助帕博利珠单抗用于可切除 NSCLC,还有其他药物或适应症也可能即将获批。在短短几年内,新的数据、批准和新兴的研究结果正在极大地改变公认的标准治疗。尽管取得了这些进展,但这些治疗的最佳应用并不完全明确。本文总结了免疫治疗的生物学原理和有关围手术期 ICIs 的重要临床试验。还进一步概述了争议和未来方向,以更好地指导 NSCLC 患者的个体化治疗。
研究背景
肺癌仍然是癌症死亡的主要原因。据估计,2024 年,美国每天将有 340 人死于肺癌,几乎是癌症相关死亡率排名第二的结直肠癌死亡人数的 2.5 倍。非小细胞肺癌(NSCLC)约占所有肺癌的 85%,20-25% 的诊断为 NSCLC 的患者为可切除疾病。然而,手术切除仅提供较小的生存获益。术后铂类化疗在过去二十年中一直是早期 NSCLC 的标准治疗(SOC),但复发和死亡很常见。与单独手术相比,术前或术后化疗仅将 5 年总生存率(OS)提高了约 5%。大约 68% 的 IB 期患者存活 5 年。对于 IIIB 期疾病患者,这一比例下降到 26%,提示存在重大未满足的医疗需求。因此,迫切需要有效的疗法。
随着免疫检查点抑制剂(ICI)的引入,肿瘤治疗的范围扩大了,在多个领域导致快速演变的治疗格局。在过去五年中,ICI 的广泛应用极大地改变了晚期和转移性 NSCLC 的治疗范式。受到成功的鼓舞,探索这些方式在可切除 NSCLC 中的潜力获得大量关注。出现了许多相关的临床试验,显示早期 NSCLC 患者的病理缓解和生存结局有所改善。FDA 基于关键临床试验(包括 IMpower010、CheckMate816、PEARLS/KEYNOTE-091 和 KEYNOTE-671)批准了四种治疗方案,巩固了靶向 PD-1 和 PD-L1 的 ICI 作为早期 NSCLC 患者标准疗法的使用,无论是在新辅助(术前)、辅助(术后)还是新辅助和辅助治疗中给药。ICI 目前已被纳入 NSCLC 围手术期 SOC,目的是治愈策略。这些改变的治疗范式为长期面临挑战的可切除 NSCLC 领域带来了重大突破。
本综述总结了 ICIs 的生物学原理,并全面概述了可切除早期 NSCLC 围手术期 ICIs 相关临床试验。此外,讨论了值得未来研究的当前有争议的问题,例如患者选择标准、新辅助 ICI 后辅助 ICI 的必要性、最佳治疗持续时间和给药间隔、生物标志物的作用以及 OS 的适当替代终点的选择。
免疫治疗的生物学原理
辅助治疗
随着机制证据的积累,手术切除原发肿瘤似乎会破坏宿主的免疫系统,包括先天和适应性免疫系统。手术后持续数天至数周的“免疫抑制窗口”使隐匿性肿瘤得以生长并逃避免疫系统。理想情况下,手术后应给予 ICIs 辅助治疗。这种方法可以抵消术后微环境的免疫抑制作用,增强对肿瘤的免疫反应,靶向手术过程中可能释放到循环系统中的肿瘤细胞,最终消除微小残留病(MRD)。在这种情况下,ICIs 也可以与辅助化疗联合使用。后者破坏肿瘤细胞,从而改变新抗原暴露的模式并增强 ICIs 的抗肿瘤功效。
新辅助治疗
整个肿瘤的存在促进更广泛的 CD8+ T 细胞的激活,术前利用 ICI 可以增强对肿瘤抗原的免疫反应,从而为根除微转移性疾病和消除手术过程中释放到循环系统中的活肿瘤细胞提供了机会。此外,ICIs新辅助治疗可以评估病理缓解情况,可能提示生存获益,并有助于制定未来的治疗方法。与辅助治疗相比,新辅助 ICI 具有更高的治疗启动率和更好的患者依从性的优势。
新辅助免疫治疗
一系列临床研究深入研究了不同的新辅助免疫治疗方案,包括 ICI 单药治疗和 ICI 与化疗、其他免疫调节药物、放化疗或抗血管生成联合治疗。其中,新辅助化疗+免疫疗法已在多项 III 期临床试验中显示出成功。
ICI单药新辅助治疗
CheckMate159 是一项开创性临床研究,旨在评估新辅助 ICI 治疗的安全性和可行性,该研究对 21 例可切除的 I-IIIA 期 NSCLC 患者在手术前给予两个周期的纳武利尤单抗。新辅助纳武利尤单抗未导致手术延迟,从第 2 剂到手术的中位间隔为 18 天。其副作用是可接受的,1 例患者发生 3 级或以上的治疗相关不良事件。主要病理缓解(MPR)(定义为切除的原发性肿瘤中残留活肿瘤细胞占 ≤10%)率为 45%,病理完全缓解(pCR)率为 10%。此外,新辅助纳武利尤单抗的添加通过 CD8 阳性/PD-1 阳性免疫细胞诱导肿瘤浸润。MPR 与肿瘤突变负荷(TMB)较高、肿瘤和外周血之间共同的 T 细胞克隆的频率较高以及 T 细胞群的克隆性较高有关。随访 63 个月后,最终临床结果显示 5 年无复发生存率(RFS)和总生存率(OS)分别为 60% 和 80%,这是迄今为止抗 PD-1 新辅助治疗最长的随访数据。MPR 和治疗前 PD-L1 阳性(TPS ≥ 1%)似乎都与较好的 RFS 相关。随后进行了多项使用抗 PD-1 和抗 PD-L1 抗体作为新辅助单药治疗的 II 期试验。总的来说,这些试验表明,手术前短暂的新辅助 ICI 治疗方案产生的 MPR 率为 14% 至 45%,pCR 率为 7% 至 11%(表 1)。
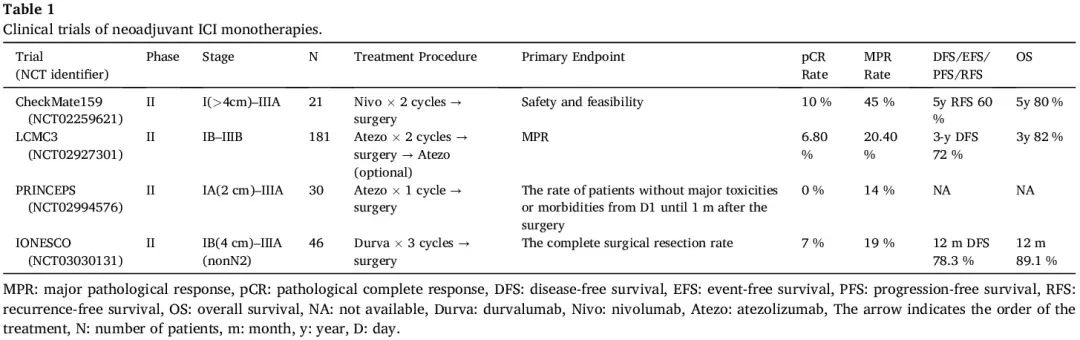
表1
新辅助ICI联合化疗
将 ICI 纳入新辅助治疗来提高化疗疗效非常有前景,特别是考虑到转移性 NSCLC 研究中证实的协同效应。
据我们所知,CheckMate-816 研究是首个 NSCLC 新辅助免疫治疗 III 期研究。共有 358 例可切除 IB-IIIA 期 NSCLC 患者被随机分配接受纳武利尤单抗联合含铂双药化疗或仅含铂双药化疗,治疗三个周期后进行根治性切除。两个共同主要终点均已达到:纳武利尤单抗联合化疗的中位 EFS 为 31.6 个月,而仅化疗为 20.8 个月(HR 0.63,97.38% CI 0.43-0.91;P = 0.005),pCR 率分别为 24.0% 和 2.2%(比值比 13.94,99% CI 3.49-55.75;P < 0.001)。此外,发现 pCR 和 EFS 之间存在很强的相关性。在 IIIA 期疾病vs IB 期或 II 期疾病,PD-L1 ≥ 1% vs. PD-L1 < 1%,以及接受卡铂vs顺铂治疗的患者中观察到纳武利尤单抗的获益较多。两组中 ctDNA 清除的患者似乎都比 ctDNA 未清除的患者实现了更长的 EFS 和更高的 pCR。在新辅助化疗中加入纳武利尤单抗相比单独化疗未导致 3-4 级 TRAE 的发生率更高(33.5% vs 36.9%)或根治性手术取消(15.6% vs 20.7%)。分别有 20.8% 和 17.8% 的患者手术延迟。鉴于这些结局,FDA于2022年3月4日批准纳武利尤单抗联合含铂双药化疗用于可切除NSCLC的新辅助治疗。根据 3 年更新,联合治疗显示出持续的 EFS 优势(中位 NR vs. 21.1 个月;HR 0.68,95% CI 0.49-0.93)和 OS 获益(中位 NR vs. NR;HR 0.62,95% CI 0.36–1.05;P = 0.0124)。在接受手术的患者中观察到纳武利尤单抗组的 EFS 获益较大,无论手术类型或切除范围如何。新辅助纳武利尤单抗联合化疗也为未手术的患者带来更大的临床获益。在更新的 4 年分析中,与单独化疗相比,使用纳武利尤单抗的新辅助化疗+免疫治疗方法继续改善 EFS(中位 43.8 个月 vs. 18.4 个月;HR 0.66,95% CI 0.49–0.90)和 OS(中位 NR vs. NR;HR 0.71,98.36% CI 0.47–1.07;P = 0.0451)。一项对生物标志物的探索性分析显示,高基线4基因(CD8A、CD274、STAT-1、LAG-3)炎症特征评分可能与EFS较优有关(中位NR vs. NR;HR 0.65,95% CI 0.30-1.39),并且纳武利尤单抗组获得 pCR 的可能性更大。而在化疗组中,高分 vs 低分患者未达到 EFS 的统计学显著性。另一项对 CheckMate 816 的分析显示,与仅新辅助化疗相比,新辅助纳武利尤单抗+伊匹木单抗具有潜在的临床益处和可控的安全性。此外,在几项 II 期试验中(包括 LungMate 002、TD-FOREKNOW 和 neoSCORE),新辅助化疗+免疫疗法实现了更高的病理缓解率和长期生存率(表 2)。目前,缺乏关于新辅助免疫治疗vs免疫联合化疗有效性的头对头比较。CTONG1804 试验基于 PD-L1 表达评估了新辅助纳武利尤单抗单药治疗和纳武利尤单抗联合化疗在可切除临床 IIA-IIIB 期 SCLC 中的临床疗效,MPR 为 50.0%(26/52),pCR 为 25.0%(13/52)。即使在 PD-L1 表达 ≥50% 的患者中,新辅助纳武利尤单抗的 MPR 率也显著低于纳武利尤单抗联合化疗(16.7% vs. 66.7%)。几项研究显示,单独免疫疗法治疗 PD-L1 水平 ≥50% 的晚期 NSCLC 患者具有良好的疗效,而与化疗联合并不能提高疗效,反而会导致毒性增加,该结论似乎不适用于该试验的早期新辅助治疗。
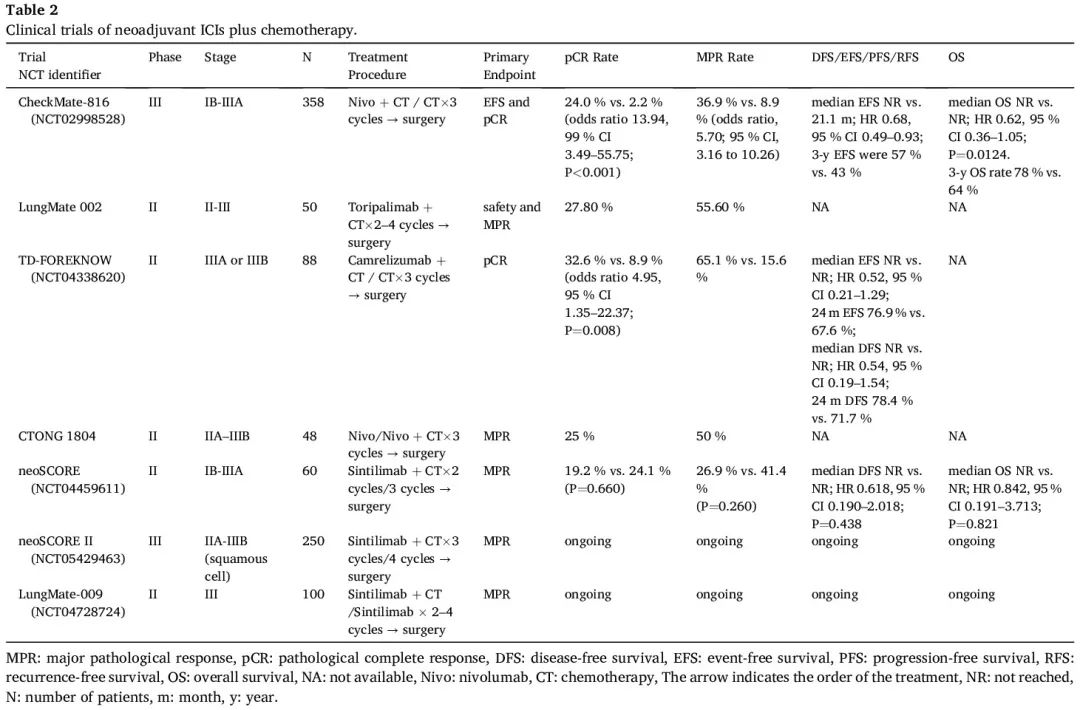
表2
新辅助ICI联合其他疗法
ICIs 联合各种治疗方式是研究的重点,因为有可能促进肿瘤微环境中免疫细胞的浸润。一系列早期研究探索了PD-(L)1抑制剂和靶向其他免疫检查点的新型ICI药物在新辅助治疗中的应用,包括联合伊匹木单抗(抗CTLA-4抗体)、relatlimab(抗LAG-3抗体)、oleclumab(抗CD73抗体)、monalizumab(抗NKG2A抗体)或 danvatirsen(抗STAT3抗体)(表3)。其中一些方案显示出协同治疗效果,联合治疗组的患者具有更高的 MPR 率和相似的安全性。然而,后续还需要在大规模研究中进行验证。评估新辅助 ICIs 加放化疗策略的几项试验也公布了积极的结局。SACTION-01 试验和 SAKK 16/18 研究显示了该方法的可行性和安全性(表 4)。据报道,血管生成抑制剂会改变肿瘤免疫。在ICI中加入血管生成抑制剂的有效性和安全性已在两项针对可切除NSCLC的单臂II期临床试验中得到证实。
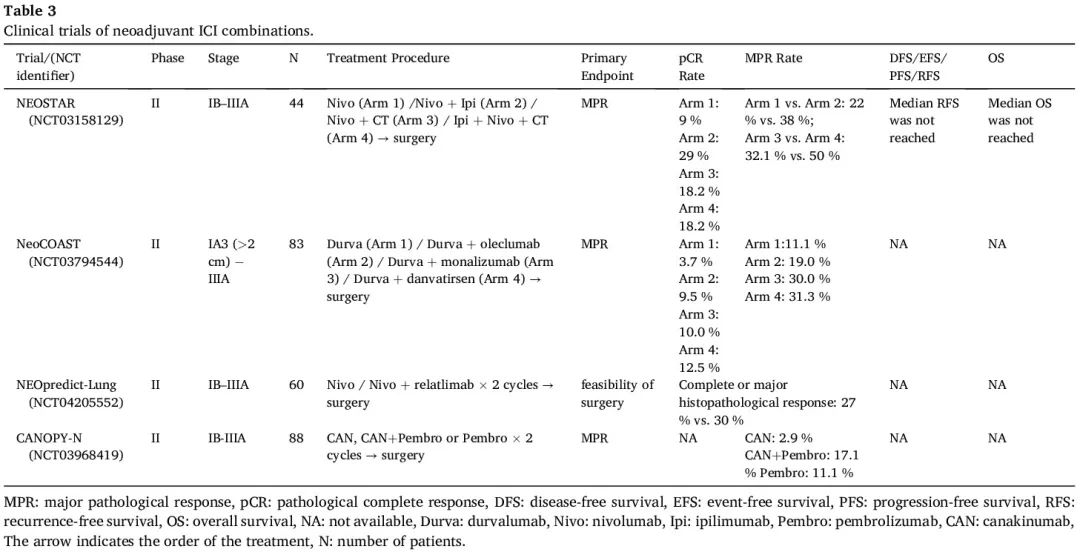
表3

表4
辅助免疫治疗
据我们所知,在探索辅助 ICI 用于手术完全切除的 IB-IIIA 期 NSCLC 的 III 期研究中,IMpower010 是首个发表数据的研究。辅助铂类化疗是必要的。之后,1005 例患者被随机分配接受辅助阿替利珠单抗或最佳支持治疗(BSC)。在 PD-L1 表达 ≥1% 的 II-IIIA 期人群亚组(中位 NE vs. 35.3 个月;HR 0.66,95% CI 0.50–0.88;P = 0.0039)和所有 II-IIIA 期患者(中位 42.3 vs. 35.3 个月;HR 0.79,95% CI 0.64–0.96;P = 0.020)中,与 BSC 相比,辅助阿替利珠单抗显著改善了主要终点 DFS。然而,在意向治疗(ITT)人群(IB-IIIA 期)中,DFS 的风险比(HR)为 0.81,未超过统计学显著性阈值。在一项探索性分析中,与PD-L1表达为1-49%的患者(HR 0.87,95% CI 0.60-1.26)相比,在PD-L1表达≥50%的患者(HR 0.43,95% CI 0.27–0.68)中观察到阿替利珠单抗的DFS获益,提示在PD-L1阳性个体中观察到的优势可能主要源于PD-L1高表达的患者。目前没有出现新的安全信号。基于积极结果,FDA 于 2021 年 10 月批准了阿替利珠单抗辅助治疗用于 PD-L1 阳性 II-IIIA 期 NSCLC 患者切除术和铂类化疗之后。欧盟委员会将其批准限制在 PD-L1 表达 ≥50% 的患者。最初的预先设定的中期分析显示,阿替利珠单抗在PD-L1表达 ≥1% 的II-IIIA期亚组中显示出OS较好的趋势(HR 0.71,95% CI 0.49-1.03),主要影响源于PD-L1表达≥50%的II-IIIA期亚组(HR 0.43,95% CI 0.24-0.78)。而 ITT 人群的 OS 仍然不成熟。事后分析表明,各亚组的DFS保持一致,阿替利珠单抗较优,无论KRAS状态和肿瘤突变负荷(TMB)如何。在 mKRAS II-IIIA 期人群中,阿替利珠单抗的 DFS 获益与 PD-L1 状态无关。虽然基线 TMB 似乎具有预后意义,但根据该分析的 DFS,它不能预测阿替利珠单抗的治疗效果。RNAseq 数据显示,在 TGFβ CAF 高人群中,阿替利珠单抗治疗的 DFS 优于 BSC,无论组织学或 PD-L1 表达水平如何。在 TGFβ CAF 高和低人群中,DFS HR(95% CI)分别为 0.54(0.37, 0.80)和 0.94(0.63, 1.41),提示富含 TGFβ CAF 基因特征的患者从阿替利珠单抗治疗中获得更大的临床益处。根据最近的研究结果,在亚洲人群中,对于 PD-L1 TC ≥1% 的 II-IIIA 期患者,阿替利珠单抗有优于 BSC 的趋势(HR 0.73,95% CI 0.28 –88),这与全球人群的结果一致。
KEYNOTE-091 是一项 III 期试验,评估了在接受完全切除的 IB-IIIA 期患者中使用帕博利珠单抗辅助治疗。辅助化疗是允许的,但不是必要的,IB 期疾病考虑,II 期和 IIIA 期疾病强烈推荐。符合条件的参与者接受帕博利珠单抗或安慰剂。35.6 个月时的中期分析显示了双重主要终点。在总人群中,帕博利珠单抗辅助治疗的 DFS 优于安慰剂(53.6 个月vs 42.0 个月;HR 0.76,95% CI 0.63–0.91;P = 0.0014)。然而,与 IMpower 010 试验不同,在 PD-L1 TPS ≥ 50% 的人群中没有观察到显著性(HR 0.82,95% CI 0.57-1.18;P = 0.14)。根据亚组分析,帕博利珠单抗对当前吸烟者、EGFR 突变患者和非鳞状组织学患者具有更大的益处。辅助化疗患者(HR 0.73,95% CI 0.60-0.89)比非辅助化疗患者(HR 1.25 ,95% CI 0.76-2.05)具有更高的 DFS 获益。接受帕博利珠单抗和安慰剂的患者发生 3 级或更严重的不良事件,发生率分别为 34% 和 26%。根据主要疗效结局指标,FDA于2023年1月26日批准帕博利珠单抗用于IB-IIIA期NSCLC切除术和铂类化疗后的辅助治疗,无论PD-L1表达如何。在接受辅助化疗的亚组中,受周期数和所用具体方案的影响,DFS HR 不同。值得注意的是,接受 3 至 4 个周期辅助化疗的患者显示出更大和更一致的获益(HR 0.74,95% CI 0.61-0.91),接受卡铂加长春瑞滨治疗的患者也是如此(HR 0.51,95% CI 0.31-0.83)。在最终的 DFS 分析中,在 ITT 人群中帕博利珠单抗辅助治疗显示出优于安慰剂的持续改善(HR 0.81,95% CI 0.68-0.96),PD-L1 TPS ≥50% 的人群没有显著改善(HR 0.83,95% CI 0.59-1.16;P = 0.13)。另外,帕博利珠单抗辅助治疗的安全性是可控的。
鉴于CANTOS探索性分析显示与canakinumab相关的NSCLC发病率和死亡率显著降低,III期CANOPY-A研究旨在进一步探索canakinumab对II-IIIB期NSCLC辅助化疗后的疗效。然而,未显示统计学显著的 DFS。在 III 期ADJUVANT BR.31 试验中,在完全切除肿瘤的 PD-L1 表达 ≥ 25% 的早期 NSCLC 患者中,与安慰剂相比,度伐利尤单抗在主要终点 DFS 方面未达到统计学意义。截至撰写日期,一些临床试验探索了使用双重 ICI 作为 NSCLC 的辅助治疗。QL1706 是一种新型双功能抗体,由抗 CTLA-4 IgG1 和抗 PD-1 IgG4 抗体组成,目前正在 DUBHE-L-304 试验中评估。这项 III 期研究纳入了 632 例接受手术切除的 II-IIIB 期 NSCLC 患者,旨在评估辅助 QL1706 联合化疗的疗效和安全性。该试验的主要终点:PD-L1 TPS ≥ 1% 的人群和所有随机人群的DFS备受期待。对辅助免疫治疗进行了广泛的研究,包括探索联合疗法疗效的研究,例如 INTerpath-002 试验评估辅助 V940(mRNA-4157)加帕博利珠单抗和 SKYSCRAPER-15 试验评估 tiragolumab 加阿替利珠单抗(表 5)。
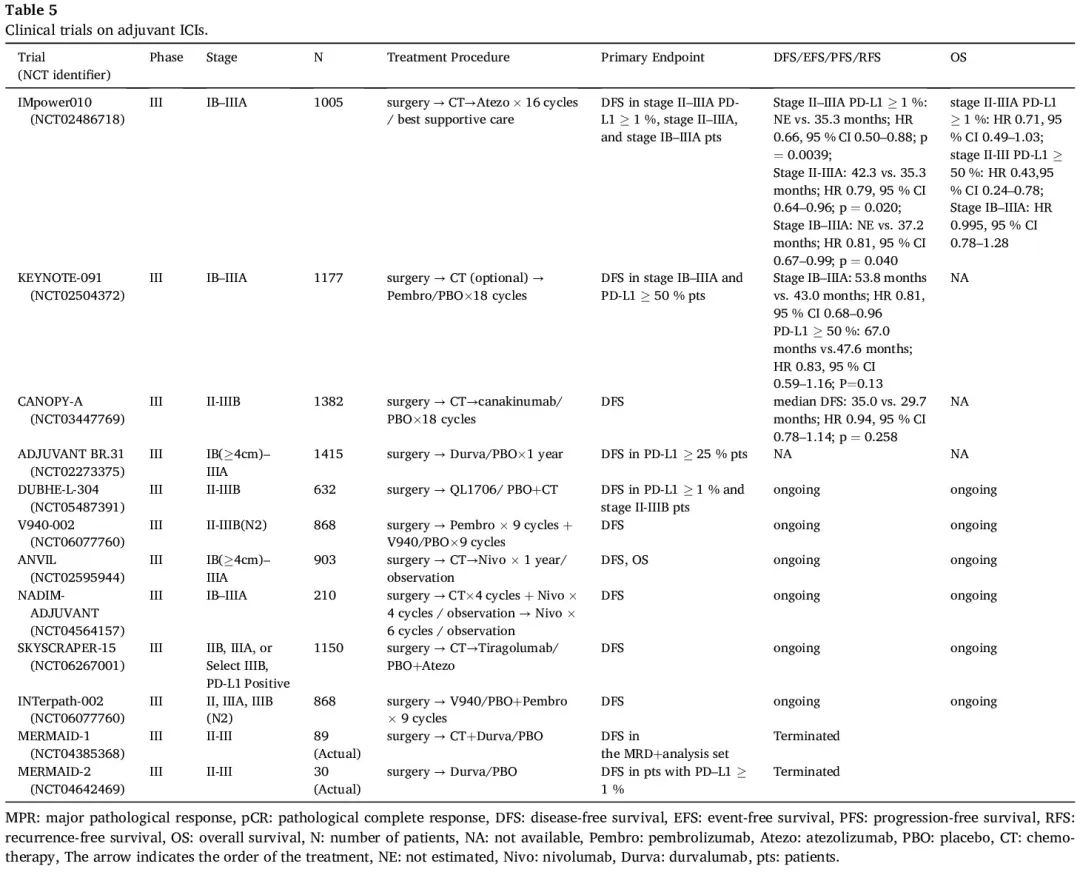
表5
围手术期免疫治疗(新辅助+辅助免疫治疗)
围手术期免疫治疗涉及术前和术后 ICI 给药。这种策略的前景很有趣,因为它有可能促进更强大的免疫反应并消除微转移性疾病,最终降低复发率。多项临床试验探索提高治愈效果的潜在新方法,将 ICI 同时纳入新辅助和辅助治疗,这些试验占正在进行的大型随机对照试验的大部分(表 6)。
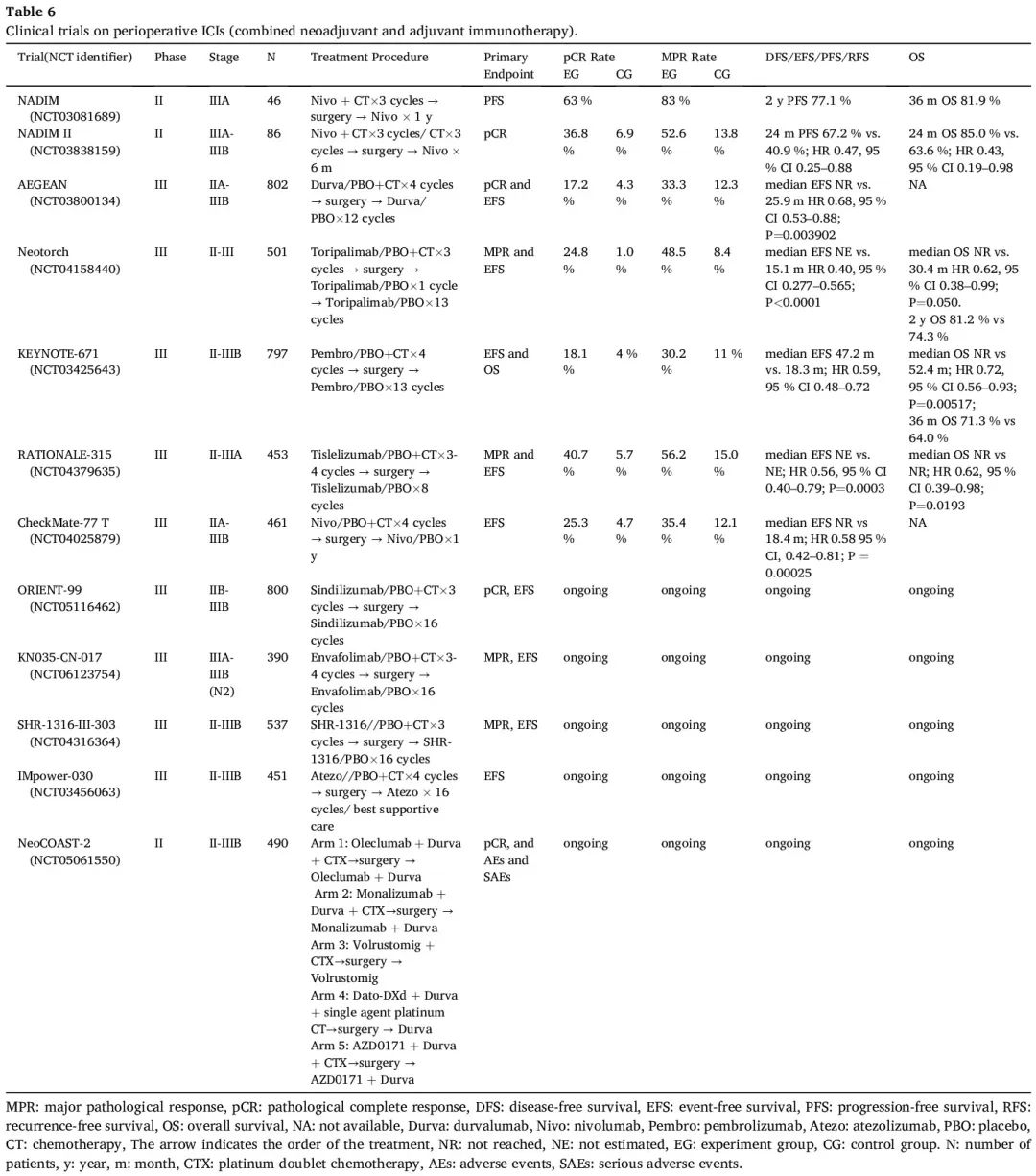
表6
单臂 NADIM 试验纳入了 46 例可切除的 IIIA 期 NSCLC 患者,进行 3 个周期的新辅助紫杉醇-卡铂加纳武利尤单抗治疗,随后进行手术,然后提供最长达 1 年的纳武利尤单抗单药辅助治疗。41/46 例患者接受了手术。观察到 MPR 率为 83%,pCR 率为 63%,令人印象深刻。主要终点 2 年无进展生存率(PFS)为 77.1%。TMB 和 PD-L1 状态均不能预测生存。治疗前低水平 ctDNA 与较长的 PFS 和 OS 显著相关。根据更新的报告,在根据方案的人群中,42 个月时的 DFS 和 OS 率分别为 81.1% 和 87.3%。
基于这些有希望的结果,启动了 II 期 NADIM II 试验,在 86 例可切除的 IIIA 期或 IIIB 期 NSCLC 患者(35%为多站N2)中,比较了术前进行新辅助纳武利尤单抗联合铂类化疗,之后 R0 切除患者进行 6 个月的纳武利尤单抗辅助治疗。联合方法的 pCR 率(36.8% vs 6.9%)和 MPR 率(52.6% vs 13.8%)显著较高,同时 3 级或 4 级不良事件的发生率没有显著较高。纳武利尤单抗提高了手术率(93% vs. 69%)以及 R0 切除率(92.5% vs. 65.0%)。此外,该试验还表明,联合治疗提高了 24 个月 PFS 率(67.2% vs. 40.9%;HR 0.47,95% CI 0.25-0.88)和 24 个月 OS 率(85.0% vs. 63.6%;HR 0.43,95% CI 0.19-0.98)。PD-L1 TPS ≥ 1% 的患者比 PD-L1 TPS<1% 的患者表现出更大的获益。在 PD-L1 TPS 为 1%-49% 和 ≥ 50% 的患者中,pCR 率分别为 41.7% 和 61.1%。相反,PD-L1 TPS <1% 的患者的 pCR 率为 15%。随访 2 年时,达到 pCR 的患者均未复发或死亡。
III 期 AEGEAN 试验入组了 802 例可切除的 IIA-IIIB 期(N2)NSCLC 患者,术前随机分配接受 4 个周期的新辅助度伐利尤单抗或安慰剂联合铂类化疗,每 3 周一次,随后接受 12 个周期的辅助度伐利尤单抗或安慰剂治疗,每 4 周一次。初步中期分析显示,达到了两个共同主要终点:度伐利尤单抗联合化疗组的 pCR 率为 17.2%,单独化疗组为 4.3%(P = 0.000036),中位 EFS 分别为未达到与 25.9 个月(HR 0.68,95% CI 0.53-0.88;P = 0.003902)。与安慰剂组相比,度伐利尤单抗组的 MPR 率更高(33.3% vs. 12.3,P = 0.000002)。度伐利尤单抗组和安慰剂组中接受手术的患者比例相似(80.6% vs 80.7%)。新辅助化疗结合围手术期度伐利尤单抗不会对手术的可行性、类型、范围或时间产生消极影响,并导致更高的 R0 切除率(94.7% vs. 91.3%)且手术安全性可控。在两组中手术相关任何级别不良事件(AE)的发生率相似。探索性分析显示,在EGFR突变的可切除NSCLC患者中,度伐利尤单抗组相比与安慰剂组没有显著的临床获益。最新研究报告,新辅助治疗期间 ctDNA 变异等位基因分数水平降低与 pCR 或 MPR 有关。度伐利尤单抗组从第 2 周期第 1 天开始,安慰剂组从第 3 周期第 1 天开始,表现出 ctDNA 清除的患者往往具有较低比例的残留活肿瘤。在基线 III 期 N2 疾病患者中,与单独新辅助化疗相比,围手术期度伐利尤单抗联合化疗显著延长了 EFS(HR 0.63,95% CI 0.43-0.90),并提高了 pCR 率(16.6% vs 4.9%;差异 11.7%,95% CI 5.6-18.4),类似于在 mITT 人群中观察到的结果。在单站和多站 N2 患者之间度伐利尤单抗组与安慰剂组的 EFS 获益相似(HR 0.61 和 0.69)。围手术期度伐利尤单抗结合新辅助化疗可能成为 N2 可切除 NSCLC 患者的潜在新治疗选择。
III期NEOTORCH试验以1:1的比例分配II期或III期可切除NSCLC患者,每3周接受一次特瑞普利单抗或安慰剂联合铂类化疗,术前3个周期,术后1个周期,再接受最多13个周期的特瑞普利单抗或安慰剂辅助治疗,每3周一次。主要结局是 EFS 和 MPR 率。该中期分析纳入了 501 例随机患者中的 404 例 III 期 NSCLC 患者。特瑞普利单抗组的手术率为 82.2%,安慰剂组为 73.3%。与安慰剂相比,特瑞普利单抗显著改善了 EFS(中位 NE vs. 15.1 个月;HR 0.40,95% CI 0.277–0.565;P<0.0001)。特瑞普利单抗的 EFS 较优,无论组织学(非鳞和鳞癌分别为 HR 0.54(95% CI 0.27-1.09)和 HR 0.35(95% CI 0.24-0.53))或 PD-L1 表达(PD-L1 表达 < 1%、1–49% 和 ≥ 50% 分别为HR 0.59(95% CI 0.33-1.03)、HR 0.31(95% CI 0.18-0.55)和 HR 0.31(95% CI 0.15-0.62))如何。特瑞普利单抗相比安慰剂改善了 MPR(48.5% vs 8.4%;P<0.0001))和 pCR(24.8% vs 1.0%;P<0.0001)。在特瑞普利单抗组中观察到 OS 改善的趋势(中位 NR vs. 30.4 个月;HR 0.62,95% CI 0.38–0.99;P = 0.050)。2 年 OS 率分别为 81.2% 和 74.3%。无论采用何种治疗方案,达到 MPR 或 pCR 的患者都与显著的 EFS 获益相关,进一步为将病理缓解视为 EFS 的替代结局提供了额外的证据。安全性与先前的研究结果一致。与安慰剂组相比,特瑞普利单抗组因不良事件(AE)停药的发生率相似(9.4% vs 7.4%),导致死亡的 AE 的发生率也相似(3.0% vs 2.0%),提示特瑞普利单抗联合化疗的安全性可控。此外,新辅助治疗后,与安慰剂组相比,特瑞普利单抗组接受根治性手术的患者比例更高(82.2% vs 73.3%)。
III期KEYNOTE-671试验纳入了797例可切除的II-IIIB期(N2期)NSCLC患者,进行了4个周期的新辅助帕博利珠单抗或安慰剂联合以顺铂为基础的化疗,每3周一次,然后进行手术,然后是13个周期的单药帕博利珠单抗或安慰剂,每3周一次。双重主要终点是 EFS 和 OS。第一次中期分析中显示,帕博利珠单抗组的中位 EFS 较优(NR vs. 17.0 个月;HR 0.58,95% CI 0.46–0.72;P<0.001)。无论疾病分期、组织学或 PD-L1 表达如何,获益都是一致的。此外,与安慰剂组相比,帕博利珠单抗组表现出更高的 MPR 率(30.2% vs. 11%;P<0.0001)和 pCR率(18.1% vs. 4%;P<0.0001),两者都与更好的 EFS 相关。随访 36.6 个月。254 例患者(31.9%)死亡,达到另一个主要终点 OS(中位 NR vs 52.4 个月;HR 0.72,95% CI 0.56-0.93;P = 0.00517)。36 个月 OS 率分别为 71.3% 和 64.0%。帕博利珠单抗组表现出持续的 EFS 改善(中位 47.2 个月 vs. 18.3 个月;HR 0.59,95% CI 0.48-0.72)。帕博利珠单抗组的相对优势随着 PD-L1 表达水平的升高变得更加明显(疾病进展、疾病复发或死亡的 HR 分别为:PD-L1 TPS ≥ 50% 时为 0.42%,PD-L1 TPS 1-49% 时为 0.51%,PD-L1 TPS <1% 时为 0.77)。基于KEYNOTE-671,帕博利珠单抗于2023年10月16日获得FDA批准与含铂化疗联合作为可切除NSCLC的新辅助治疗,以及单药作为术后辅助治疗。最近的研究表明,接受帕博利珠单抗治疗的患者在术前和术后都可以保留健康相关生活质量(HRQoL),进一步支持围手术期帕博利珠单抗联合化疗方案作为新的 SOC。
RATIONALE-315 研究是一项 III 期临床试验,旨在探索围手术期替雷利珠单抗联合化疗治疗中国可切除 II-IIIA 期 NSCLC 患者的疗效和安全性。453 例符合条件的患者被纳入研究,术前接受 3-4 个周期的替雷利珠单抗(200 mg)或安慰剂(每 3 周静脉注射一次)联合含铂双药化疗,然后术后接受最多 8 个周期的替雷利珠单抗(400 mg)或安慰剂(每 6 周静脉注射一次)辅助治疗。与单独化疗相比,在化疗中加入替雷利珠单抗导致 pCR 率(40.7% vs. 5.7%;比值比 11.5,95% CI,6.2-21.5)和 MPR 率(56.2% vs. 15.0%;比值比 7.5,95% CI,4.8-11.8)显著提高(P<0.0001)。亚组分析显示,患者显著获益于替雷利珠单抗联合化疗,无论 PD-L1 表达水平或组织学类型如何。在这项中期分析中,替雷利珠单抗组的 EFS 优势达到了统计学上的显著差异(中位 NR vs. NR;HR 0.56,95% CI 0.40–0.79;P = 0.0003)。替雷利珠单抗组的 OS 呈明显较好趋势,尽管 OS 数据不成熟(HR 0.62,95% CI 0.39-0.98;P = 0.0193)。在最新的手术结果分析中,替雷利珠单抗组84.1%的患者和安慰剂组 76.2%的患者接受了根治性手术,R0 切除率分别为 95.3% 和 93.1%。此外,两组术后任何级别 AE 和 ≥ 3 级并发症的发生率分别为 63.7% vs 61.3% 和 11.1% vs 15.6%,相应的术后 90 天死亡率分别为 1.3% vs 1.8%。公布的数据表明,围手术期替雷利珠单抗联合新辅助化疗不会影响 NSCLC 患者手术的可行性和完整性,安全性可控。
最后,在 CheckMate-77 T 试验中,461 例 IIA-IIIB 期 NSCLC 患者被随机分配接受纳武利尤单抗或安慰剂新辅助治疗,每 3 周一次,均联合化疗,持续 4 个周期,然后进行纳武利尤单抗或安慰剂辅助治疗,每 4 周一次,持续一年。值得注意的是,纳武利尤单抗组 78%的患者和安慰剂组 77% 的患者进行了根治性手术,R0 切除率分别为 89% 和 90%。两组之间新辅助治疗和辅助治疗的完成率相似。纳武利尤单抗组 3-4 级 TRAE 的发生率为 32%,安慰剂组为 25%,两组 3-4 级手术相关 AE 的发生率均为 12%。纳武利尤单抗改善了 EFS(中位 NR vs 18.4 个月;HR 0.58 95% CI,0.42–0.81;P = 0.00025)。关于 EFS 获益,III 期疾病患者(HR 0.51,95% CI,0.36-0.72)大于 II 期疾病患者(HR 0.81,95% CI,0.46-1.43),PD-L1 表达 ≥1% 的患者(HR 0.52,95% CI,0.35-0.78)大于 PD-L1 表达 <1% 的患者(HR 0.73,95% CI 0.47-1.15),达到 pCR 的患者(HR 0.22,95% CI 0.04-1.08)大于未达到 pCR 的患者,接受辅助治疗的患者大于未接受辅助治疗的患者(HR 0.63,95% CI 0.40-0.99)。纳武利尤单抗组的MPR(35.4% vs 12.1%;OR 4.01)和 pCR(25.3% vs 4.7%;OR 6.64)高于安慰剂。探索性分析显示,MPR 和 pCR 与更好的 EFS 相关。更新的探索性分析显示,围手术期纳武利尤单抗治疗为可切除的NSCLC带来临床获益,无论新辅助治疗周期如何,在新辅助治疗少于 4 个周期的患者中 pCR(18.4% vs. 0%)、MPR(21.1% vs. 0%)和EFS(中位NR vs 7.8;HR 0.51,95% CI 0.23-1.11)改善,在接受 4 个周期治疗的患者中 pCR(26.7% vs 5.4%)、MPR(38.2% vs 13.7%)和 EFS(中位 NR vs 19.8;HR 0.57,95% CI 0.42-0.79)也改善。纳武利尤单抗的 TTDM 较优,无论 pCR 状态(达到 pCR 患者和未达到 pCR 患者的 HR 分别为 0.39(95% CI 0.07-2.12)和 0.81(95% CI 0.58-1.13]))、MPR 状态(达到 MPR 患者和未达到 MPR 患者的 HR 分别为 0.44(95% CI 0.15-1.26)和 0.88(95% CI 0.62-1.24))或完成新辅助治疗的周期(新辅助治疗 4 个周期和少于 4 个周期患者的 HR 分别为 0.61(95% CI 0.42-0.88)和 0.46(95% CI 0.22-0.98))如何。一项更新的探索性分析基于淋巴结状态评估了可切除 III 期 NSCLC 的临床结局,在 N2 和非 N2 疾病患者中(HR 0.46 和 0.60),纳武利尤单抗组的 EFS 长于安慰剂组。纳武利尤单抗组中 N2 和非 N2 疾病患者的 R0 切除率相似(86% vs. 84%)。手术后,67% 的 N2 疾病患者实现了淋巴结降期,其中 57% 的患者降期至 ypN0。N2 疾病患者的 pCR 率为 29%,多站 N2 疾病患者的 pCR 率为 38%。总之,这些积极结果进一步支持围手术期纳武利尤单抗联合化疗作为可切除 NSCLC 的潜在新治疗方法,包括预后不良的患者,如 III N2期。
此外,几项正在进行的 III 期研究正在评估其他 ICI 联合化疗作为围手术期治疗的安全性和有效性。值得注意的是,II 期 NeoCOAST-2 研究探索了双重 ICI 联合化疗提高生存率的潜力。鉴于可切除 NSCLC 免疫疗法的快速发展,来自已发表临床研究的更可靠数据以及正在进行的研究结果备受期待,将提供更全面的围手术期 ICIs 疗效信息。
争议和未来方向
患者选择标准
关于 NSCLC 新辅助免疫治疗的候选标准的争论仍然存在,尤其是对于处于可切除边缘的 III 期患者。新辅助 ICI 导致的临床降期使许多患者符合手术条件,对手术可行性的定义提出了挑战。值得注意的是,在CheckMate 816(HR 0.54 vs. 0.87)和 CheckMate 77 T(HR 0.51 vs. 0.81)中,III期疾病患者的EFS优于 II 期。而KEYNOTE-671、AEGEAN 和 RATIONALE-315 研究的亚组分析显示,II 期和 III 期患者的 EFS 相似或不相关。总之,临床分期与 EFS 的相关性尚不清楚。在这些 III 期试验中,新辅助 ICIs 的病理缓解和 EFS 获益在腺癌和鳞状细胞 NSCLC 之间有所不同,提示需要进一步研究来确定潜在的关联。
最佳治疗方案
新辅助+辅助vs仅新辅助ICI
将 ICI 加入铂类化疗作为新辅助治疗改善了可切除 NSCLC 患者的病理缓解和生存率。关于在切除前后均给予 PD-1 抑制剂是否比仅在手术前给予产生更好的结果,仍然存在争议。与 CheckMate-816 中仅新辅助纳武利尤单抗相比,CheckMate-77 T 中新辅助+辅助纳武利尤单抗的复发风险进一步降低(HR 0.58 vs. 0.68)。CheckMate-77 T 的亚组分析表明,与未接受纳武利尤单抗辅助治疗的患者相比,接受纳武利尤单抗辅助治疗的患者在 EFS 获益方面呈更有利的趋势(HR 0.45 vs. 0.55)。此外,在 LCMC3 中,接受新辅助阿替利珠单抗治疗的患者 DFS 延长,OS表现出延长的趋势。此外,新辅助免疫治疗后达到 pCR 的患者是否应该接受辅助免疫治疗仍是一个持续争论的话题。CheckMate 816 显示,pCR 组的 3 年 EFS 率约为 75%。术后复发风险的存在表明,原发病灶达到 pCR 可能不等于根除远处微转移。在 CheckMate 77T 中观察到 pCR 患者的 EFS 获益更大。在临床实践中,病理缓解评估的标准化和正常化因地区和医院而异,由于病理评估不充分,可能导致对 pCR/MPR 结果的高估。然而,一项间接的荟萃分析显示,与单独新辅助 ICI 相比,在新辅助ICI的基础上加入辅助ICI并未产生更好的EFS(HR 0.90,95% CI 0.63-1.30;P = 0.59)或 OS(HR 1.18,95% CI 0.73-1.90;P = 0.51),但显著增加了任何等级的 TRAEs 的发生率(RR 1.08,95% CI 1.00-1.17;P = 0.04)。未来进行头对头随机试验来探索这些发现至关重要。
最佳治疗持续时间和给药间隔
能够实现最佳获益的必要治疗持续时间和给药间隔仍不清楚。晚期 NSCLC 结果表明,对 ICI 联合化疗产生反应的中位时间约为 2 个月(相当于大约 3 个周期,每周期为 21 天)。此外,免疫治疗后达到客观缓解的晚期 NSCLC 患者可能在 3-4 个周期内出现外周血中 PD-1 + CD8 + T 细胞增殖,提示 3-4 个周期的新辅助 ICI 可能会使免疫治疗效果最大化。在目前的 III 期试验中,新辅助 ICI 联合化疗在术前给药 3-4 个周期,术后不再进行化疗(表 7),例如 CheckMate-816、KEYNOTE-671、RATIONNALE-315、CheckMate 77 T 和 AEGEAN。Neotorch 采用 4 个周期的 ICI 联合化疗,术前 3 个周期,术后 1 个周期。这些研究一致表明,通过 3-4 个周期的新辅助 ICI 和化疗,可以在不影响手术的情况下实现显著的 pCR/MPR 率和 EFS 获益。PACIFIC 研究的结果将度伐利尤单抗强化治疗最长 1 年作为放化疗后未出现疾病进展的不可切除 III 期 NSCLC 患者的国际标准。因此,大多数关于可切除早期NSCLC围手术期免疫治疗的试验采用了一年期辅助ICI治疗方案。而 KEYNOTE-671 和 Neotorch 研究采用了新辅助+辅助 ICI 治疗的最长持续时间为一年。在 NADIM II 试验中,患者接受为期 6 个月的纳武利尤单抗辅助治疗。关于辅助免疫治疗的最佳持续时间仍然存在相当大的争议,有待长期生存数据的公布和进一步的头对头研究。值得一提的是,AEGEAN 和 CheckMate-77T 研究探索了辅助治疗 Q4W(每 4 周一次)给药方案。在 RATIONALE-315 中,特瑞普利单抗在术后给药,400 mg,每 6 周一次,持续 8 个周期。这些方法延长了给药间隔,不影响安全性和有效性,从而提高了患者在持续治疗期间的依从性和生活质量。此外,这些策略为临床管理和长期随访提供了便利,展示了临床创新的价值。此外,III 期 INTerpath-002 研究正在探索辅助治疗 400 mg Q6W 给药方案的可行性。
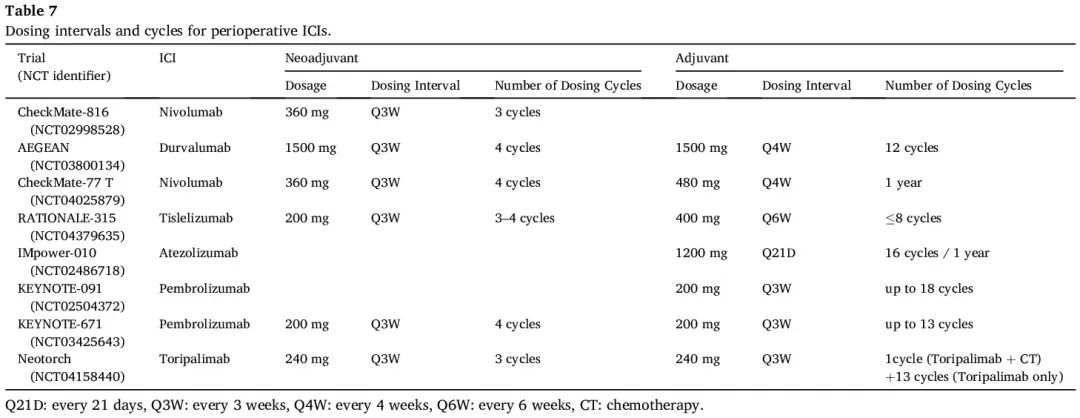
表7
生物标志物
肿瘤细胞相关生物标志物
PD-L1 肿瘤细胞阳性比例分数(TPS)可以作为围手术期免疫治疗疗效的预测性生物标志物,正如许多试验报告的那样,包括 AEGEAN、NADIM II、NEOTORCH、KEYNOTE-671 和 CheckMate 77T 研究(表 8)。在 CheckMate 816 研究中也观察到了类似的结果。然而,当用于辅助免疫治疗时,IMpower 010 试验表明,PD-L1 表达与辅助 ICI 治疗更大的 DFS 获益存在相关性,而在 KEYNOTE-091 研究中没有观察到相关性,可能是由于对照组的非凡表现,这也提示 PD-L1 作为疗效预测因子仍然不稳定, 正在等待正在进行的 III 期辅助试验的进一步证据,例如 ANVIL 和 ADJUVANT BR.31,以获得更多信息。CheckMate-159 研究揭示了 TMB 和 MPR 呈正相关,这种相关性在 LCMC3 研究中也观察到。然而,TMB 未表现出对阿替利珠单抗辅助治疗(IMpower010)或新辅助化疗+免疫治疗(CheckMate816 和 NADIM II)反应的预测能力。TMB 在预测围手术期免疫治疗疗效方面的潜在价值值得进一步探索(表 8)。
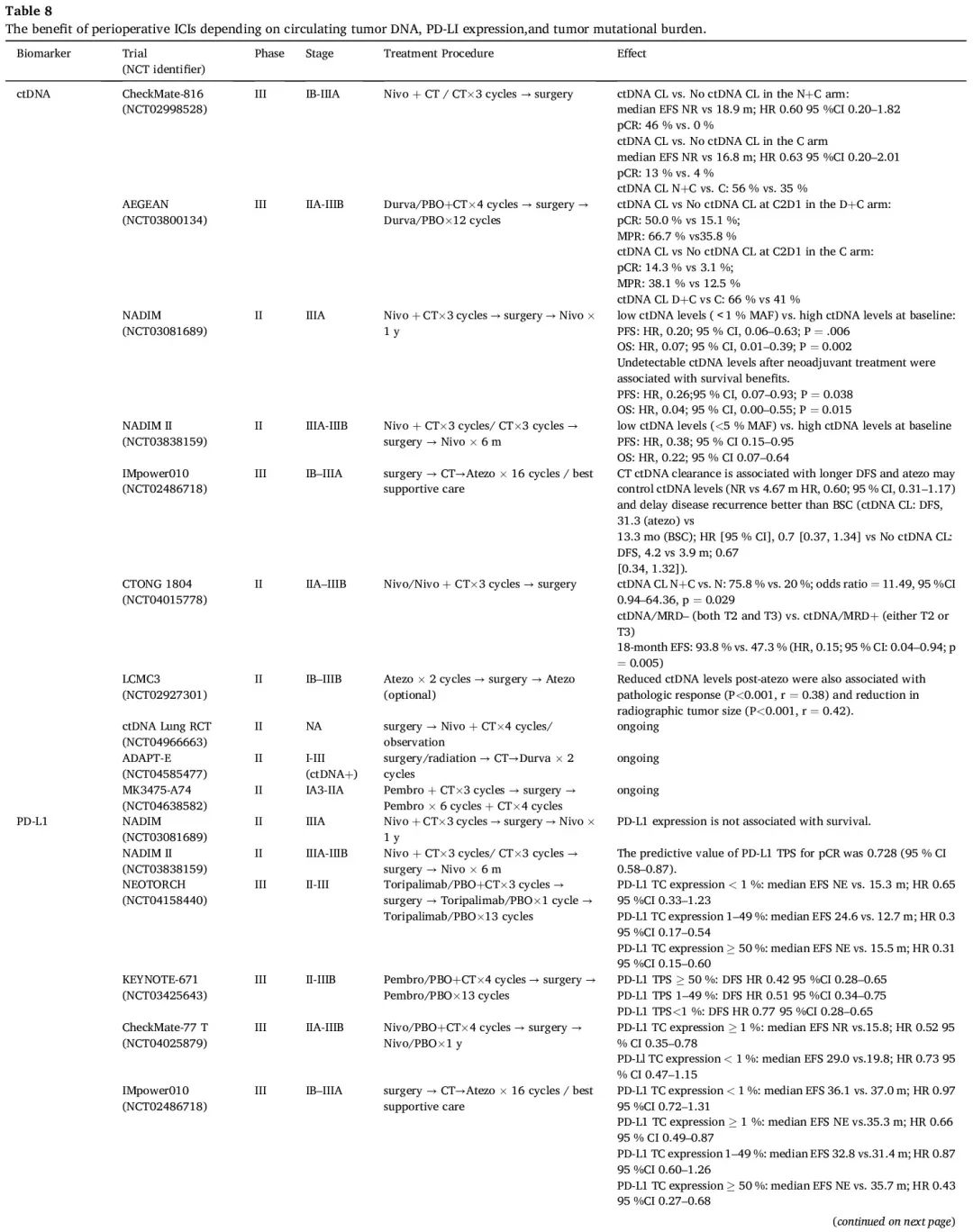
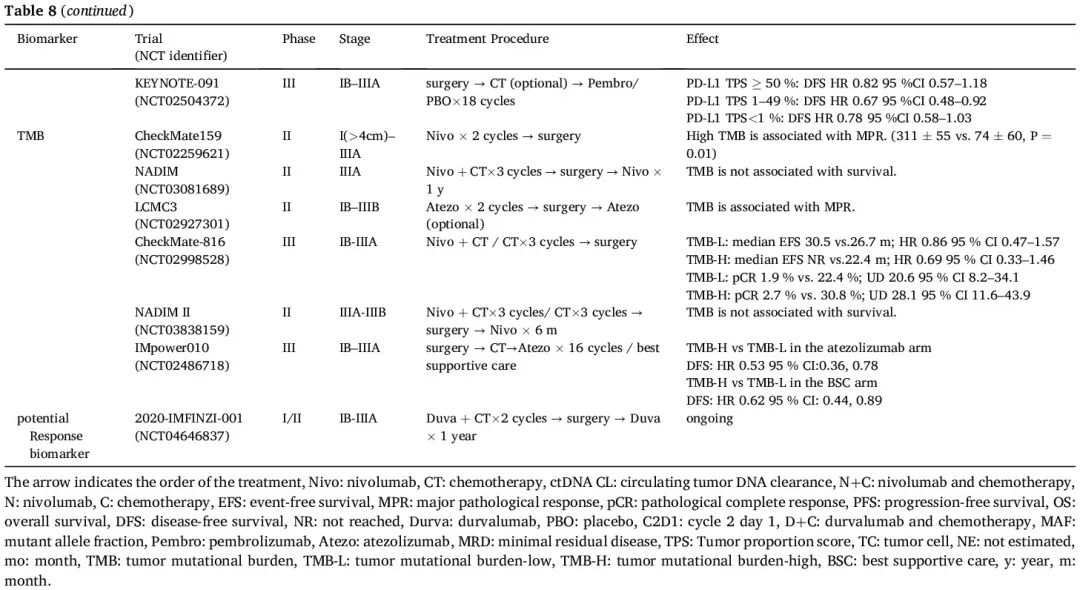
表8
肿瘤微环境相关生物标志物
与晚期 NSCLC 的治疗方法相比,早期 NSCLC 的 ICIs 新辅助治疗提供了机会评估肿瘤微环境中相关免疫细胞对 ICIs 的不同反应,以及通过直接评估治疗前组织标本和切除标本来识别潜在的生物标志物。CheckMate159 试验的研究人员发现,添加新辅助纳武利尤单抗通过 CD8 阳性/PD-1 阳性免疫细胞诱导肿瘤浸润增强。MPR 与肿瘤和外周血之间共同的 T 细胞克隆的频率较高以及 T 细胞群的克隆性较高有关。NEOSTAR 研究表明,将伊匹木单抗与纳武利尤单抗联合使用还可以减少活肿瘤,并加强肿瘤微环境中免疫细胞的浸润。在 CheckMate 816 中,高基线 4 基因炎症特征评分可能与纳武利尤单抗治疗更好的 EFS 和 pCR 概率增加相关,但与化疗无关。IONESCO 研究表明,DFS 与度伐利尤单抗治疗前活检标本中高 CD8 + TIM3 + 密度显著相关(HR 0.25,95% CI 0.09-0.71,p = 0.0092),与度伐利尤单抗治疗后手术标本中高 CD20 + 细胞密度显著相关(HR 0.36,95% CI 0.13-0.97,p = 0.04)。
液体活检相关生物标志物
ctDNA 已被验证是指导 II 期结直肠癌治疗决策的可靠生物标志物,并在 NSCLC 中显示出预测价值。因此,广泛研究了 ctDNA 动态变化作为早期 NSCLC 围手术期 ICI 的潜在生物标志物(表8)。在即将进行的试验中,预后标志物,特别是 ctDNA 清除,对定制围手术期治疗很关键。治疗后 ctDNA 清除有望成为新辅助化疗+免疫治疗后 EFS 生物标志物,尽管样本获取受限阻碍了明确的结论。几项研究表明,治疗后 ctDNA 清除或基线 ctDNA 水平低与病理缓解率较高和生存期较长相关。在对 AEGEAN 试验的探索性 ctDNA 分析 中,在每个新辅助治疗周期后,度伐利尤单抗组的 ctDNA 清除率高于安慰剂组,术前清除率分别为 66% 和 41%。目前该领域有几项临床试验正在进行中,包括 ADAPT-E 和 MK3475-A74。通过液体活检对 ctDNA 进行动态评估可能有助于制定个性化围手术期治疗,提高治愈潜力,同时最大限度地降低过度治疗风险。ctDNA-Lung-DETECT 研究探索了基于 MRD 的辅助治疗,结果显示,术前检测到 ctDNA 的患者肺癌复发率更高(16.7% vs 7.5%)。II 期 ctDNA 肺 RCT 试验评估了术前 ctDNA 检测是否有助于识别可从强化治疗中获益的接受手术切除的 I 期 NSCLC 患者, 其结果备受期待。然而,与转移性 NSCLC 患者相比,早期 NSCLC 患者的血浆 ctDNA 水平较低。目前,大多数 ctDNA 分析方法在治疗期间和之后检测 MRD 的灵敏度不够高。两项生物标志物驱动的基于MRD的试验 MERMAID-1 和MERMAID-2 由于MRD评估的复杂性和MRD检测工具不够灵敏而终止。开发高灵敏度的血液检测方法来确定全身性 MRD 对于预测癌症患者的预后至关重要。最近的一项研究表明,超灵敏 ctDNA 检测提高了早期 NSCLC MRD 临床灵敏度,有望用于风险适应试验。在晚期NSCLC中,在接受PD-1抑制剂治疗的患者中,较高的血液中性粒细胞/淋巴细胞比值以及骨髓/淋巴细胞比值与生存结局不良有关。NADIM 研究表明,新辅助免疫治疗可降低外周血中中性粒细胞/淋巴细胞、髓系细胞/淋巴细胞以及血小板/淋巴细胞比值。值得注意的是,pCR 患者的血小板/淋巴细胞比值显著较低。血细胞比值作为新辅助免疫治疗的预测性生物标志物的潜力需要进一步验证。
宿主相关标志物
肠道微生物组仍然是与抗肿瘤反应相关的重要因素。值得注意的是,在 NEOSTAR 试验中,两个研究组中达到 MPR 的患者都显示出有益的肠道微生物组特征,Akkermansia 的相对丰度较高,促炎和病原微生物水平较低。
OS的替代终点
在早期 NSCLC 试验中,OS 仍然是关键终点,但由于与晚期相比,达到的中位时间更长,使用起来可能具有挑战性。仅依赖长期 OS 作为基础可能会延长新疗法的审批过程,阻碍其快速临床实施。因此,探索 OS 的替代终点变得势在必行。PFS 和 EFS 通常作为大规模临床试验的主要终点,但目前较少的数据表明,在围手术期免疫治疗中 PFS/EFS 复合终点不能完全替代 OS。在新辅助免疫治疗领域,病理缓解已作为预后指标。NADIM 和 Checkmate159 研究的长期随访结果表明,pCR 率可以转化为生存获益,与 OS 具有很强的相关性。NADIM II 试验显示,pCR 是 PFS 和 OS 的替代指标。在 CheckMate 816、Neotorch、KEYNOTE-671 和 CheckMate-77T 试验中观察到 EFS 和 pCR 的相关性。需要进一步的数据来验证它们的替代效果。围绕 MPR 定义和可重复性的持续争论使其与 OS 的潜在相关性复杂化。未来利用人工智能平台可以提高 MPR 测定的准确性,从而加强其在新辅助化疗+免疫治疗试验中作为替代终点的有效性。
总 结
ICI 极大地改变了可切除 NSCLC 围手术期治疗范式。大量临床试验证明了围手术期 ICIs 治疗的可行性和有效性。NSCLC 围手术期 ICIs 的未来方向旨在个性化和精准治疗。然而,仍然存在各种挑战,包括确定从中获益最多的患者、选择最佳治疗方式、识别具有临床价值的生物标志物以及探索 OS 的替代终点。我们热切期待正在进行的试验的结果,以解决这些有争议的问题。
参考文献:
Siyuan Cui, Na Wang, Yangyueying Liang, Yuan Meng, Xinyi Shu, Fanming Kong, Advances in clinical trials on perioperative immune checkpoint inhibitors for resectable non-small cell lung cancer: A comprehensive review, International Immunopharmacology, Volume 141, 2024, 112903, ISSN 1567-5769, https://doi.org/10.1016/j.intimp.2024.112903.

作者:苏州绘真医学
版权声明:
本网站所有注明“来源:梅斯医学”或“来源:MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明“来源:梅斯医学”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言









#非小细胞肺癌# #免疫治疗#
23